Intra-uteriene inseminatie bij de hond

in: Recent avances in Small Animal Reproduction, P. W. Concannon, G. England and J. Verstegen (Eds.) Uitgever: International Veterinary Information Service (www.ivis.org), Ithaca, New York, Verenigde Staten.
Intra-uteriene inseminatie bij de hond met behulp van de Scandinavische Trans-cervicale katheter en een vergelijking met andere methoden ( 2-Feb-2001 )
C. Linde-Forsberg
Faculteit Diergeneeskunde, Departement verloskunde en Gynaecologie, Zweedse universiteit voor landbouwwetenschappen, Uppsala, Zweden
Inleiding
de belangstelling voor preservering en kunstmatige inseminatie van hondensperma (AI) neemt wereldwijd gestaag toe, maar er worden elk jaar relatief weinig studies op dit gebied gepubliceerd en het is bijzonder moeilijk gegevens te vinden van kunstmatige inseminaties met vers sperma of sperma dat volgens verschillende methoden voor koelen, invriezen en ontdooien is geconserveerd, en ook de resultaten te vergelijken wanneer verschillend technieken om de inseminaties uit te voeren worden gebruikt. Een reden voor de schaarste van gegevens is dat het duur is om experimentele studies te doen bij honden, en weinig onderzoekscentra kunnen groot genoeg hond kolonies te houden voor dit soort studies. Een andere reden is dat de meeste grote bedrijven die hondensperma voor hondenfokkers verwerken en distribueren, op een zuiver commerciële basis werken en hoewel sommigen van hen een register van hun resultaten lijken bij te houden, worden deze resultaten noch de samenstelling van de vulstoffen noch de methoden voor de bewaring van het sperma onthuld. De aldus verkregen kennis zal dus bij de verschillende bedrijven blijven en niet ten goede komen aan de wetenschappelijke wereld, en dus ook niet aan de hondenfokkers in het algemeen. De enige studies over kunstmatige inseminatie van honden die melding maken van vruchtbaarheidsresultaten van een groot aantal inseminaties zijn die van Seager et al., op 156 bevroren ontdooid Sperma AIs met vaginale depositie, Linde-Forsberg & Forsberg op respectievelijk 470 en 527 AIs, met zowel vers, gekoeld uitgebreid en bevroren ontdooid sperma en vaginale en intra-uteriene AI, Linde-Forsberg et al., on 327 frozen-thiewed semen AIs, comparing vaginal and intra-uterine AI, Linde-Forsberg reporting on 2041 AIs with fresh and chilled extended, and frozen-thiewed semen and using both vaginal and intra-uterine AI, and Thomassen et al., op 312 bevroren-ontdooid voornamelijk intra-uteriene AIs. Een aantal factoren zijn van belang bij het bepalen van het slagingspercentage van kunstmatige inseminatie bij honden, zoals wanneer en hoe vaak tijdens de oestruscyclus van de teef de AI wordt uitgevoerd, sperma kwaliteit en behandeling, en de inseminatie techniek. Meer informatie over deze facetten is te vinden in de geciteerde referenties. In dit artikel wordt alleen ingegaan op de inseminatietechnieken en de effecten van de plaats van spermadepositie. De recente klinische studies hebben gewezen op het belang van intra-uteriene in tegenstelling tot intravaginale kunstmatige inseminatie bij de hond en zijn de eerste om aanzienlijk betere resultaten aan te tonen wanneer sperma werd afgezet in de baarmoeder in plaats van in de vagina. In de studie van Linde-Forsberg et al. het werppercentage bij gebruik van intra-uteriene afzetting van bevroren sperma was 84,4% in vergelijking met 58.9 % bij gebruik van vaginale afzetting, en de gemiddelde nestgrootte was 5,4 + 3,0 vergeleken met 4,0
+2,7 pups/nest (P<0,001). Vruchtbaarheid gegevens van 2041 kunstmatige inseminaties zijn honden, uitgevoerd in Zweedse teven tussen 1990 en 1998 en gemeld aan de Kennel Club binnen 2 weken, (d.w.z. voordat een zwangerschapstest had kunnen worden uitgevoerd om vertekening van de resultaten te voorkomen), bleek dat aanzienlijk hogere werpcijfers en worpgroottes werden verkregen, niet alleen met bevroren ontdooid sperma, maar ook met vers, evenals gekoeld, uitgebreid sperma wanneer het sperma in de baarmoeder in plaats van in de vagina was afgezet (Tabel 1).

de resultaten met vers sperma, weergegeven in Tabel 1, zijn iets te hoog omdat 11% van deze teven om verschillende redenen niet alleen kunstmatig geïnsemineerd maar ook gedekt werd. De meest voorkomende reden hiervoor was dat de fokkers de teven te vroeg probeerden te paren tijdens de estrus en wanneer de honden niet wilden paren, vroegen hun baasjes om een AI. Het werpcijfer in de eveneens gepaard gaande groep was zo hoog als 84,5%, met een gemiddelde worpgrootte van 6,0 + 2,8 pups, vergeleken met een werpcijfer van 48,9% en een gemiddelde worpgrootte van 5,8 + 2,8 pups voor de teven die alleen kunstmatig geïnsemineerd werden. Het blijkt, daarom, dat een aantal van de AIs die worden uitgevoerd met vers sperma daadwerkelijk worden gedaan op een niet-optimale tijd tijdens de estrus, meestal als gevolg van onervarenheid van de fokker, maar de relatief slechte resultaat is waarschijnlijk ook te wijten aan dat AI wordt gevraagd vanwege verschillende problemen bij de honden. De Zweedse gegevens tonen echter duidelijk aan dat intra-uteriene AI bij de hond de werpfrequentie en de nestgrootte aanzienlijk verbetert. Het werppercentage door intra-uteriene AI steeg met 36% voor vers sperma tot 50% voor bevroren ontdooid sperma, in vergelijking met vaginale AI. En bij intra-uteriene AI nam de gemiddelde nestgrootte toe met 0,3 jongen per nest voor bevroren sperma en met 0,6 en 0,7 per nest voor vers en gekoeld uitgebreid sperma. Het is ook interessant in deze context op te merken dat de hond wordt beschouwd als een soort met intra-uteriene afzetting van sperma bij natuurlijke paring, omdat tegen de tijd dat de copulatoire band voorbij is, de spermatozoa de eileiders hebben bereikt . De sperma rijke fractie wordt geëjaculeerd bij intromissie en tijdens het vroege stadium van de copulatoire band, en wordt gevolgd door een groot volume van prostaatvloeistof die onmiddellijk spoelt de spermatozoa uit de smalle craniale vagina via de baarmoederhals in de baarmoeder lichaam en hoorns. De vagina lijkt een ongunstige omgeving voor honden spermatozoa te bieden, omdat een groot deel hun staarten verliest binnen enkele minuten na afzetting in de schedel vagina . Het is ook aangetoond dat ongeveer 10 keer zoveel spermatozoa nodig zijn om vergelijkbare resultaten te verkrijgen door vaginale AI als door intra-uteriene AI met vers sperma , evenals met bevroren ontdooid sperma . Er zijn dus vele factoren die bijdragen tot de slechtere resultaten van intravaginale spermadepositie in vergelijking met intra-uteriene depositie.
methoden voor Intra-uteriene AI bij de hond.
Intra-uteriene AI bij de hond kan transcervicaal worden gedaan door middel van de Scandinavische (of Noorse) katheter, of door gebruik te maken van een stijve fiberoptische vaginale endoscoop om de baarmoederhals te visualiseren en een hond urinaire katheter om deze transversaal te maken. Intra-uteriene AI kan ook door invasieve methodes zoals laparoscopie, of volledige buikchirurgie worden bereikt. In sommige landen kunnen deze methoden illegaal zijn of ethisch niet aanvaardbaar worden geacht.
palpatie van de baarmoederhals
Het is absoluut noodzakelijk dat de persoon die honden AI wil uitvoeren, leert hoe hij de baarmoederhals kan lokaliseren door middel van abdominale palpatie om het sperma op de juiste plaats te kunnen deponeren en het teefje niet te verwonden. De teef moet een lege maag en blaas om de procedure te vergemakkelijken. Voor trainingsdoeleinden wordt aanbevolen gebruik te maken van de plastic canine vaginale AI-katheters voor eenmalig gebruik (Minitüb GmbH, Tiefenbach, Duitsland) (Fig. 1).
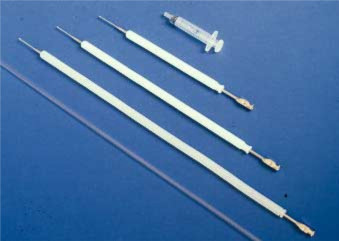
figuur 1. De drie maten van de Scandinavische kunstmatige inseminatie katheter voor honden, en de plastic single-use vaginale kunstmatige inseminatie katheter.
omdat de uretherale opening van de teef zich aan de bekkenrand bevindt, is het verrassend gemakkelijk dat de AI-katheter, of een dunne stijve Endoscoop, onbedoeld in de urineblaas wordt ingebracht. Afgezien van de gevaren van het perforeren van de blaas met de katheter, is het duidelijk dat er geen zwangerschap zou volgen na een AI. Daarom moet de juiste positie van de katheter altijd worden gecontroleerd door palpatie voordat een spermadosis wordt gedeponeerd. Als de katheter zich in de urineblaas bevindt, kunnen het schedelgedeelte van de vagina en de baarmoederhals boven de katheter worden gepalpeerd. De wanden van de urineblaas zijn meestal dunner dan die van de vagina, en de punt van de katheter onderscheidt zich duidelijker dan als het in de vagina. Om de baarmoederhals te palperen, wordt een AI-katheter in de vagina van de teef ingebracht. De introductie van de katheter wordt vergemakkelijkt als de vulva wordt verhoogd tot vlak onder de anus (zoals wanneer de teef staat voor de reu). Wanneer de punt van de katheter zo ver wordt ingebracht als onmiddellijk craniaal aan de bekkenrand, moet deze worden gepalpeerd. Craniaal de vagina in de meeste teven hellingen iets naar beneden. In sommige rassen, echter, vooral het zicht honden met een zeer gebogen lendenen, de vagina heeft een meer dorsale richting. Het schedeluiteinde van de katheter moet nu dichter bij de buikwand worden verlaagd om toegankelijker te worden voor palpatie. Wanneer de kathetertip gepalpeerd kan worden en de juiste positie in de vagina dus gecontroleerd kan worden, wordt deze zorgvuldig verder ingebracht, onder voortdurende palpatorische controle, totdat deze het paracervicale gebied bereikt. Dit is het smalle, craniale gedeelte van de vagina gemaakt door de dorsale, mediane post-cervicale plooi en kan worden gepalpeerd als een 1 tot 2 cm lange, stevige structuur. Het eindigt bij de baarmoederhals, die in een teef in estrus is een 0,5 tot 1,5 cm harde, afgeronde-tot-eivormige vrij beweegbare structuur. Het is meestal niet mogelijk om de buitenste beschermhuls van de Scandinavische katheter, die een diameter van 10 mm heeft, in het paracervicale gebied te brengen. Ook de dunnere plastic AI katheter, die een diameter van 5 mm heeft, kan te breed zijn om in het paracervicale gebied in sommige teven te introduceren, vooral die van de kleinere rassen, of die die niet hebben bevallen van een nest van pups. Zodra de baarmoederhals is geïdentificeerd, kunnen de baarmoederhals en de baarmoederhoorns voor deze structuur worden gepalpeerd. Laat de punt van de katheter zakken en sluit vervolgens de punt van de duim tegen die van de wijsvinger boven de katheter, til vervolgens het schedeluiteinde van de katheter zodanig op dat de baarmoederhals en de baarmoederhoorns tussen de vingers omhoog worden getrokken. Hun omvang en consistentie worden dan duidelijk. (Deze methode van palpatie van de baarmoeder is ook zeer nuttig voor vroege drachtigheid detectie en om teven met vermoedelijke pyometra te onderzoeken).
Intra-uteriene inseminatie met behulp van de Scandinavische katheter
de Scandinavische katheter bestaat uit een 1 – 2 mm brede stalen katheter met een 0.Tip met een diameter van 75 mm tot 1 mm, en is verkrijgbaar in drie verschillende lengtes: 20, 30 of 40 cm. Het wordt gebruikt in combinatie met een 10 mm diameter buitenste beschermende nylon mantel (Fig. 1 en Fig. 2). De middelgrote katheter past bij de meeste kleine en middelgrote teven. De uitrusting is verkrijgbaar bij de Norwegian Fur Breeders ‘ Association, P. O. Box 136, Økern, n-0509 Oslo 5, Noorwegen.

Figuur 2. Een close-up van de twee maten tips van de Scandinavische AI katheter voor honden.
Intra-uteriene AI met de Scandinavische katheter wordt uitgevoerd met de teef die op de vloer of op een tafel staat. Sedatie is zeer zelden nodig; integendeel, de meeste teven in de estrus accepteren dit soort behandeling vrij. Indien een lichte sedatie vereist is, bijvoorbeeld bij een zeer grote, zwaarlijvige of nerveuze teef, kan 1 – 3 mg/kg xylazine IM of IV worden gebruikt. De binnenste stalen katheter, met de punt binnenin en beschermd door de nylon schede, wordt in de vagina ingebracht. Het schedeluiteinde van de nylon schede wordt gepalpeerd voor de bekkenrand zoals eerder beschreven. Als de punt van de katheterschede dichter bij de buikwand is neergelaten, wordt de baarmoederhals meestal enkele cm vóór en erboven gevonden. De stalen katheter wordt vervolgens door de schede geleid totdat de punt de ventrale fornix bereikt. De baarmoederhals wordt tussen de duim en de wijsvinger gefixeerd en, door een iets neerwaartse trekkracht op het baarmoedercorpus aan te brengen, wordt deze zo gekanteld dat de hoek van het cervicale kanaal meer horizontaal wordt (Fig. 3).
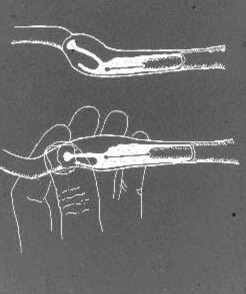
Figuur 3. Een schematische tekening van het canine paracervicale gebied en het cervicale kanaal, met de Scandinavische katheter in positie in de schedelvagina. Door manipulatie bij de baarmoederhals en de baarmoederhals wordt de hoek van de baarmoederhals veranderd om de baarmoederhals beter af te stemmen op de punt van de katheter om de katheterisatie te vergemakkelijken.
De Punt van de katheter wordt dan voorzichtig teruggetrokken terwijl deze herhaaldelijk tegen het oppervlak van de baarmoederhals wordt gedrukt op zoek naar de opening van het cervicale kanaal. De sensatie wanneer deze opening wordt gevonden kan in de meeste gevallen worden omschreven als het gevoel van het aanraken van kraakbeen, dat wil zeggen “knapperig”. Zodra de opening is gevonden, bevestig de katheter en begin met het werken van de baarmoederhals tegen de katheter. Het cervicale kanaal is 5 tot 10 mm lang en niet altijd helemaal recht. Zo kan een lichte druk moeten worden toegepast, terwijl het draaien van de katheter te verlichten door. Bij de meeste teven is de punt van de katheter gemakkelijk voelbaar voor de baarmoederhals in het corpus uteri. Bij sommige teven is de sensatie echter niet zo duidelijk. De spuit met sperma is verbonden met de katheter en het sperma langzaam geïnfundeerd in de baarmoeder. Soms is er een weerstand tegen infusie afhankelijk van of de opening van de katheter drukt tegen het endometrium mucosa. Een lichte neerwaartse tractie van het corpus uteri of de baarmoederhals verlicht meestal de situatie en laat sperma infusie. Om te controleren of de katheter echt in de baarmoeder van de teef 1 – 2 ml fysiologische zoutoplossing kan worden toegediend. Als de katheter in de juiste positie in het baarmoederlichaam is, kan de vloeistof gemakkelijk worden toegediend. Als, aan de andere kant, de katheter in het paracervicale gebied, zal er een bijna onmiddellijke terugstroom van zoutoplossing tussen de katheter en de nylon mantel. De katheter wordt verwijderd en de achterhand van de teef wordt verhoogd en de teef in deze positie gehouden gedurende 5 – 10 minuten na de AI om terugstroom van sperma te minimaliseren en om baarmoedertransport van spermatozoa naar de eileiders te vergemakkelijken . De teef moet ook worden gevederd rond het perineale gebied als dit wordt verondersteld om baarmoeder samentrekkingen te stimuleren. Om deze techniek te leren vereist enige oefening, maar eenmaal geleerd is het een snelle methode, meestal wordt bereikt binnen enkele minuten. Het wordt aanbevolen om in eerste instantie orgaanmonsters te verkrijgen voor opleidingsdoeleinden en anatomisch onderzoek. Het is ook een voordeel als vooral de eerste pogingen worden gedaan bij teven die een of meer nesten hebben gebaard, omdat ze meestal veel gemakkelijker te katheteriseren zijn. Perforaties kunnen optreden als de katheter blindelings of met kracht wordt ingebracht. Op voorwaarde dat de katheterisatie wordt uitgevoerd onder zorgvuldige palpatorische controle, echter, de techniek is volledig veilig voor de teef. Sommige teven zijn moeilijker te katheteriseren, met name die behoren tot een aantal van de gigantische rassen, evenals zwaarlijvige of nerveuze dieren. Het gebruik van de Scandinavische katheter was slechts tussen 2 en 3,5% van de pogingen tot intra-uteriene katheterisatie mislukt . Het resultaat van de werpcijfers met diepgevroren ontdooid sperma is 84.5%, en 71% indien uitgevoerd door ervaren inseminators, gemiddeld 65% met vers en gekoeld sperma en 52% met bevroren ontdooid sperma, in een groter veldonderzoek waarbij ook minder ervaren inseminators betrokken waren (Fig. 1). Deze techniek kan ook worden gebruikt voor intra-uteriene infusie van contrastmiddel voor hysterografisch onderzoek van de teef .
Intra-uteriene inseminatie met endoscopische visualisatie van de baarmoederhals
transcervicale intra-uteriene inseminatie kan ook worden bereikt met behulp van een stijve fiberoptische endoscoop en een urinaire of angiografische katheter, op de staande teef, en zonder sedatie (Fig. 4 en Fig. 5).

Intra-uteriene inseminatie met behulp van laparoscopie
abdominale laparoscopie moet een iets acceptabeler alternatief bieden voor volledige chirurgie voor AI bij de hond. De techniek is beschreven door Wildt en Silva et al. . Een zwangerschapspercentage van 60 tot 73% is gemeld door AI met behulp van laparoscopie, maar het aantal teven in die studies was gering.
Intra-uteriene inseminatie met behulp van chirurgie
chirurgie om intra-uteriene inseminatie uit te voeren is gemeld . Er zijn verschillende chirurgische ingrepen uitgevoerd, met de teef onder algehele narcose en in rugliggen. De buikholte wordt geknipt, en na routine chirurgische voorbereiding wordt een 4 -6 cm incisie gemaakt halverwege tussen de pubis en de navel, door de linea alba. De baarmoeder wordt verhoogd door de incisie, en de naald van de spuit met het sperma wordt ingebracht in het lumen van de baarmoeder lichaam onder een 45o hoek met de schuine kant van de naald omhoog. Het sperma wordt langzaam in de baarmoeder geïnjecteerd. Het moet gemakkelijk stromen met duidelijke uitzetting van de baarmoederhoorns, of anders moet de naald worden verplaatst. Nadat de naald is opgezogen, wordt een zoutoplossing bevochtigd gaasje op de injectieplaats gehouden. Na 1 min. wordt het gaas verwijderd, wordt de baarmoeder vervangen in de buik en wordt de wond gesloten met behulp van routine-methodologie. Om terugstroom van sperma te voorkomen moet de teef worden geplaatst met haar achterste verhoogd als ze herstelt van anesthesie . Rond 60% zwangerschap is gemeld na chirurgische AI bij de hond, maar net als bij laparoscopische AI resultaten zijn gebaseerd op beperkte experimentele studies en geen veldgegevens beschikbaar zijn voor evaluatie met behulp van beide methoden. Of het ethisch aanvaardbaar is om een beroep te doen op chirurgie om zwangerschappen te bereiken is discutabel. De methode, hoewel bepleit door sommigen, wordt door velen beschouwd als onethisch en onaanvaardbaar stressvol voor de teef. De risico ‘ s voor infectie, enz. geassocieerd met chirurgie in het algemeen en het beperkte aantal chirurgische AI ‘ s die kunnen worden uitgevoerd in een bepaalde teef zijn twee duidelijke nadelen. De methode is ook duur en tijdrovend.
1. Seager SWJ, Platz CC, Fletcher WS. Conceptie tarieven en gerelateerde gegevens met behulp van bevroren hond sperma. J Reprod Fertil 1975; 45: 189-192.
2. Linde-Forsberg C, Forsberg M. Fertility in dogs in relation to semen quality and the time and place of insemination. J Reprod Fertil 1989; 39 (Suppl): 299-310. – PubMed –
3. Linde-Forsberg C, Forsberg M. Resultaten van 527 gecontroleerde kunstmatige inseminaties bij honden. J Reprod Fertil 1993; 47 (Suppl): 313-323. – PubMed –
4. Linde-Forsberg C, Ström Holst B, Govette G. Comparison of fertility data from vaginal vs intrauterine insemination of frozen-thawed dog semen: A retrospective study. Theriogenology 1999; 52: 11-23. – PubMed –
5. Linde-Forsberg C. Vruchtbaarheidsgegevens uit 2041 gecontroleerde kunstmatige inseminaties bij honden. In: Proceeding of the 4th int Symp Canine Feline Reprod, Oslo, 2000, 120 p.(abstr.)
6. Thomassen R, Farstad W, Krogenaes, A, Fougner, J. A. en Andersen Berg K. Kunstmatige inseminatie met bevroren sperma in de hond. Een retrospectieve studie. J Reprod Fertil 2001, in press.
7. Tsutsui T, Kawakami E, Murao I, et al. Transport van spermatozoa in het voortplantingskanaal van de teef: waarnemingen door uteriene fistels. Jpn J Vet Sci 1989; 51: 560-565. – PubMed –
8. Linde-Forsberg C. kunstmatige inseminatie met vers, gekoeld uitgebreid en bevroren ontdooid sperma in de hond. Seminaries in Vet Med Surg (Small Animal) 1995; 10: 48-58.
9. Tsutsui T, Tezuka T, Shimizu T, Murao I, Kawakami E, Ogasa A. Kunstmatige inseminatie met vers sperma in Beagle teven. Jpn J Vet Sci 1988; 50: 193-198.
10. Andersen K. inseminatie met diepvriessperma op basis van een nieuwe inseminatietechniek. Zuchthyg 1975; 10: 1-4.
11. Linde C. Transport van radiopake vloeistof in de baarmoeder na vaginale afzetting in de oestrus teef. Acta vet scand 1978; 19: 463-465.
12. Funkquist B, Lagerstedt A-S, Linde C, Obel N. Hysterography in the bitch. Vet Radiol 1985; 26: 12-18.
13. Wilson M. niet-chirurgische intra-uteriene kunstmatige inseminatie bij teven met diepvriessperma. Wedstrijden In Congo-Brazzaville; 47 (Suppl): 307-311. – PubMed –
14. Battista M, Parks J, Concannon PW. Hoeds sperma na ontdooien overleving na bevriezing in rietjes of pellets met behulp van leidingen, lactose, tris of test extenders. In: Proceedings of the 11th Int Congr Anim Reprod and AI, Dublin 1988; 3: 229-231.
15. Wildt DE. Laparoscopie. In: Burke TJ, ed. Voortplanting en onvruchtbaarheid van kleine dieren. Philadelphia: Lea & Febiger, 1986;121-140.
16. Silva LDM, Onclin K, Snaps F, Verstegen JP. Laparoscopische intra-uteriene inseminatie in de teef. Theriogenology 1995; 43: 615-623.
17. Silva LDM, Verstegen JP. Vergelijkingen tussen drie verschillende extenders voor Canine intra-uteriene inseminatie met bevroren ontdooide spermatozoa. Theriogenology 1995; 44: 571-579.
18. Silva LDM, Onclin K, Lejeune B, Verstegen JP. Vergelijkingen van intravaginale en intra-uteriene inseminatie van teven met vers of bevroren sperma. Vet Rec 1996; 138: 154-157. – PubMed –
19. Smith FO, Graham EF: Cryopreservation of canine semen: Technique and performance. In: Proceedings of the Xth Int Congr Anim Reprod and AI, Champaign-Urbana 1984; 2: 216.
20. Hutchison RV. Vaginaal & chirurgische intra-uteriene afzetting van sperma. In: Proceedings of the Canine Theriogenology Short Course 1993; 33-37.
21. Hutchison RV. Het maximaliseren van conceptie tarieven met behulp van vers gekoeld of bevroren canine sperma. In: Proceedings of the Canine Male Reprod Symp 1997; 61-70.