Het ontwerp van FRET-TaqMan-sondes voor multiplex real-time PCR gebruikend een interne positieve controle
Inleiding
real-time PCR laat ononderbroken controle van fluorophore fluorescentie toe tijdens de generatie van PCR-producten in een gesloten buisformaat. Momenteel, gebruiken de beschikbare methodes of geëtiketteerde sondes of DNA intercalating kleurstof om de versterking van PCR-product te controleren. De Taqman-sonde is single-stranded oligonucleotide die fluorophore en quencher bevatten geplaatst 10-30 basissen apart. De Taqman-sonde wordt gehydrolyseerd tijdens de versterking toe te schrijven aan de dubbel-bundel–specifieke exonucleaseactiviteit van de Taq-polymerase die fluorophore van de quencher scheidt, resulterend in fluorescentieverhoging. De Real-time PCR-instrumenten zijn uitgerust met fluorescentiedetectors en software geschikt om de cyclusdrempel (Ct) te schatten, de cyclus waarbij de fluorescentie groter is dan achtergrondfluorescentie, voor positieve reacties. Nochtans, kan de techniek geen echt negatief resultaat van vals negatief onderscheiden wanneer PCR door versterkingsinhibitors wordt beà nvloed. Na nucleïnezuurextractie, wordt gemeld dat de inhibitors nog aanwezig kunnen zijn uit klinische steekproeven (b. v., hemoglobine), milieumonsters (b.v., humus-en fulvic zuren), en chemische producten tijdens nucleïnezuurextractie (b. v., ethanol, detergenten, of chaotropic agenten). De betrouwbaarheid van diagnostische analyses wordt verhoogd door de opname van een intern controlenucleic zuur dat de aanwezigheid en het effect van PCR-inhibitors (1,2) kan aangeven. Een interne positieve controle (IPC) wordt vergroot gelijktijdig in aanwezigheid van een doelopeenvolging gebruikend geëtiketteerde fluorophore die licht bij een verschillende golflengte dan fluorophore uitzendt die voor de analyse van de doelopeenvolging wordt gebruikt, met twee fluorophores die in verschillende kanalen door het real-time PCR-instrument worden ontdekt. De algemeen gebruikte interne controle voor PCR is een plasmide die een opeenvolging gelijkend op dat van het analysedoel behalve sondegebied bevat. Een beperkt aantal IPC molecules wordt toegevoegd aan individueel testdoel en mede-versterkt met het doelnucleic zuur; aldus, is een positief IPC signaal bewijsmateriaal dat de versterkingsreactie voldoende ging om een positief signaal van zeer kleine hoeveelheden doelnucleic zuur te produceren. Deze eigenschap is belangrijk om gelijkwaardige versterking van IPC en doelnucleic zuur (3-9) te verzekeren. Echter, sommige apparaten-zoals de LightCycler 1.2 en LightCycler 2 (Roche Applied Science, Indianapolis, IN, USA), de robuuste geavanceerde pathogeen identificatie apparaat (R. A. P. I. D.) instrument (Idaho Technology, Salt Lake City, UT, USA), en handheld real-time PCR—instrumenten-zijn slechts uitgerust met één lichtbron en bijbehorende emissiekanaal. Het Multiplexing op deze types van instrumenten vereist het gebruik van multi-geëtiketteerde oligonucleotides en het concept van de de overdrachtsenergie van de fluorescentieresonantie (lijstwerk). Nochtans, kunnen de sondes van het lijstwerk aan ontwerp uitdagend zijn en kunnen robuustheid in hypervariable gebieden en wanneer niet-optimale versterkingsvoorwaarden aanwezig zijn ontberen. Het gebruik van sondes van het lijstwerk vereist de identificatie van twee gebieden voor twee sondes. Het systeem van de LIJSTSONDE vertrouwt op aangrenzende kruising van oligonucleotides van de twee enig-geëtiketteerde sondes op zodanige wijze de fluorescentie van de acceptorkleurstof wordt ontdekt door de opwinding van fluorophore in bijlage aan de tweede sonde. Een belangrijk nadeel van de sonde van het lijstwerk is het vereiste van een groter opeenvolgingsgebied dat nodig is om twee aangrenzende sondes met een hiaat van 2-5 nucleotiden aan te passen. De mogelijkheid bestaat om te multiplexen met andere labelsystemen, zoals MegaStokes dye (DYXL; Dyomics, Jena, Duitsland) en Pulsar 650 (Biosearch Technologies, Inc., Novato, CA, USA), maar deze etiketteringssystemen vereisen spectrale informatie om te compenseren voor channel crosstalk en zijn niet op grote schaal beschikbaar. De die lijstwerk-TaqMan sonde in deze studie wordt ontwikkeld, nochtans, vereist geen software van de kleurencompensatie en gebruikt fluorophores (FAM, Cy5.5) die wijd beschikbaar zijn. Dit rapport richt zich op het ontwerp van een triple-label sonde om multiplexing mogelijk te maken in instrumenten die zijn uitgerust met slechts één blauwe lichtemitterende diode (LED) excitatie bron (470 nm) en bijbehorende drie overeenkomstige detectiekanalen (bijvoorbeeld 530 nm, 640 nm en 705 nm).
materialen en methoden
Probe design principle
alle experimenten werden uitgevoerd met het R. A. P. I. D.-systeem van Idaho Technology, een 32-Monster draagbare real-time PCR-instrument uitgerust met een blauwe LED voor excitatie (470 nm) en bijbehorende drie fluorescentiedetectiekanalen die de fluorescentie meten bij 530, 640 en 705 nm voor mono-en dual-color assays. Primers JVAF en JVAR (10) en probe 5′-FAM/BHQ-1 werden gesynthetiseerd bij de CDC Biotechnology Core Facility (Atlanta, GA, USA) en probe 5 ‘FAM-Cy5.5/3′ HQ-3 werd gesynthetiseerd bij Idaho Technology. Om duplex TaqMan PCR mogelijk te maken, werd één sonde geëtiketteerd met 5’-FAM/BHQ-1 (520-nm fluorescentie golflengte) en een andere met 5 ‘FAM-Cy5.5/3’ HQ-3 (705-nm fluorescentie golflengte). In oplossing, blijft de sonde geëtiketteerd met 5 ‘FAM-Cy5. 5/3’ HQ-3 geblust bij hybridisatie aan een opeenvolging, en bij volgende splitsing van de sonde door enzymatische primeruitbreiding, wordt de quencher geëlimineerd. Dit resulteert in FRET door de opwinding van FAM door de lichtbron van het R. A. P. I. D. instrument. De opwindingsenergie wordt overgebracht naar acceptor fluorophore, Cy5.5, en de uitgezonden fluorescentie wordt gemeten in een tweede fluorescentiekanaal (fluorescentiekanaal F3 voor het R. A. P. I. D.-instrument). De emissie van CY5. 5 fluorescentie is het resultaat van de combinatie van FRET en Taqman-sondetechnieken, zodat kunnen deze triple-geëtiketteerde sondes als “FRET-TaqMan” sondes worden bedoeld.
Primers, probes en plasmide
om de multiplexing mogelijkheden van het FRET-TaqMan ontwerp aan te tonen, gebruikten we een genus-specifieke Cryptosporidium real-time PCR-test om een 159-bp deel van het 18S rRNA gen te amplificeren (10). De forward primer (JVAF) was 5′-ATGACGGGGGGGGAAT-3′, reverse primer (JVAR) was 5′-CCAATTACAAAAC-CAAAAAGTCC-3′, en TaqMan probe (JVAP) was 5′-FAM-CGCGCCTGCT-GCCTTCTTAGATG-BHQ1–3′, overeenkomend met nucleotiden 100-118, 258-236, en 184-161, respectievelijk van GenBank toetreding Nee. AY458612. Primers voor de constructie van de Cryptosporidium IPC bevatten dezelfde reeks primer sequenties gerapporteerd voor amplificatie van Cryptosporidium spp., behalve voor het probe-bindende gebied van doeldna, dat met de kunstmatige opeenvolging 5′-TTGTGCTCGTAGTCGCCTCTGTCTCTCT-3′ (JPIPC) werd vervangen. Deze sondevolgorde had een gloeitemperatuur van 69°C en werd ontworpen om geen secundaire structuur te hebben. De theoretische specificiteit voor de interne sonde werd vastgesteld door een BLAST (11) Onderzoek van de sonde en primer sequenties waarbij geen exacte overeenkomst werd gevonden met een Cryptosporidium sequentie. Het IPC-fragment werd samengesteld en gekloond tot een plasmide door geïntegreerde DNA-technologieën (Coralville, IA, USA). Een bekende concentratie van plasmide DNA (100 kopieën/reactie) werd toegevoegd aan de master mix van alle reacties behalve in negatieve controle. Een triple-label sonde (JPIPC) specifiek voor de IPC werd gesynthetiseerd door Idaho technologie, zoals weergegeven in Figuur 1. De FAM/Cy5.5 / BHQ3 oligo-nucleotide probe werd gesynthetiseerd vanaf het 3′ einde met niet-fluorescerende Zwarte Gat Quencher (BHQ-3) gecontroleerde porieglas (CPG). Het 5 ‘einde werd vervolgens geconjugeerd met een Cy5.5 phosporamidiet gevolgd door een terminal 5’ fluoresceïne (6-FAM) phosporamidiet.
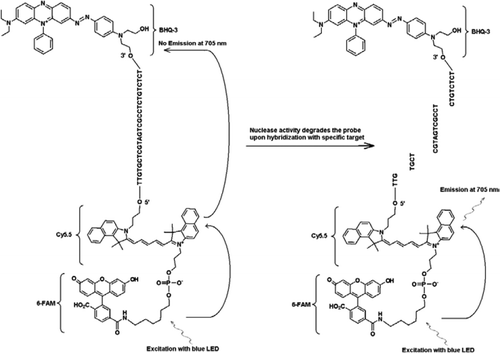
de FRET-TaqMan sonde bevat drie labels: een zwart gat quencher deel aan het einde van de 3′ – arm, een emitter fluorophore (Cy5.5), en een harvester fluorophore (FAM) samengevoegd aan het einde van zijn 5′ – arm. De FAM absorbeert efficiënt energie uit blauwe LED als lichtbron. Bij afwezigheid van doelwitten is de sonde donker omdat de door de FAM geabsorbeerde energie wordt overgebracht naar Cy5, 5 en op zijn beurt de energie die uit Cy5 vrijkomt.5 wordt overgebracht naar de quencher en gaat verloren als warmte-energie. In aanwezigheid van doelstellingen, wordt de Taqman-sonde gespleten door de activiteit van Taq-polymerase en wordt de quencher vrijgegeven en de energie die door FAM wordt geabsorbeerd wordt overgebracht aan Cy5.5 door LIJSTWERKMECHANISME om fluorescentie bij 705 nm uit te zenden.
Real-time PCR-test
flowcytometrie gesorteerde Cryptosporidium parvum oöcysten (200 oöcysten per tube) verkregen van het State Laboratory of Hygiene van de Universiteit van Wisconsin (Madison, WI, USA). DNA van C. parvum oöcysten werd geëxtraheerd met behulp van een protocol beschreven door Hill et al. (12) en gesuspendeerd in 80 µL Tris EDTA (te, pH 8.0) buffer. Twee micro-liter DNA werden toegevoegd per reactie, die overeenkwam met 5 oöcysten (equivalent aan 100 kopieën van doeldna). Het amplificatie reactiemengsel bestond uit Quantifast Probe PCR + ROX kit reactiemengsel (Cat. no. 204354; Qiagen) zonder rox toegevoegd, JVAF, jvar primers (elk 0,4 µM), jvap sonde (0,2 µM), JPIPC sonde (0,2 µM), en 100 kopieën van de IPC. Een aliquot (2 µL) van het geëxtraheerde DNA-monster werd toegevoegd aan het reactiecapillair (Roche Diagnostics, Indianapolis, IN, USA) met een reactiemengsel van 18 µL. Een C. parvum genomic DNA positieve controle (Figuur 2, plot 1), het plasmide IPC (Figuur 2, plot 2), een mengsel van de C. parvum positieve controle en de IPC (Figuur 2, plot 3), en een no-template controle (NTC) bestaande uit nucleasevrij water (Cat. geen. AM9932; Ambion, Foster City, CA, USA) in plaats van het DNA (Figuur 2, plot 4) werden opgenomen in elk experiment. Het protocol nam ∼30 min om met de volgende PCR voorwaarden te voltooien: denaturatiestap met warme start bij 95°C gedurende 3 min, gevolgd door 45 cycli met een denaturatie van 95 ° C gedurende 5 s, 60 ° C gloeien gedurende 30 s met één fluorescentie-acquisitie (met een temperatuurhelling van 20°C/s). Een positief resultaat werd geregistreerd voor FAM in kanaal F1 (530 nm) en voor Cy5, 5 in kanaal F3 (705 nm). De versterkingsreacties werden in drievoud uitgevoerd. Amplicons (159 bp) werden gevisualiseerd door agarose gelelektroforese en Glow-Green nucleïnezuurkleuring (eEnzyme, Gaithersburg, MD, USA) om de specificiteit van het PCR-product te bevestigen.
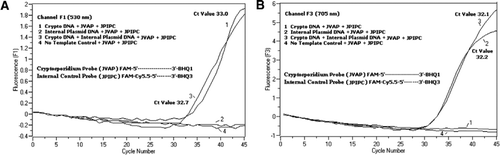
in alle PCR-reactiemengsels is een equimolair mengsel van een FAM/BHQ1 en een FAM/Cy5, 5/BHQ3 toegevoegd. (A) Kanaal F1 monitoren toename van Fam fluorescentie voor de aanwezigheid van C. parvum. Plot 1 (kanaal F1 verzamelt voornamelijk FAM-signaal) met alleen C. parvum DNA onthulde Cryptosporidium-specifiek Fam-signaal in de PCR. Plot 2 bevatte alleen plasmide-DNA en geen FAM-signaal van Fam/Cy5.5 / BHQ3-sonde. Plot 3 bevatte beide C. parvum en plasmide DNA maar produceerde alleen C. parvum-specifiek Fam signaal. Plot 4 was een negatief monster dat alleen nucleasevrij water bevatte in plaats van enig template-DNA; er werd geen fluorescentie waargenomen van de sondes. B) Kanaalf3-monitors stijgen in Cy5.5 voor de aanwezigheid van internecontrole plasmide-DNA. Plot 1 bevatte alleen DNA van C. parvum en geen fluorescentiesignaal van Fam / BHQ1-sonde. Plot 2 (kanaal F3 verzamelt hoofdzakelijk Cy5.5–signaal) dat alleen plasmide-DNA bevat dat een specifiek Cy5.5-signaal voor interne plasmidecontrole (IPC) in de PCR bevat. Plot 3 bevatte beide C. parvum en plasmide DNA maar produceerde alleen IPC-specifiek Cy5. 5 signaal. Plot 4 was een negatief monster met alleen nucleasevrij water in plaats van enig template-DNA; er werd geen fluorescentie waargenomen van de sondes.
resultaten en discussie
Real-time PCR-fluorescentiesignalen die de versterking van het genomische DNA van C. parvum weerspiegelen, werden gedetecteerd in het F1-kanaal (figuur 2A) als gevolg van Fam-etikettering van de Taqman-sonde. Fluorescentiesignaal dat de versterking van de IPC weerspiegelt, werd gedetecteerd in het F3-kanaal (figuur 2B) als gevolg van FAM/Cy5.5 labeling van de IPC TaqMan probe. Deze sonde veroorzaakte een toename van Cy5, 5 in het F3-kanaal (Cy5, 5), maar geen toename van FAM in het F1-kanaal (FAM) wanneer BHQ3 door nucleaseactiviteit wordt gescheiden van de FAM/Cy5, 5, omdat energie van FAM naar Cy5, 5 werd overgedragen. Evenzo, in de duplexreactie, werd de genomic de versterking van DNA van C. parvum ontdekt in het kanaal F1, terwijl de IPC versterking gelijktijdig in het kanaal F3 werd ontdekt. FAM heeft een excitatie bij 495 nm en een emissie bij 520 nm. Cy5. 5 heeft een excitatie van 690 nm en een emissie van 705 nm. Met dergelijke dichte nabijheid tussen Cy5. 5 en FAM op de Triple-geëtiketteerde IPC sonde, straalt CY5.5 fluorophore fluorescentie toe te schrijven aan de volledige overdracht van energie van Fam fluorophore uit, resulterend in geen fluorescentieemissie van FAM in het kanaal F1 (figuur 2A). Negatieve controlereacties vertoonden geen toename van de fluorescentie als gevolg van FAM of Cy5.5. Deze resultaten tonen ook aan dat één enkele blauwe (470 nm) LEDBRON voldoende is om dubbele fluorescentie-emissies via F1 – (530 nm) en F3 – (705 nm) kanalen te bewaken zonder spectrale overlapping in de respectieve bewakingskanalen voor Fam en Cy5.5. De FRET-TaqMan-techniek werd ook getest met behulp van een panel van 12 DNA-extracten van ontlastingsspecimens (8 van specimens waarvan eerder was vastgesteld dat ze positief waren voor Cryptosporidium spp. en vier exemplaren die negatief waren voor Cryptosporidium spp.). De 18S rRNA test was in staat om alle acht Cryptosporidium spp.te detecteren. De IPC TaqMan-analyse bleek alleen het IPC plasmide-DNA te versterken. De IPC-test resulteerde in Ct-waarden van 32-37, wat tot 5 Ct-waarden van PCR-remming voor sommige ontlastingsmonsters aangaf (32 was de verwachte Ct-waarde voor geen-remmende reacties).
de huidige techniek verschilt van traditioneel gebruikt lijstwerk in die zin dat één fluorescently geëtiketteerde oligonucleotidesonde (de sonde van het lijstwerk-TaqMan) in plaats van twee sondes (de sondes van het lijstwerk) wordt gebruikt waarin één sonde donorfluorophore bevat en de andere sonde acceptorfluorophore (13,14) bevat. De sonde van het lijstwerk-TaqMan wordt geëtiketteerd aan het eind 5 ‘met twee fluorophores van donor (FAM) en acceptor (Cy5.5) fluorophores en aan het eind 3’ met een BHQ-3 quencher zoals een Taqman-sonde. Het unieke sonde-bindende gebied wordt geselecteerd om van doeldna te onderscheiden om twee verschillende fluorescentiemetingen in twee verschillende opsporingskanalen (530 nm in F1 en 705 nm in F3) van de zelfde versterkingsreactie te controleren zonder de behoefte om software van de kleurcompensatie te omvatten. Doeldna en IPC hadden de zelfde plaatsen van de inleidingsband maar een verschillende sondeopeenvolging. Dit verzekert dat het gebruik van de zelfde inleidingen voor beide doelstellingen van DNA om primer-dimeer vorming of interactie tussen inleidingssets te minimaliseren. Wanneer Fam / Cy5.5 fluorophores dicht bij eind 5 worden geplaatst, vindt de overdracht van de resonantieenergie met een verhoging van fluorescentieemissie van Cy5.5 fluorophore plaats. Nochtans, vermindert het gebruik van BHQ3, een niet-fluorescentieacceptor voor Cy5.5, potentiële achtergrondfluorescentie, die in een hogere signaal-aan-ruisverhouding resulteert. Men vond dat toevoeging van 100 exemplaren van IPC aan een reactie die 100 100 exemplaren van genomic C. bevatten. parvum-DNA resulteerde in vergelijkbare Ct-waarden (Ct = 32) toen de Cryptosporidium TaqMan-assay werd uitgevoerd als een singleplex-assay en als een duplex-assay met de IPC TaqMan-assay. Wanneer toegepast op een panel van Cryptosporidium-positieve DNA-specimens, gaf het IPC aan dat sommige specimens geen PCR-remmers bevatten (gebaseerd op verwachte Ct-waarden van 32), maar andere specimens werden geassocieerd met remming van maximaal 5 Ct-waarden.
de nieuw ontwikkelde interne PCR-positieve controle bleek gevoelig en specifiek voor gelijktijdige detectie van twee doelwitten in dezelfde reactie als gevolg van de etikettering met het FAM/Cy5.5-BHQ3 en FAM/BHQ1 voor de respectieve IPC-en 18S rRNA-doelgen in een dual-color multiplex PCR voor monitoring in F1-en F3-fluorescentiekanalen van het R. A. P. I. D-instrument. Het gebruik van de 5 ‘FAM-Cy5.5/3’ HQ-3–gelabelde sonde als tweede reporter is voordelig omdat de emissiemaxima van de twee sondes goed van elkaar waren gescheiden. De FRET-TaqMan Triple-label sonde ontwerp kan toepassingen hebben in het ontwikkelen van een goedkope, wegwerp “lab-on-a-chip” apparaat met optiek bestaande uit een blauwe LED excitatie en twee emissiebronnen van 530 nm en 705 nm, met de juiste optische filters om Fam te detecteren in een kanaal en Cy5.5 in de andere. Deze combinatie zou geen twee krachtige fluorescentiebron en opsporingssystemen vereisen.de auteurs erkennen de hulp van Mike Powers bij de DNA Sequencing and Genomic Core Facility (University of Utah, Salt Lake City, UT, USA) en Rachelle Muller bij Idaho Technology, Inc. voor discussie over de ontwikkeling van de interne positieve controle voor de R. A. P. I. D cycler. Deze publicatie werd gedeeltelijk ondersteund door fondsen die beschikbaar werden gesteld via de Centers for Disease Control and Prevention, Coordinating Office for Terrorism Preparedness and Emergency Response. Het gebruik van handelsnamen en commerciële bronnen is uitsluitend bedoeld voor identificatie en impliceert geen goedkeuring door de Centers for Disease Control and Prevention of het Amerikaanse Ministerie van Volksgezondheid en Menselijke Diensten.
- 1. Hartman, L. J., S. R. Coyne, en D. A. Norwood. 2005. Ontwikkeling van een nieuwe interne positieve controle voor op Taqman gebaseerde assays. Mol. Cel. Sondes 19: 51-59.Crossref, Medline, CAS, Google Scholar
- 2. Hoorfar, J., B. Malorny, A. Abdulmawjood, N. Cook, M. Wagner, P. Fach. 2004. Praktische overwegingen bij het ontwerp van interne versterkingscontroles voor diagnostische PCR-tests. J. Clin. Microbiol. 42:1863–1868.Crossref, Medline, CAS, Google Scholar
- 3. Betsou, F., K. Beaumont, J. M. Sueur, and J. Orfila. 2003. Constructie en evaluatie van interne controle DNA voor PCR amplificatie van Chlamydia trachomatis DNA uit urinemonsters. J. Clin. Microbiol. 41:1274–1276.Crossref, Medline, CAS, Google Scholar
- 4. Burggraf, S., B. Olgemoller. 2004. Eenvoudige techniek voor interne controle van real-time amplificatie assays. Clin. Scheikunde. 50:819–825.Crossref, Medline, CAS, Google Scholar
- 5. Drosten, C., M. Weber, E. Seifried, and W. K. Roth. 2000. Evaluatie van een nieuwe PCR-test met competitieve interne controlesequentie voor bloeddonorscreening. Transfusie 40: 718-724.Crossref, Medline, CAS, Google Scholar
- 6. Gruber, F., F. G. Falkner, F. Dorner, and T. Hammerle. 2001. Kwantificering van virale DNA door real-time PCR die duplexversterking, interne standaardisatie, en tweekleurige fluorescentieopsporing toepassen. Appl. Environ. Microbiol. 67:2837–2839.Crossref, Medline, CAS, Google Scholar
- 7. Rosenstraus, M., Z. Wang, S. Y. Chang, D. DeBonville, en J. P. Spadoro. 1998. Een interne controle voor routine diagnostische PCR: ontwerp, eigenschappen en effect op klinische prestaties. J. Clin. Microbiol. 36:191–197.Medline, CAS, Google Scholar
- 8. Stocher, M., V. Leb, J. Berg. 2003. Een geschikte benadering van de generatie van veelvoudige interne controledna voor een paneel van real-time PCR analyses. J. Virol. Methoden 108: 1-8.Crossref, Medline, CAS, Google Scholar
- 9. Zimmermann, K., J. W. Mannhalter. 1996. Technische aspecten van kwantitatieve concurrerende PCR. BioTechniques 21: 268-279.Link, CAS, Google Scholar
- 10. Jothikumar, N., A. J. da Silva, I. Moura, Y. Qvarnstrom, en V. R. Hill. 2008. Detectie en differentiatie van Cryptosporidium hominis en Cryptosporidium parvum door dubbele TaqMan assays. J. Med. Microbiol. 57:1099–1105.Crossref, Medline, CAS, Google Scholar
- 11. Altschul, S. F., W. Gish, W. Miller, E. W. Myers, and D. J. Lipman. 1990. Basic local alignment search tool. J. Mol. Biol. 215:403–410.Crossref, Medline, CAS, Google Scholar
- 12. Hill, V. R., A. M. Kahler, N. Jothikumar, T. B. Johnson, D. Hahn, en T. L. Cromeans. 2007. Multistate evaluatie van een ultrafiltratie-gebaseerde procedure voor gelijktijdige recuperatie van enterische microben in 100-liter leidingwatermonsters. Appl. Environ. Microbiol. 73:4218–4225.Crossref, Medline, CAS, Google Scholar
- 13. Bernard, P. S., M. J. Lay, en C. T. Wittwer. 1998. Geïntegreerde amplificatie en detectie van de c677t puntmutatie in het methyleentetrahydrofolaatreductase gen door fluorescentie resonantie energie overdracht en sonde smeltkrommen. Anaal. Biochem. 255:101–107.Crossref, Medline, CAS, Google Scholar
- 14. Wittwer, C. T., M. G. Herrmann, A. A. Moss, and R. P. Rasmussen. 1997. Continuous fluorescence monitoring of rapid cycle DNA amplification. BioTechniques 22:130–138.Link, CAS, Google Scholar