Dunne darm Borstelgrensenzymen
VIVO Pathofysiologie
dunne darm Borstelgrensenzymen
de laatste stap in de vertering van koolhydraten en eiwitten uit de voeding vindt plaats op het oppervlak van dunne darm enterocyten, in de onmiddellijke nabijheid van de transporteiwitten die de resulterende suikers en aminozuren naar de epitheliale cellen zullen brengen. De enzymen die verantwoordelijk zijn voor deze terminale fase van de spijsvertering zijn niet vrij in het darmlumen, maar eerder gebonden als geïntegreerde membraaneiwitten in het plasmamembraan van de enterocyt. De apicale plasma membraanhuisvesting deze enzymen is samengesteld uit talrijke microvilli die zich van de cel uitstrekken en de “borstelgrens” vormen. Vandaar, worden de enzymen ingebed in die microvilli bedoeld als borstelgrensenzymen.
de dichtheid en verdeling van borstelgrensenzymen verschilt per segment van de dunne darm en varieert vaak afhankelijk van de leeftijd van het dier. Bovendien, in sommige gevallen kan de concentratie van dergelijke enzymen door dieet worden gemoduleerd; bijvoorbeeld, neemt de hoeveelheid sucrase-isomaltase enzym in dieren toe die een hoog-koolhydraatdieet worden gevoerd.
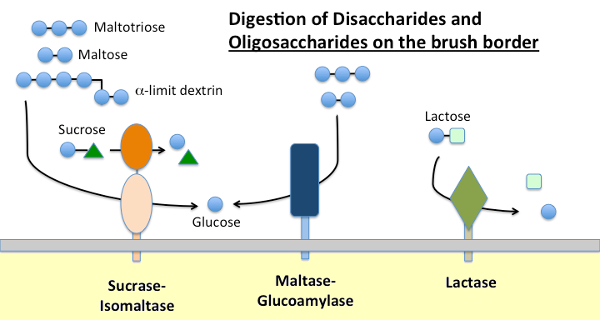
Maltase-Glucoamylase en Sucrase-Isomaltase
voedingszetmeel wordt verteerd door α-amylase, aanwezig in pancreassecreties en, bij veel soorten, speeksel. Amylase hydrolyseert interne α-1,4 glycosidebindingen in zetmeel om maltose, korte oligosachariden (bv. maltotriose) en zogenaamde limietdextrines te genereren, die vertakkingspunten zijn in amylopectine. Geen van deze moleculen kunnen door het dunne darmepitheel worden geabsorbeerd en vereisen verdere hydrolyse, uiteindelijk in glucose.
Maltase-glucoamylase en sucrase-isomaltase zijn nauw verwante enzymen ingebed in het membraan van de borstelrand die de terminale stadia van de spijsvertering uitvoeren met behulp van substraten die door de werking van amylase worden geleverd:
- Maltase-glycoamylase heeft twee actieve locaties. De maltaseplaats hydrolyseert terminale α-1,4-gebonden d-glucoseresiduen van maltose of maltotriose, waardoor α-D-glucose ontstaat. De glucoamylaseplaats heeft ook die α-1,4 hydrolase-activiteit, maar hydrolyseert ook α-1,6 glycosidebindingen wanneer deze grenzen aan een α-1,4-verbinding, waardoor β-D-glucose vrijkomt.
- Sucrase-isomaltase heeft ook twee actieve sites met verschillende specifieke kenmerken. De sucraseplaats katalyseert hydrolyse van sucrase in fructose en glucose, en kan ook maltose hydrolyseren. De plaats van isomaltase is belangrijk als het belangrijkste mechanisme voor het verteren van de α-1,6 verbindingen van de limietdextrine.
Lactase
Lactase, zoals de naam al aangeeft, is een disaccharidase die lactose hydrolyseert tot galactose en glucose; formeel is het een β-glycosidase. Lactose is de belangrijkste koolhydraat in melk en lactase is overvloedig aanwezig in de dunne darm borstel rand van jonge zoogdieren. Bij de meeste soorten, inclusief de mens, daalt de expressie van lactase kort na het spenen. Bij de meerderheid van de mensen wordt deze niet-persistentie van lactaseactiviteit op volwassen leeftijd geassocieerd met “lactose-intolerantie”. Het verschil tussen lactasepersistentie en niet-persistentie wordt genetisch bepaald.
peptidasen
Er is een groot aantal borstelrandpeptidasen, die gezamenlijk de diversiteit van de aminozuursequentie in voedingseiwitten kunnen hydrolyseren. De belangrijkste klassen van peptidasen omvatten:
- Exopeptidasen die terminale aminozuren uit peptiden hydrolyseren. Sommige van deze enzymen hebben activiteit tegen C-terminale residuen en andere werken op n-terminale aminozuren. Hun activiteit levert vrije aminozuren of dipeptiden op. Als voorbeeld van enzymspecificiteit en diversiteit, hydrolyseert aminopeptidase P N-eind aminozuur van di-, tri – en oligopeptiden maar slechts als zij met proline verbonden zijn, terwijl aminopeptidase a de hydrolyse van eind zure aminozuren zoals glutamaat en aspartaat katalyseert.
- Endopeptidasen splitsen peptideketens intern, wat kleinere peptiden met een variërende ketenlengte oplevert.
- een enkel dipeptidase bestaat ook als een borstelgrensenzym.
Enteropeptidase, ook bekend als enterokinase, is een ander borstelgrensenzym dat de belangrijke activiteit heeft van het katalyseren van de activiteit van trypsinogeen in trypsine, een van de belangrijkste proteasen van de alvleesklier. Enteropeptidase is het meest aanwezig in de twaalfvingerige darm.
lipasen
een aantal lipasen zijn aanwezig in de borstelrand van de dunne darm. Deze omvatten fosfolipase B1, neutrale ceramidase en alkalische sphingomyelinase.