Posts Tagged «MO teori; cycloaddition; organisk kjemi; HOMO; LUMO; konjugert system»
En av de mest utfordrende begreper i konjugerte systemreaksjoner er molekylære orbital interaksjoner, ELLER MO teori. Grunnleggende til dette prinsippet kan være vanskelig å forstå, men vil være svært informativ i å forutsi de riktige reaksjonsbetingelsene og utfallet av reaksjonen hvis du forstår dem, noe som vil gi deg en stor fordel på fremtidige spørrekonkurranser og eksamener. Vi I StudyOrgo har utviklet en enkel forklaring på det grunnleggende TIL MO teori for å hjelpe deg med dine studieforberedelser.Det grunnleggende konseptet MED MO-teori er å beskrive de vekslende mønstrene av orbitaler som eksisterer i pi-bindingssystemer. Vi beskriver orienteringen av hver halvdel av dumbbell orbital sentrert rundt et atom som fet eller åpen. Husk at det er bonding og antibonding orbitaler. I hovedsak oppfører orbitaler med lavere antall noder (brytere i orienteringen av dumbbell orbitalen som vi viser med den stiplede linjen) mer som bonding orbitaler mens orbitaler med høyere antall noder oppfører seg som anti-bonding orbitaler. For å bestemme hvilke orbitaler som er opptatt på molekylet ditt, må du bare telle hvor mange pi-bindinger du har i ditt konjugerte system. Nedenfor er et eksempel på butadien. Den har 4 pi elektroner, så vi fyller de laveste molekylære orbitaler først, to i hver orbital. Derfor er den høyeste okkuperte molekylorbitalen, ELLER HOMO, i butadien #2. Som et resultat er den laveste ubebodde molekylære obitalen, ELLER LUMO, i butadien #3. Vi kan utvide dette til etylen og se at med 2 pi elektroner er molekylær orbital # 1 HOMO og molekylær orbital #2 ER LUMO.
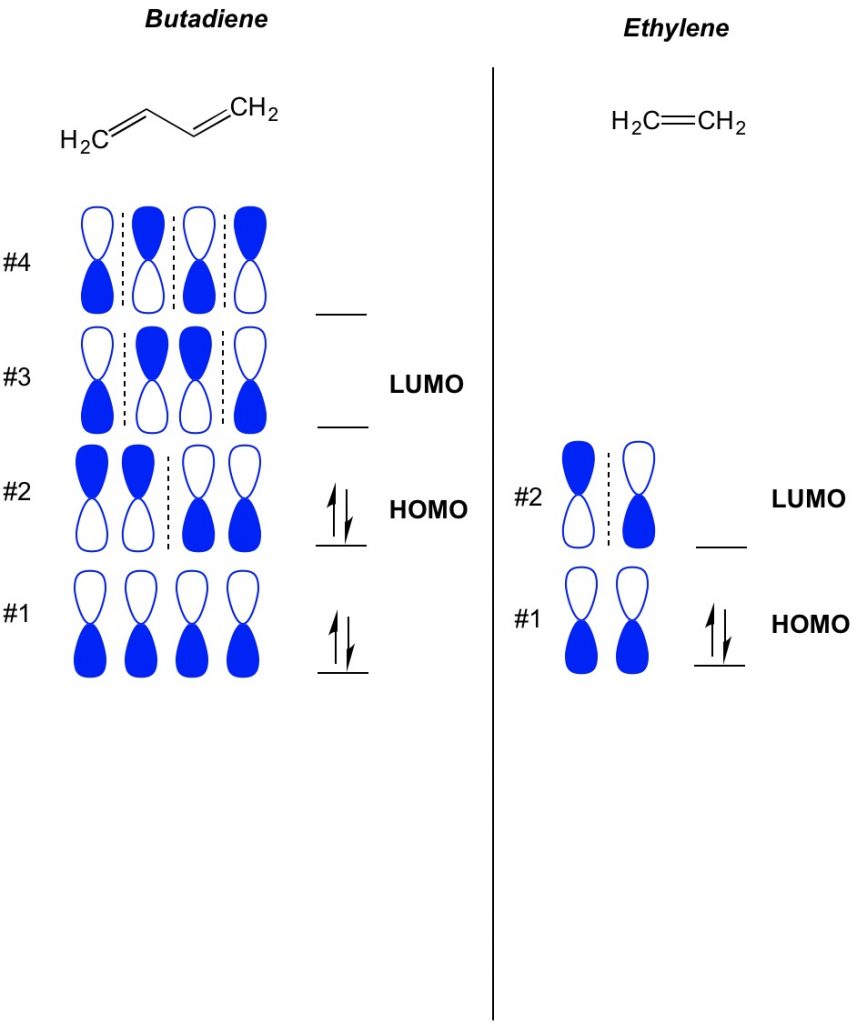
Cycloadditions Mo Teori
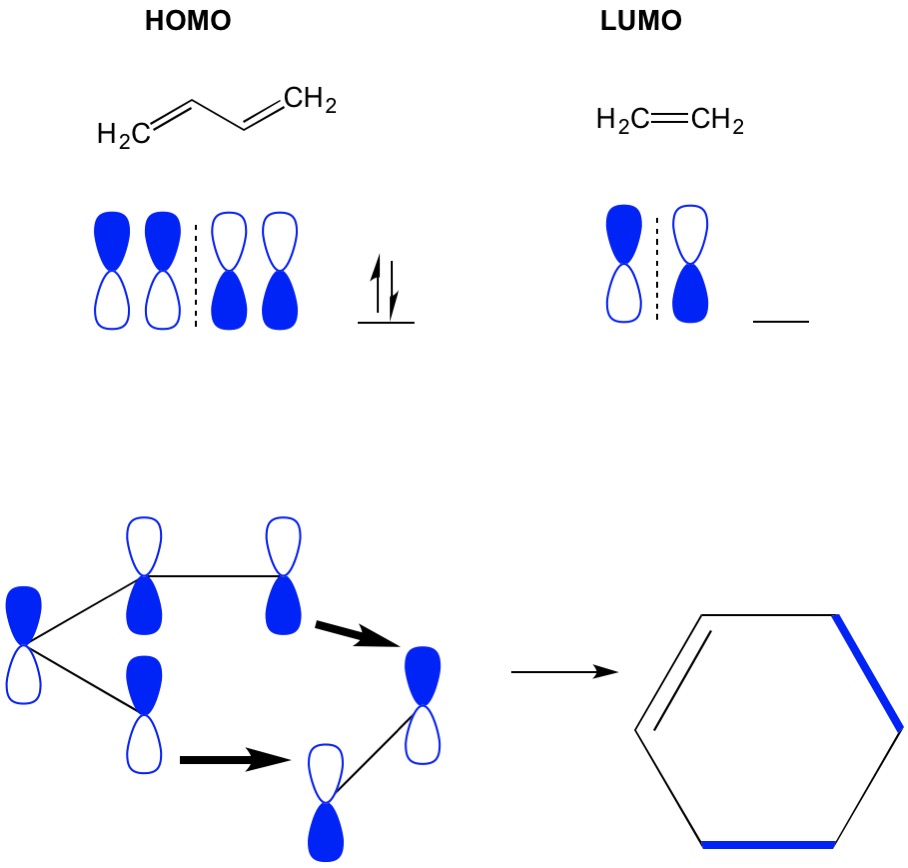
Husk at cycloaddition reaksjoner beskrive dannelsen av nye C – c sigma bindinger gjennom omorganisering av pi elektroner i et konjugert system. Derfor må vi bruke molekylorbitaler av pi-elektronene til å drive reaksjonen. La oss ta reaksjonen av butadien med etylen, den mest forenklede Diels Alderreaksjonen (4 + 2 cykloaddisjon). Vi starter med det mest konjugerte molekylet, butadien og undersøker DETS HOMO. Så ser vi på det minst konjugerte molekylet, etylen og undersøker DETS LUMO. Hvorfor? Vi trenger elektronene FRA EN HOMO til å strømme fra ett molekyl til et annet, så VI må bruke LUMO-orbitalet som ikke er opptatt for denne prosessen. Vi ser at noder AV HOMO OG LUMO justerer; det er de åpne og lukkede halvdelene av dumbbells justere. Dette fører til en fremoverreaksjon og dannelse av produktet, cykloheksen.
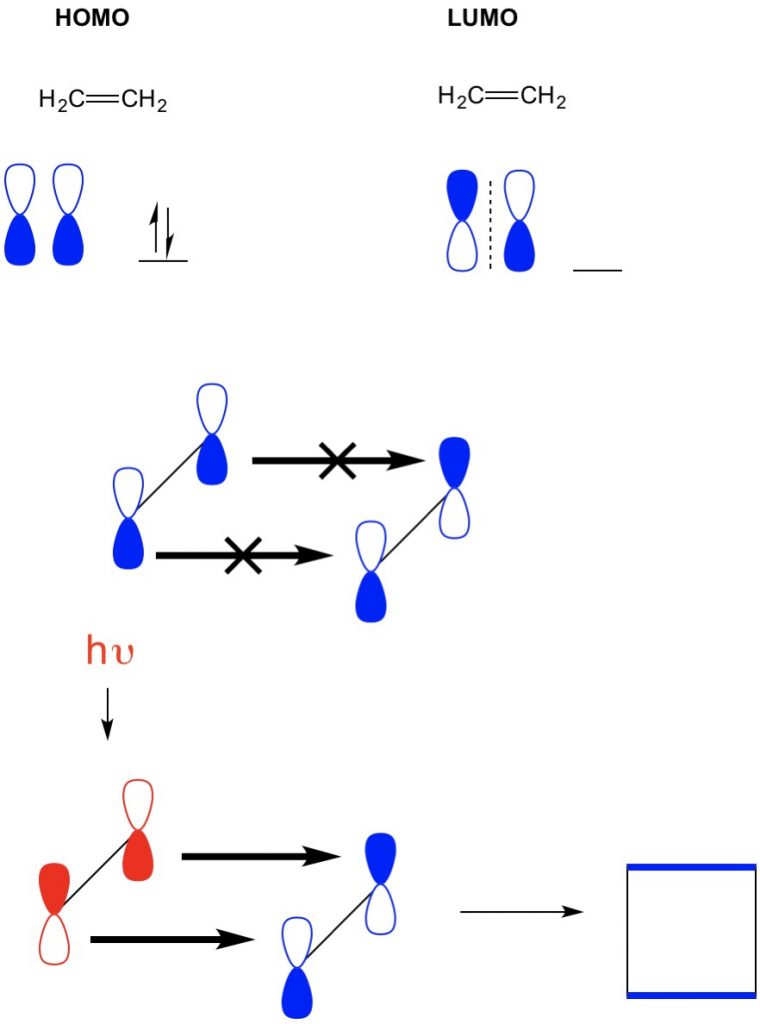
Men I et annet eksempel der vi har en (2+2 cycloaddition), ser VI HOMO OG LUMO av etylen ikke justere dermed forby reaksjonen. Imidlertid har vi muligheten til å opphisse elektroner FRA HOMO til en høyere orbital ved hjelp av lys (hv) eller varme, og dermed endre HOMO. Vi vurderer dette konseptet i detalj i en tidligere artikkel. NÅR VI gjør dette, HOMO av opphisset etylen OG LUMO av grunntilstand etylen justere og reaksjonen produserer cyklobutan.
vi håper denne beskrivelsen har bidratt til å avklare dette begrepet MO teori. Dette er et eksempel på de klare og enkle expatiations vi har forberedt for over 175 reaksjoner ofte sett I Orgo1 og Orgo2 kurs. Registrer deg i dag for dine studieforberedelsesbehov!