Kjemi Learner
Hva Er En Koordinat Kovalent Binding?
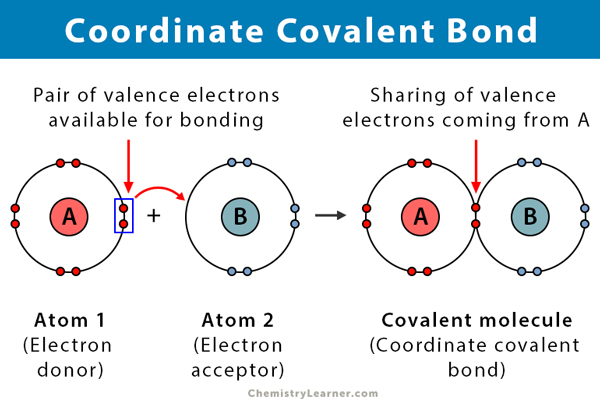
en kovalent binding dannes når to atomer deler elektroner. En koordinat kovalent binding, også kjent som en dativ kovalent binding, er en type kovalent binding der den delte par elektroner kommer fra ett av atomene. Atomene holdes sammen fordi begge kjernene tiltrekker elektronparet. Når den kovalente bindingen er dannet, er det umulig å skille opprinnelsen til elektronene. Denne typen binding er vanligvis observert i binding av metallioner til ligander. Imidlertid kan ikke-metaller også delta i denne bindingen. Reaksjonen Mellom Lewis syre og base er en koordinat kovalent binding .en kompleks ion er laget av to ting, en metallion og forbindelser kalt ligander. Ligander er nøytrale molekyler eller ioner som inneholder ensomme elektronpar som kan binde seg til metallionen. Vanlige ligander er ammoniakk (NH3), vann (H2O) og halogenidioner (Cl–, Br–). Ligander betraktes Som Lewis-baser fordi de deler sine elektronpar med metallionen. Metallioner er alltid positive, så de er ganske attraktive for ensomme par elektroner.
Fakta og Egenskaper Av Koordinatkovalent Binding
koordinatkovalent binding har mange likheter med det av kovalent binding. Her er noen av egenskapene:
- Foregår mellom en elektrondonor og en elektron-akseptor, typisk Mellom et metall og en ligand
- Foregår mellom ulike atomer
- Dannet Ved deling av elektroner donert av et av atomene
- Stive Og retningsbestemte
- Polar
- Atomer følger oktettregelen
- Forbindelser er sparsomt løselig i vann
tomet som donerer elektronene kalles en donor, og atomet som aksepterer dem kalles en akseptor.
Eksempler På Koordinatkovalent Binding
Her er noen eksempler på molekyler der koordinatkovalent binding eksisterer .
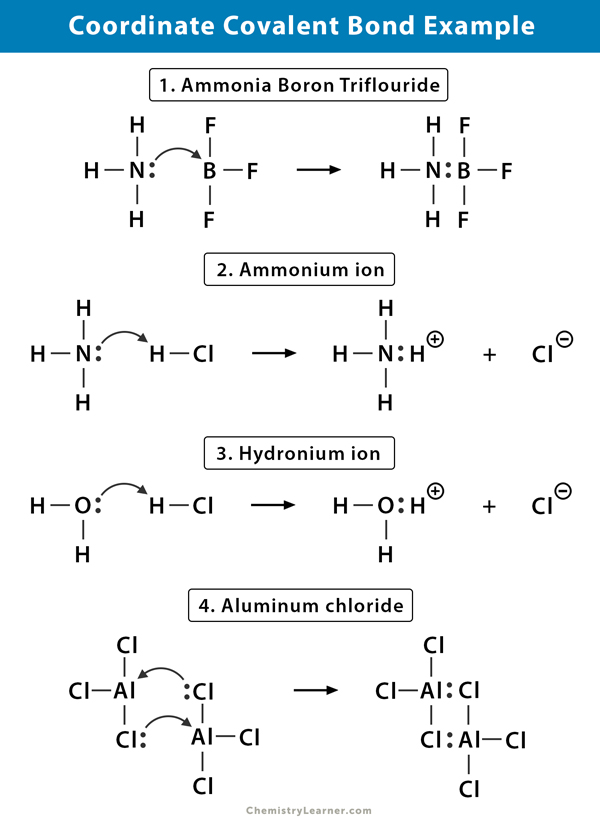
Ammonium (NH4+) ion
ammoniumionet dannes fra reaksjonen av ammoniakk (NH3) gass med hydrogenklorid (HCl) gass. I NH4+ er det fjerde hydrogenet festet med en koordinatkovalent binding fordi bare hydrogenets kjerne overføres fra klor til nitrogen. Hydrogenets elektron er igjen på klor for å danne et negativt klorid (Cl–) ion.
Ammoniakkbor Trifluorid (NH3.BF3)
bortrifluorid (BF3) er en forbindelse som ikke har en edelgassstruktur rundt boret (B) atom. Boret har bare tre par elektroner i valansskallet og krever et par for å fullføre orbitalet. DERFOR ER bf3 elektron mangelfull. Det ensomme paret på nitrogenet (N) av ammoniakk (NH3) molekylet brukes til å overvinne den mangelen, og en kompleks forbindelse dannes gjennom en koordinatkovalent binding.
Hydroniumion (H3O+)
når hydrogenklorid (HCl) gass oppløses i vann for å lage saltsyre (HCl aq.), dannes en koordinatkovalent binding i hydroniumionet. Hydrogen (H) kjernen overføres til vann (H2O) molekylet, som har et ensomt par elektroner for å danne hydronium. Så, H bidrar Ikke noen elektroner til bindingen.
Aluminiumklorid (Al2Cl6)
bindingen i aluminiumklorid (AlCl3) er i det vesentlige kovalent. Hvert aluminium (Al) atom har et underskudd på to elektroner i sitt valansskall, og klor (Cl) har et ensomt par. Al danner en koordinatkovalent binding med cl-atomet på en tilstøtende AlCl3-gruppe. Da hvert Av To al-atomer gjør dette, er aluminiumklorid et kovalent dimermolekyl Med formelen Al2Cl6.
Karbonmonoksid (CO)
Karbon (C) har fire elektroner i valensskallet, og oksygen (O) har seks. Både karbon og oksygen deler sine to elektroner. Mens oktettregelen er fornøyd med oksygen, er det fortsatt et underskudd på to elektroner på karbonet. Så deler oksygen sine to elektroner med karbon for å danne en koordinatkovalent binding, i tillegg til de to vanlige (doble) kovalente bindingene.