Intrauterin Inseminasjon hos Hunden

I: Nylige Fremskritt Innen Reproduksjon Av Små Dyr, P. W. Concannon, G. England Og J. Verstegen (Eds.) Utgiver: International Veterinary Information Service (www.ivis.org), Oslo, norway.
Intrauterin Inseminasjon Hos Hund Ved Bruk Av Skandinavisk Trans-Cervikal Kateter og En Sammenligning Med andre Metoder (2-Feb-2001)
C. Linde-Forsberg
Veterinærmedisinsk Fakultet, Institutt For Obstetrikk og Gynekologi, Sveriges Landbruksuniversitet, Uppsala, Sverige
Introduksjon
interessen for konservering av hundesæd og kunstig inseminasjon (AI) øker stadig over hele verden, men det publiseres relativt få studier hvert år innen dette feltet, og det er spesielt vanskelig å finne data fra kunstige inseminasjoner ved hjelp av fersk sæd, eller sæd bevart i henhold til ulike metoder for kjøling, eller frysing og tining, og også sammenligne resultater når annerledes teknikker for å utføre inseminasjonene brukes. En årsak til mangel på data er at det er dyrt å gjøre eksperimentelle studier hos hunder, og få forskningssentre kan holde store nok hundekolonier for denne typen studier. En annen grunn er at de fleste av de store selskapene som behandler og distribuerer hundesæd for hundeoppdrettere, jobber på rent kommersielt grunnlag, og selv om noen av dem ser ut til å holde oversikt over resultatene, blir ikke disse resultatene, heller ikke sammensetningen av forlengerne eller metodene for bevaring av sæden avslørt. Eventuell kunnskap som er oppnådd, vil derfor forbli hos de forskjellige selskapene, og vil ikke være til nytte for den vitenskapelige verden, og dermed heller ikke for hundeoppdretterne generelt. De eneste studiene på hundens kunstige inseminasjon rapportering om fruktbarhetsresultater fra et stort antall inseminasjoner er De Av Seager et al., på 156 frosset-tint sæd AIs ved bruk av vaginal avsetning, Linde-Forsberg & Forsberg på henholdsvis 470 og 527 AIs, ved bruk av både fersk, kjølt utvidet og frosset-tint sæd og vaginal samt intra-uterin AI, Linde-Forsberg et al., på 327 frossen-tint sæd AIs, sammenligne vaginal OG intrauterin AI, linde-Forsberg rapportering på 2041 AIs med fersk og kjølt utvidet og frosset-tint sæd og bruk av både vaginal OG intrauterin AI, Og Thomassen et al., på 312 frosset-tint hovedsakelig intra-uterin AIs. En rekke faktorer er av betydning for å bestemme suksessraten for kunstig inseminasjon hos hunder, for eksempel når og hvor mange ganger I løpet av tisens østrous syklus AI utføres, sædkvalitet og håndtering og inseminasjonsteknikken. Mer informasjon om disse fasettene finner du i de nevnte referansene. Dette papiret vil bare omhandle inseminasjonsteknikkene og effektene av stedet for sædavsetning. De siste kliniske studiene har fremhevet betydningen av intrauterin i motsetning til intravaginal kunstig inseminering hos hunden, og er de første som viser betydelig bedre resultater når sæd ble deponert i livmoren i stedet for i skjeden. I Studien Av Linde-Forsberg et al. valpehastigheten ved bruk av intrauterin avsetning av frøsetint sæd var 84,4% sammenlignet med 58.9 % ved bruk av vaginal avsetning, og gjennomsnittlig kullstørrelse var 5,4 + 3,0 sammenlignet med 4,0
+2,7 valper/kull (P <0,001). Fertilitetsdata fra 2041 kunstig inseminasjon er hunder, utført i svenske tisper mellom 1990 og 1998 og rapportert til Kennelklubben innen 2 uker (dvs . før en graviditetstest kunne ha blitt gjort for å unngå bias til resultatene), viste at signifikant høyere valpingshastigheter og søppelstørrelser ble oppnådd ikke bare med frossen tint sæd, men også med fersk, så vel som kjølt, utvidet sæd når sæden hadde blitt avsatt i livmoren i stedet for i skjeden (Tabell 1).

resultatene ved bruk av fersk sæd, vist I Tabell 1, er litt for høye fordi 11 % av disse tispene av ulike årsaker ikke bare var kunstig inseminerte, men også parret. Den hyppigste årsaken til dette var at oppdretterne prøvde å parre tispene for tidlig under østrus, og når hundene ikke ville parre, ba eierne OM EN AI. Valpesatsen i den også parrede gruppen var så høy som 84,5%, med en gjennomsnittlig kullstørrelse på 6,0 + 2,8 valper, sammenlignet med en valpesats på 48,9% og en gjennomsnittlig kullstørrelse på 5,8 + 2,8 valper for de tispene som bare var kunstig inseminert. Det ser derfor ut til at en rekke AIs som utføres med fersk sæd faktisk er gjort på en ikke-optimal tid under østrus, vanligvis på grunn av oppdretterens uerfarenhet, men det relativt dårlige resultatet er sannsynligvis også på GRUNN AV AT AI er forespurt på grunn av ulike problemer hos hundene. De svenske dataene viser imidlertid klart at i hunden forbedrer intra-uterin AI signifikant valpehastigheten og kullstørrelsen. Valpehastigheten ved intrauterin AI økte med fra 36% for fersk sæd til 50% for frossen tint sæd, sammenlignet med vaginal AI. Og med intrauterin AI økte gjennomsnittlig kullstørrelse med 0,3 valper per kull for frosset sæd og med 0,6 og 0,7 per kull for fersk og kjølt utvidet sæd. Det er også interessant i denne sammenheng å merke seg at hunden anses å være en art med intrauterin avsetning av sæd ved naturlig parring, fordi spermatozoa når den kopulatoriske slipsen er over, har nådd oviduktene . Den sædrike fraksjonen ejakuleres ved intromisjon og i det tidlige stadiet av det kopulatoriske båndet, og etterfølges av et stort volum prostatavæske som umiddelbart spyler spermatozoa fra den smale kraniale skjeden gjennom livmorhalsen inn i livmorlegemet og hornene. Skjeden ser ut til å tilby et ugunstig miljø for hundens spermatozoa, siden en stor andel mister sine haler innen minutter etter avsetning i kranialskjeden . Det har også vist seg at rundt 10 ganger så mange spermatozoer kreves for å oppnå lignende resultater ved vaginal AI som ved intrauterin AI med fersk sæd, så vel som med frosset tint sæd . Det er derfor mange faktorer som bidrar til de dårligere resultatene som oppnås ved intravaginal sædavsetning sammenlignet med intrauterin deponering.
Metoder For Å Utføre Intrauterin AI I Hunden. Intra-uterin AI i hunden kan gjøres transcervisk enten ved Hjelp Av Det Skandinaviske (eller norske) kateteret, eller ved å bruke et stivt fiberoptisk vaginalt endoskop for å visualisere livmorhalsen og et hundekateter for å krysse det. Intra-uterin AI kan også oppnås ved invasive metoder som laparoskopi, eller full abdominal kirurgi. I noen land kan sistnevnte metoder være ulovlige eller ikke anses etisk akseptable.
Palpasjon Av Livmorhalsen
det er helt avgjørende for personen som ønsker å utføre CANINE AI å lære å lokalisere livmorhalsen ved abdominal palpasjon for å kunne sette sæden på riktig sted og for å unngå å skade tispa. Tissen skal ha tom mage og blære for å lette prosedyren. For opplæringsformål anbefales det å bruke engangsplast vaginal ai-kateter (Minitü GmbH, Tiefenbach, Tyskland) (Fig. 1).
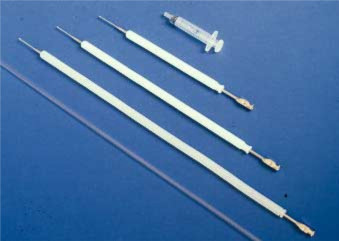
Figur 1. De Tre størrelsene På Skandinavisk kunstig inseminasjonskateter for hunder, og plast engangs vaginal kunstig inseminasjonskateter.
fordi uretheralåpningen av tisken befinner seg ved bekkenbunnen, er DET overraskende enkelt FOR AI-kateteret, eller et tynt stivt endoskop, å utilsiktet innføres i urinblæren. Bortsett fra farene ved perforering av blæren med kateteret, er det åpenbart at ingen graviditet vil følge etter EN AI. Således bør korrekt posisjon av kateteret alltid kontrolleres ved palpasjon før avsetning av en sæddose. Hvis kateteret er i urinblæren, kan kranialdelen av skjeden og livmorhalsen bli palpert over kateteret. Veggene i urinblæren er vanligvis tynnere enn vagina, og spissen av kateteret skiller seg ut tydeligere enn om det var i skjeden. For å palpere livmorhalsen, blir ET AI-kateter introdusert i tisens vagina. Innføringen av kateteret blir lettere hvis vulvaen er forhøyet til den ligger like under anusen (som når tisken står for hannhunden). Når spissen av kateteret blir introdusert så langt som å umiddelbart kranialt til bekkenbrimen, bør det bli palpert. Cranially skjeden i de fleste tisper skråner litt nedover. I noen raser, men spesielt synhundene med en veldig buet lend, har skjeden en mer dorsal retning. Den kraniale enden av kateteret skal nå senkes nærmere bukveggen for å bli mer tilgjengelig for palpasjon. Når kateterspissen kan palperes og den korrekte posisjonen i skjeden kontrolleres, innføres den nøye videre, under fortsatt palpatorisk kontroll, til den når det paracervikale området. Dette er den smale, kraniale delen av skjeden opprettet av dorsal, median post-cervical fold og kan palperes som en 1 til 2 cm lang, fast struktur. Den ender i livmorhalsen, som i en tisse i østrus er en 0,5 til 1,5 cm hard, avrundet til ovoid fritt bevegelig struktur. Det er vanligvis ikke mulig å passere Den ytre beskyttelseskappen Til Det Skandinaviske kateteret, som har en diameter på 10 mm, inn i paracervikalområdet. Også det tynnere PLAST AI-kateteret, som har en diameter på 5 mm, kan være for bredt til å introdusere i paracervical-området hos noen tisper, spesielt de av de mindre raser, eller de som ikke har født et søppel av valper. Når livmorhalsen er identifisert, kan corpus uteri og livmorhornene bli palpert foran denne strukturen. Senk spissen av kateteret og lukk tuppen av tommelen mot pekefingeren over kateteret, løft deretter kranialenden av kateteret på en slik måte at livmorhalsen og livmorhornene trekkes oppover mellom fingrene. Deres størrelse og konsistens blir da tydelig. (Denne metoden for å palpere livmoren er også svært nyttig for tidlig graviditetsdeteksjon og for å undersøke tisper med mistanke om pyometra).
Intrauterin Inseminasjon ved Bruk Av Skandinavisk Kateter
Det Skandinaviske kateteret består av et 1-2 mm bredt stålkateter med 0.75 mm til 1 mm diameter spiss, og kommer i tre forskjellige lengder: 20, 30 eller 40 cm. Den brukes sammen med en 10 mm diameter ytre beskytte nylon kappe (Fig. 1 Og Fig. 2). Det mellomstore kateteret passer til de fleste små og mellomstore tisper. Utstyret kan fås fra Norsk Pelsoppdretterforening, P. O. Box 136, Ø, N-0509 Oslo 5, Norge.

figur 2. Et nærbilde av de To størrelsene av tips Av Skandinavisk AI kateter for hunder.
Intra-uterin AI Med Det Skandinaviske kateteret utføres med tisken som står på gulvet eller på et bord. Sedasjon er svært sjelden nødvendig; tvert imot aksepterer de fleste tisper i østrus fritt denne typen håndtering. I tilfelle en lett sedasjon bør være nødvendig for eksempel i en svært stor, overvektig eller nervøs tispe, kan 1 – 3 mg/kg xylazin IM ELLER IV brukes. Det indre stålkateteret, med spissen innenfor og beskyttet av nylonkappen, blir introdusert i skjeden. Den kraniale enden av nylonkappen er palpert foran bekkenbunnen som tidligere beskrevet. Hvis spissen av kateterkappen er senket nærmere bukveggen, er livmorhalsen vanligvis funnet noen få cm foran og over den. Stålkateteret blir deretter introdusert gjennom kappen til spissen når den ventrale fornixen. Livmorhalsen er festet mellom tommelen og pekefingeren, og ved å påføre en litt nedadgående trekk ved corpus uteri, er den vippet slik at vinkelen til livmorhalskanalen blir mer horisontal (Fig. 3).
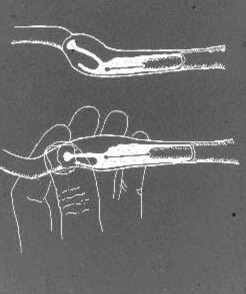
figur 3. En skjematisk tegning av hundens paracervikale region og livmorhalskanalen, Med Det Skandinaviske kateteret på plass i kranialskjeden. Ved manipulering på livmorhalsen og corpus uteri vinkelen på livmorhalsen er endret for å få cervikalkanalen i bedre innretting med tuppen av kateteret for å lette kateterisering.
spissen av kateteret trekkes deretter forsiktig ut mens du skyver det gjentatte ganger mot overflaten av livmorhalsen på jakt etter åpningen av livmorhalsen. Følelsen når denne åpningen er funnet, kan i de fleste tilfeller beskrives som følelsen av å berøre brusk, dvs. «sprø». Når åpningen er funnet, fikser du kateteret og begynner å jobbe livmorhalsen mot kateteret. Den livmorhalske kanalen er 5 til 10 mm lang, og ikke alltid helt rett. Dermed kan det hende at et lite trykk må påføres, mens du roterer kateteret for å lette det gjennom. I de fleste tisper kan spissen av kateteret lett følges foran livmorhalsen i corpus uteri. I noen tisper er følelsen imidlertid ikke så tydelig. Sprøyten som inneholder sæd er koblet til kateteret og sæden sakte infundert i livmoren. Noen ganger er det motstand mot infusjon avhengig av om åpningen av kateteret presser mot endometrial slimhinnen. En lett nedadgående trekk av corpus uteri eller livmorhalsen lindrer vanligvis situasjonen og tillater sædinfusjon. For å kontrollere at kateteret virkelig er i livmor av tisken, kan 1-2 ml fysiologisk saltvann infunderes. Hvis kateteret er i riktig posisjon i livmorlegemet, kan væsken lett infunderes. Hvis kateteret derimot er i den paracervikale regionen, vil det være en nesten umiddelbar tilbakestrømning av saltvann mellom kateteret og nylonkappen. Kateteret er fjernet og bakparten av tispa er forhøyet og tispa holdes i denne posisjonen i 5-10 minutter ETTER AI å minimere tilbakestrømning av sæd og for å lette livmor transport av spermatozoa mot ovidukter . Tispa bør også være fjær rundt perineal regionen som dette antas å stimulere livmor sammentrekninger. For å lære denne teknikken krever litt øvelse, men når lært det er en rask metode, vanligvis blir oppnådd i løpet av minutter. Det anbefales at orgelprøver i utgangspunktet oppnås for treningsformål og anatomisk studie. Det er også en fordel hvis spesielt de første forsøkene gjøres hos tisper som har født ett eller flere kull, da de vanligvis er mye lettere å kateterisere. Perforeringer kan oppstå hvis kateteret innføres blindt eller med kraft. Forutsatt at kateteriseringen utføres under forsiktig palpatorisk kontroll, er teknikken imidlertid helt trygg for tisken. Noen tisper er vanskeligere å kateterisere, spesielt de som tilhører noen av de gigantiske raser, samt overvektige eller nervøse dyr. Ved Bruk Av Det Skandinaviske kateteret var bare mellom 2 og 3,5% av forsøkene på intrauterin kateterisering mislykket . Resulterende valpefrekvenser ved bruk av frossen tint sæd har blitt rapportert å være 84.5% og 71% når utført av dyktige inseminatorer, gjennomsnittlig 65% med fersk og kjølt sæd og 52% med frosset tint sæd, i en større feltstudie med også mindre erfarne inseminatorer (Fig. 1). Denne teknikken kan også brukes til intrauterin infusjon av kontrastmedium for hysterografisk undersøkelse av tisken .
Intra-Uterin Inseminasjon ved Hjelp Av Endoskopisk Visualisering Av Livmorhalsen
Transcervikal intra-uterin inseminasjon kan også oppnås ved hjelp av et stivt fiberoptisk endoskop og et urin-eller angiografisk kateter, på stående tispe, og uten sedasjon (Fig. 4 Og Fig. 5).

Intra-Uterin Inseminasjon Ved Hjelp Av Laparoskopi
abdominal laparoskopi bør tilby et noe mer akseptabelt alternativ til full kirurgi FOR AI hos hunden. Teknikken har blitt beskrevet Av Wildt Og Silva et al. . EN 60 til 73% graviditetsrate har blitt rapportert AV AI ved hjelp av laparoskopi, men antall tisper i disse studiene var få.
Intrauterin Inseminasjon ved Bruk Av Kirurgi
Kirurgi for å utføre intrauterin inseminasjon er rapportert . Ulike kirurgiske prosedyrer har blitt brukt, med tisken under generell anestesi og i dorsal recumbency. Den ventrale buken klippes, og etter rutinemessig kirurgisk forberedelse gjøres et 4 -6 cm snitt midt mellom pubis og navlestreng, gjennom linea alba. Livmoren er forhøyet gjennom snittet, og nålen på sprøyten som inneholder sæden, settes inn i lumen i livmorlegemet i en 45o vinkel med nålens skråning opp. Sæden injiseres sakte i livmoren. Det skal flyte lett med åpenbar distention av livmorhornene, ellers skal nålen reposisjoneres. En saltvann fuktet gasbind holdes over injeksjonsstedet etter at nålen er trukket ut. Etter 1 min gasbind er fjernet, livmoren erstattet i magen og såret lukket ved hjelp av rutinemessig metodikk. For å unngå tilbakestrømning av sæd tispa bør plasseres med sin bakre forhøyet som hun gjenoppretter fra anestesi . Rundt 60% graviditet rate har blitt rapportert etter kirurgisk AI i hunden, men som med laparoskopisk AI resultatene er basert på begrensede eksperimentelle studier og ingen feltdata er tilgjengelig for evaluering ved hjelp av noen av metodene. Hvorvidt det er etisk akseptabelt å ty til kirurgi for å oppnå svangerskap, er diskutabelt. Metoden, selv om det er foreslått av noen, anses av mange for å være uetisk og uakseptabelt stressende for tisken. Risikoen for infeksjon, etc. forbundet med kirurgi generelt og det begrensede antallet kirurgiske AI-ER som kan utføres i en gitt tispe, er to åpenbare ulemper. Metoden er også kostbar og tidkrevende.
1. Seager SWJ, Platz CC, Fletcher WS. Conception priser og relaterte data ved hjelp av frossen hund sæd. J. Reprod Fertil 1975; 45:189-192.
2. Linde-Forsberg C, Forsberg M. Fertilitet hos hunder i forhold til sædkvalitet og tid og sted for inseminasjon. J Reprod Fertil 1989; 39 (Suppl): 299-310. – PubMed –
3. Linde-Forsberg C, Forsberg M. Resultater av 527 kontrollerte kunstige inseminasjoner hos hunder. J Reprod Fertil 1993; 47 (Suppl): 313-323. – PubMed –
4. Linde-Forsberg C, Str@m Holst B, Govette G. Sammenligning av fertilitetsdata fra vaginal vs intrauterin inseminasjon av frosset tint hundesæd: en retrospektiv studie. Theriogenology 1999; 52: 11-23. – PubMed –
5. Linde-Forsberg C. Fertilitetsdata fra 2041 kontrollerte kunstige inseminasjoner hos hunder. I: Fortsetter av 4. Int Symp Canine Feline Reprod, Oslo, 2000, 120 s. (abstr.)
6. Thomassen R, Farstad W, Krogenaes, A, Fougner, J. A. Og Andersen Berg K. Kunstig inseminasjon med frossen sæd i hunden. En retrospektiv studie. J Reprod Fertil 2001, i pressen.
7. T. t., Kawakami E, Murao I, et al. Transport av spermatozoa i tikens reproduktive kanal: Observasjoner gjennom livmorfistler. Jpn J Vet Sci 1989; 51: 560-565. – PubMed –
8. Linde-Forsberg C. Kunstig inseminasjon med fersk, kjølt utvidet og frosset tint sæd i hunden. Seminarer I Vet Med Surg (Liten Dyr) 1995;10: 48-58.
9. Tsutsui T, Tezuka T, Shimizu T, Murao I, Kawakami E, Ogasa A. Kunstig inseminasjon med fersk sæd I beagle tisper. Jpn J Vet Sci 1988; 50: 193-198.
10. Andersen K. Inseminasjon med frossen hundesæd basert på en ny inseminasjonsteknikk. Zuchthyg 1975; 10: 1-4.
11. Linde C. Transport av radiopaque væske inn i livmoren etter vaginal avsetning i østrous tispe. Acta vet scand 1978; 19: 463-465.
12. Funkquist B, Lagerstedt A-S, Linde C, Obel N. Hysterografi i tispa. Vet Radiol 1985;26: 12-18.
13. Wilson M. Ikke-kirurgisk intrauterin kunstig inseminering hos tisper ved bruk av frossen sæd. J Reprod Fertil 1993; 47 (Suppl): 307-311. – PubMed –
14. Battista M, Parks J, Concannon PW. Canine sperm etter tining overlevelse etter frysing i sugerør eller pellets VED HJELP AV RØR, laktose, tris eller TEST extender. I: Proceedings of The 11th Int Congr Anim Reprod og AI, Dublin 1988;3: 229-231.
15. Wildt DE. Laparoskopi. I: Burke TJ, red. Reproduksjon av Små Dyr og Infertilitet. Philadelphia: Lea & Febiger, 1986; 121-140.
16. Silva LDM, Onclin K, Snaps F, Verstegen JP. Laparoskopisk intrauterin inseminering i tisken. Theriogenology 1995; 43: 615-623.
17. Silva LDM, Verstegen JP. Sammenligninger mellom tre forskjellige forlengere for hundens intrauterin inseminering med frosne tinte spermatozoer. Theriogenology 1995; 44: 571-579.
18. Silva LDM, Onclin K, Lejeune B, Verstegen JP. Sammenligninger av intravaginal og intrauterin inseminasjon av tisper med fersk eller frossen sæd. Vet Rec 1996;138: 154-157. – PubMed –
19. Smith FO, Graham EF: Kryopreservering av hundesæd: Teknikk og ytelse. I: Proceedings Av Xth Int Congr Anim Reprod og AI, Champaign-Urbana 1984; 2: 216.
20. HUTCHISON RV. Vaginal & kirurgisk intrauterin deponering av sæd. I: Proceedings Of Canine Theriogenology Kort Kurs 1993; 33-37.
21. HUTCHISON RV. Maksimere unnfangelsen priser ved hjelp av fersk avkjølt eller frossen hjørnetann sæd. I: Proceedings Of The Canine Male Reprod Symp 1997; 61-70.