Basicitet Av Aminer og pKaH
Kvantifisere Basiciteten Til Aminer, Ved Å Bruke «pKa Av Konjugatsyren», aka»pKaH»
hvordan måler du basiciteten til et amin? Case in point: hva er en sterkere base: pyridin eller piperidin?
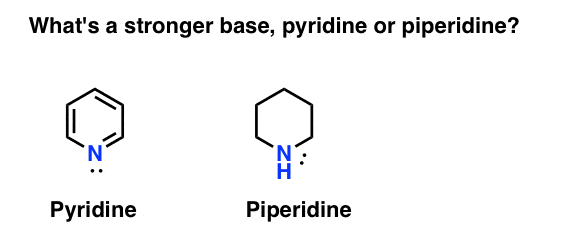
hvis du sa piperidin, gratulerer – det er faktisk en sterkere base.
Men hvorfor ? Hvor mye sterkere? Hvordan går man om å prøve å svare på disse spørsmålene? Tross alt kan vi enkelt sammenligne styrken av syrer ved å undersøke deres pKa. Burde vi Ikke kunne gjøre det samme med baser?
Ja, på en måte. Her er to viktige punkter for i dag:
- den beste måten å kvantifisere basiciteten til en amin er å undersøke pKa av dens konjugatsyre.
- jo høyere pka av konjugatsyren, desto sterkere er basen.
i dette innlegget vil vi vise noen konkrete eksempler på hvordan du bruker pka verdier for å sammenligne basicity av aminer.
i et senere innlegg vil vi da utforske noen viktige trender som ligger til grunn for aminenes grunnleggende egenskaper.
Innholdsfortegnelse
- Hurtig Gjennomgang: Syrer, Baser, Konjugerte Syrer og Konjugerte Baser
- Bruke pKa Til Å Måle Surhet
- Bruke pKa Til Å Kvantifisere Basisiteten Av Aminer
- «Pka Av Konjugatsyren» Kan Forkortes Som «pKaH»
- Bruke pKaH til Å Bestemme Den Relative Basisiteten Til Aminer
- Noen Ord Med Forsiktighet På pka-verdier for aminer
- hvilke viktige faktorer styrer basisiteten Til Aminer?
- Notater
1. Rask Gjennomgang: Syrer, Baser, Konjugat Syrer og Konjugat Baser
Først, La oss raskt gjennomgå noen grunnleggende grunnleggende.
det er fire aktører i hver syre-base reaksjon.basen er den arten som donerer et enkelt par Til H+ (også kjent som en «proton» eller «hydrogenkjerne»). Det er der den nye bindingen til h former (f. eks pyridin, under)
her er pyridin og piperidin i aksjon. Ved å følge obligasjonene som danner og bryter, kan du identifisere hver skuespiller.
2. Ved å Bruke pKa Til Å Måle Surhet
kan hver syrebasereaksjon skrives som en likevekt mellom en forover-og revers reaksjon. Vi har sett at surhetskonstanten, Ka, er et mål på hvor lett en art dissocierer for å gi H+ og konjugatbasen.
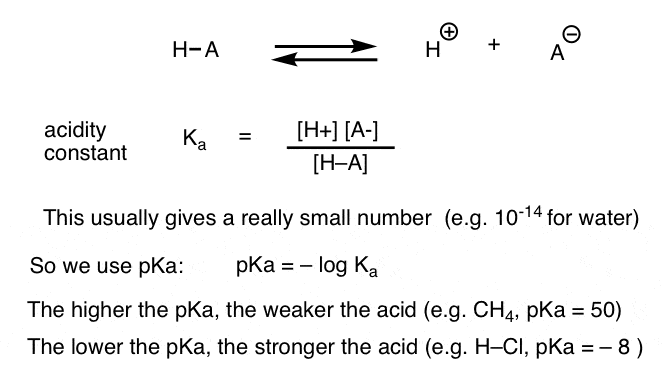
For enkelhets skyld bruker vi den negative loggen Til Ka, kalt pKa, som ligner den kjente pH-skalaen, men kan strekke seg utover 14 fordi den ikke er strengt begrenset til vandig løsningsmiddel. pKa-verdier varierer fra -10 eller så for svært sterke syrer (f. eks. hydroiodisk syre, H-I) til 50 og over for visse hydrokarboner (f.eks. etan).
Hvordan kan vi bruke disse konseptene for å måle basicitet? Kan vi ikke bytte ting rundt og definere Et Begrep, Kb , som er likevekten for hvor lett en art kombinerer Med H+, definere pKb som sin negative logg, og sammenligne baser ved å se på deres pkb-verdier?
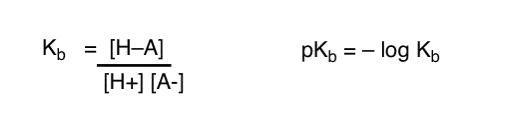
Ja…. vi kunne. Jeg antar det. Hvis vi måtte. Men generelt er organiske kjemikeres mening om dette emnet «Skrue pKb».
tross alt har pKa-verdier blitt målt for tusenvis av organiske molekyler. Ønsker noen virkelig å huske et stort sett med pKb-verdier også? Ikke faen!
I Stedet kan vi enkelt bruke pKa-verdier som en indirekte måling av basisitet. Slik gjør du det.
3. Bruk pKa-Verdier for Å Kvantifisere Basiciteten Av Aminer
Husk disse to utødelige linjene prosa, verdt å recitere til deg selv nattlig:
- jo sterkere syre, jo svakere er konjugatbasen.
- jo svakere syren, desto sterkere er konjugatbasen.
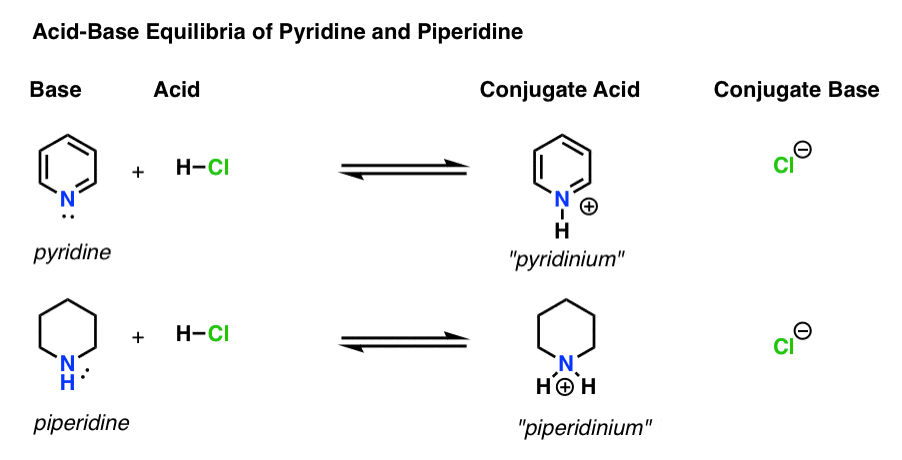
pKa for konjugatsyren av pyridin («pyridinium») er målt. Det handler om 5.2 .
Vi har også en verdi for pKa for konjugatsyren av piperidin. Det handler om 11 .
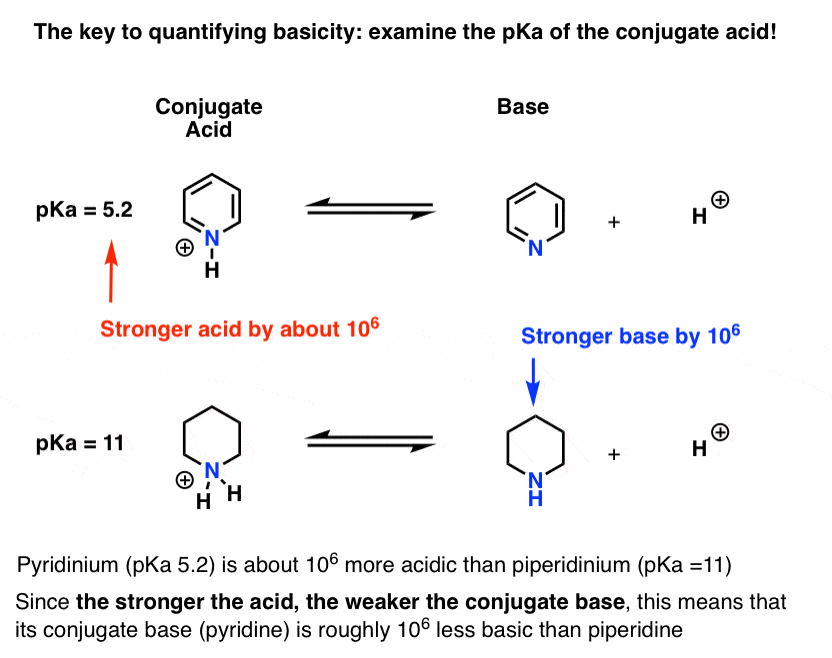
fra disse pka-verdiene kan vi fortelle at konjugatsyren av pyridin er sterkere enn konjugatsyren av piperidin med ca. 6 pka-enheter. Siden hver pKa-enhet representerer en faktor på 10, er det en faktor på ca 1 million.
siden» jo sterkere syren, jo svakere konjugatbasen», er pyridin derfor en svakere base enn piperidin med en faktor på 1 million.
4. «Pka Av Konjugatsyren «Kan Forkortes som»pKaH»
begrepet «pKa av konjugatsyren» er litt av en munnfull å bruke regelmessig. Å være naturlig lat, vil vi gjerne kondensere dette litt for vanlig bruk.
siden konjugatsyren til en base («B») er «BH», kan vi forkorte «pKa av konjugatsyren til en base» som sin pkah.
Dette lar oss si at pkah av pyridin er 5,2, og pkah av piperidin er 11.
vi kan da grave inn i litteraturen for å finne andre baser for å sammenligne det med.for eksempel, nøyaktig hvor grunnleggende er ammoniakk (NH3) ? Konjugatsyren av ammoniakk, NH4 (+), er 9,2 . Tilsvarende kan vi si at pkah av ammoniakk er 9,2. Dette setter det mellom pyridin og piperidin på basicitetsskalaen.
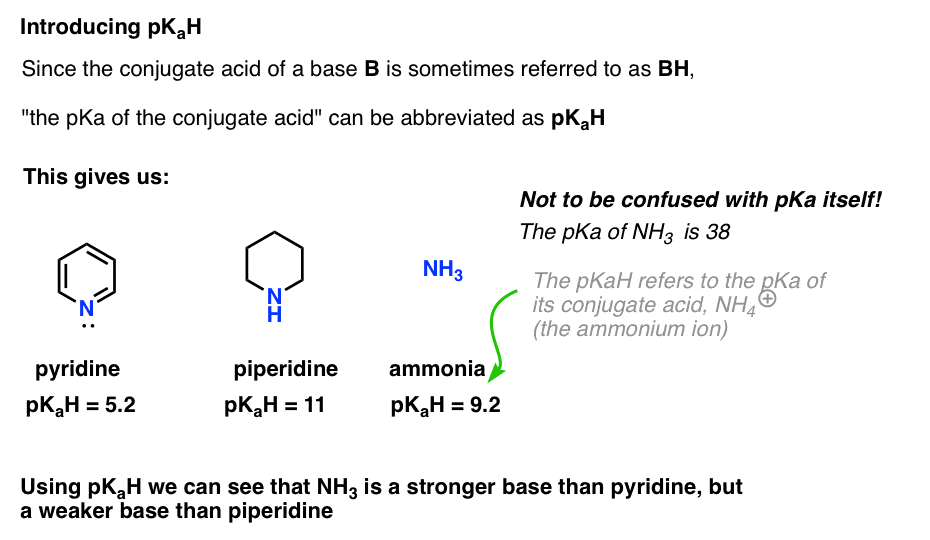
Merk at det er veldig viktig å ikke forveksle pKaH med pKa. Pkah av ammoniakk er 9,2, som måler surheten av dens konjugatsyre, NH4(+).
pka av ammoniakk i seg selv er 38, som måler likevektskonstanten FOR dissosiasjon AV NH3 for å gi sin konjugatbase, NH2 ( -) Og H+.
Det betyr at 38 er pKaH av amidionet NH2 ( – ), som du kanskje har møtt før som den sterke basen (NaNH2) som brukes til å deprotonere terminale alkyner (pKa =25). Ved hjelp av pKaH kan VI bestemme AT NH2 ( – ) er omtrent (38-9) = 29 størrelsesordener mer grunnleggende ENN NH3 !
5. Å Bruke pKaH for Å Bestemme Den Relative Basicities Av Aminer
Å Bruke pKaH for å bestemme den relative styrken av baser er et ganske nyttig triks.
Her er noen representative eksempler på nitrogenholdige molekyler. Nedenfor er pKa av deres konjugatsyrer.
Hva er den sterkeste basen her? Hva er det svakeste?
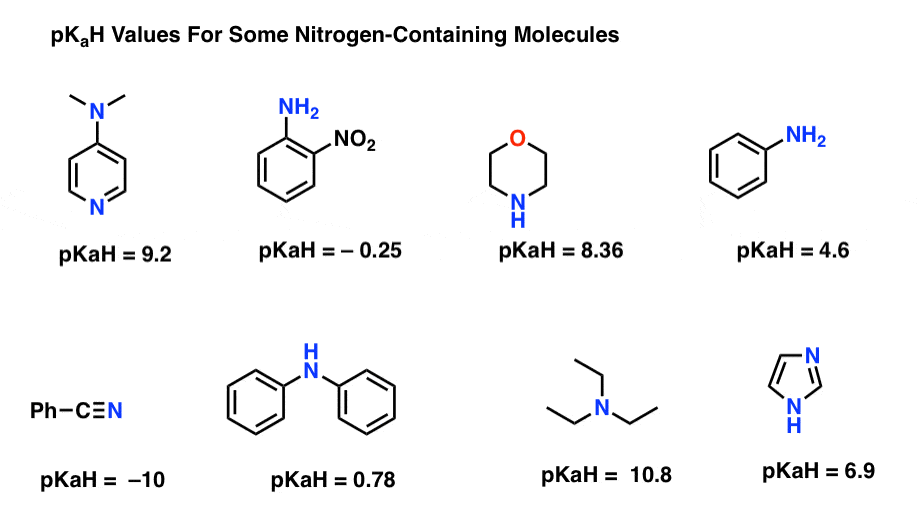
den laveste pkah-verdien her er -10 for nitrilen (nederst til venstre). Dette betyr at nitril er minst grunnleggende av alle disse molekylene.
den høyeste pkah-verdien her er 10,8 for trietylamin. Det gjør trietylamin den sterkeste basen ut av alle de som er oppført.
Noen Ord Med Forsiktighet På Pka-Verdier for Aminer
To ting å passe på, spesielt når du leser andre elektroniske kilder om dette emnet.
noen ganger rapporteres pKaH-verdiene for aminer som pka-verdier , uten forklaring. De beste pka-bordene vil ikke gjøre dette, men det er vanskelig å sortere hveten fra kafet når du bare starter.
hvis du ser en unormalt lav pka-verdi for et amin, refererer det sannsynligvis til pkah av konjugatsyren.For eksempel, Her er et pka-bord hvor pka av metylamin (CH3NH2) er oppført som 10.63.
det er lavt. Forhåpentligvis på dette punktet, bør en slik verdi på 10 for en pka av en amin slå deg så rart, spesielt siden pKa av den nært beslektede NH3 er 38.
verdien av 10,63 refererer faktisk til pka av konjugatsyren av metylamin, IKKE metylamin selv. Det er en pKaH-verdi.
på Samme måte viser samme tabell trimetylamin som å ha en pKa på 9,8 . Igjen, dette er faktisk sin pKaH. Jeg kan ikke finne en faktisk pka-verdi for trimetylamin, men jeg vil gjette at det er > 40, siden konjugatbasen av trimetylamin er carbanion (CH3)2N–CH2 (–)).en annen, mindre vanlig kilde til forvirring er at noen ganger er pKaH av et amin rapportert som dets pKb, slik som i denne tabellen som rapporterer PKB AV NH3 som 9.2 . Dette er unøyaktig.Igjen, pKb-verdier kommer egentlig ikke opp mye i organisk kjemi, selv om jeg blir fortalt at de noen ganger ser ut PÅ DAT/MCAT.
7. Hvilke Viktige Faktorer Styrer Basiciteten Til Aminer?
Nå som vi i det minste har lært å kvantifisere og tolke pka-verdiene av aminer og deres konjugat syrer, kan vi begynne å stille nøkkelspørsmålet: hvorfor? Hvilke viktige faktorer styrer basiciteten til aminer? Hva er de viktige trendene?for eksempel, hvorfor er pyridin en svakere base enn piperidin? Hvorfor er nitriler enda svakere baser? Hvorfor har elektron-trekkgrupper en tendens til å gjøre aminer svakere baser?Den gode nyheten er at hvis du allerede forstår faktorene som styrer surhet, må du bare bruke nøyaktig samme prinsipper-men omvendt!
vi vil dekke det i neste innlegg. Fem Faktorer Som Påvirker Basiciteten Av Aminer
Notater
Fotnote 1. DET er mange syrer som er ikke-baser (SOM NH4 som mangler et ensomt par) og mange baser som er ikke-syrer, Som Cl(–), som ikke er i stand til å akseptere et ensomt par. Derfor sier «jo sterkere syren, jo svakere basen» er feil.
Fotnote 2. Det er måling oppnådd ved bruk av vann som løsemiddel. Du kan se en annen verdi, 3,4, som oppnås når dimetylsulfoksid (DMSO) brukes som løsningsmiddel. Se Bordwell Pka Tabeller (DMSO)