글 태그”MO 이론,cycloaddition;유기화학전공,호모;LUMO;복합 시스템”
중 가장 도전적인 개념을 활용 시스템 반응은 분자 궤도 상호 작용,또는 MO 이론이다. 기초하여 이 원리를 이해하기 어려울 수 있지만,매우 유익 예측하는 올바른 반응의 조건과 결과의 반응하는 경우 당신은 그들을 이해,당신의 주요 장점에서 미래유! StudyOrgo 에서 우리는 당신의 연구 준비에 도움이 모 이론에 기초의 간단한 설명을 고안했다.
의 원칙 MO 이론
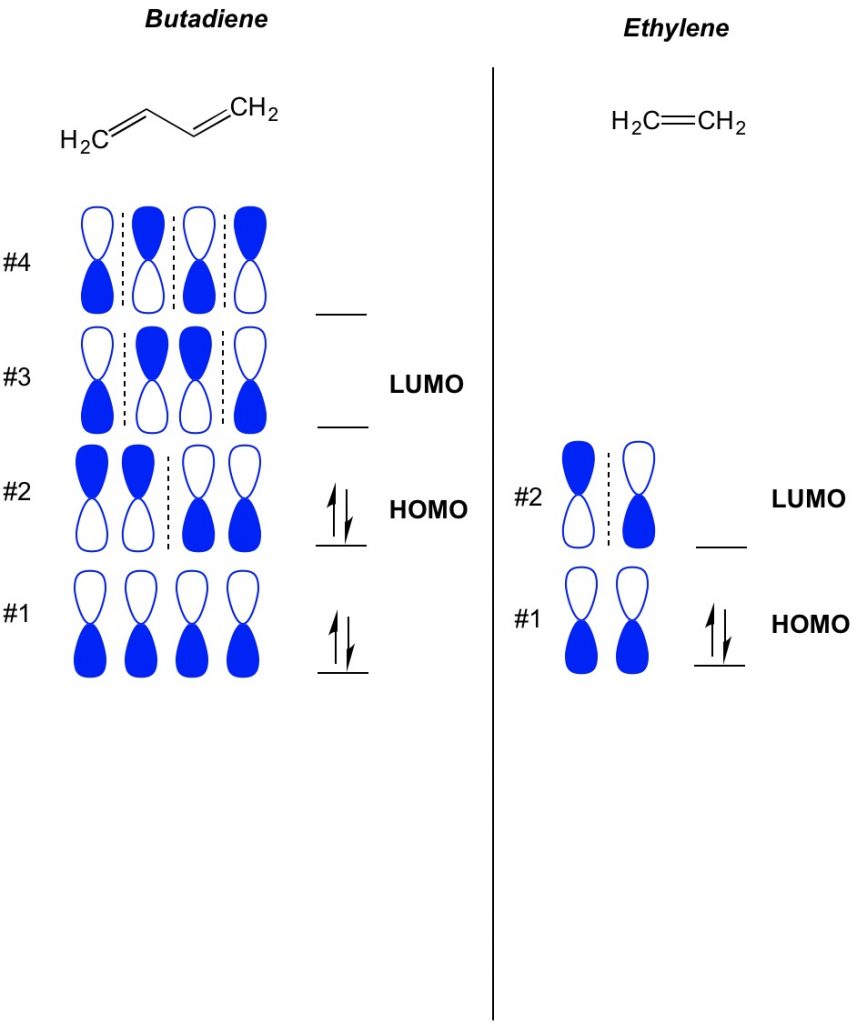
의 기본 개념 MO 이론을 설명하는 것입니다 번갈아 패턴의 궤도에 존재하는 파이 채권 시스템입니다. 우리는 원자를 중심으로 한 덤벨 궤도의 각 절반의 방향을 대담하거나 개방 된 것으로 묘사합니다. 결합 및 결합 방지 인공 위성이 있음을 기억하십시오. 기본적으로 궤도가 낮은 수의 노드(스위치의 방향령 궤도는 우리 쇼를 가진 점선)처럼 더 결합 orbitals 는 궤도로 높은 수의 노드처럼 행동 반대로 접착 orbitals. 을 확인 궤도가 점령지에서 분자,단순히 얼마나 많은 파이 채권에 활용된 시스템입니다. 아래는 부타디엔의 예입니다. 그것에는 4 개의 파이 전자는,그래서 우리가 채우는 가장 낮은 분자 궤도 첫째,두 개의에서 각각의 궤도. 따라서 부타디엔에서 가장 많이 점유 된 분자 궤도 또는 호모는#2 입니다. 결과적으로 부타디엔에서 가장 낮은 비어 있지 않은 분자 오비탈 또는 루모는#3 입니다. 을 확대할 수 있습니다 이 에틸렌시는 2 개의 파이 전자,분자 궤도#1 은 호모와 분자 궤도#2LUMO.
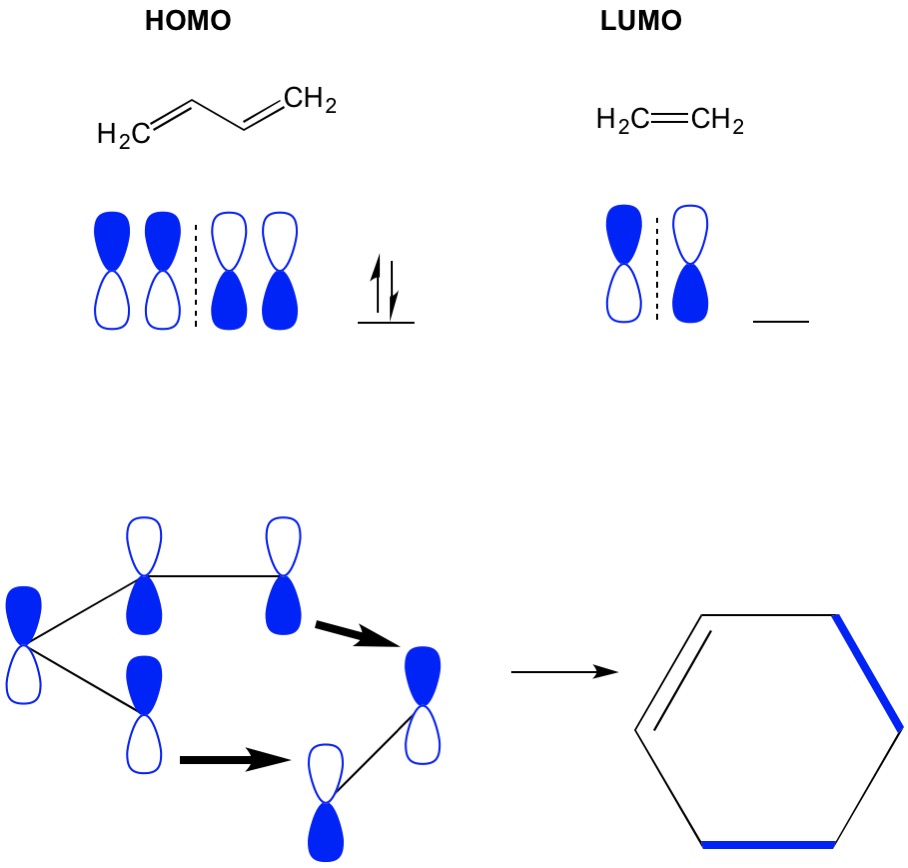
Cycloadditions MO 이론
기억 cycloaddition reactions 설명하의 형성이 새로운 C C sigma 채를 재배치의 파이 전자서에 활용된 시스템입니다. 따라서 우리는 pi 전자의 분자 인공 위성을 사용하여 반응을 유도해야합니다. 가장 단순한 디엘 알더 반응(4+2 시클로 디션)인 에틸렌과 부타디엔의 반응을 보자. 우리는 가장 접합 된 분자 인 부타디엔으로 시작하여 그 호모를 검사합니다. 그런 다음 우리는 가장 적은 공액 분자 인 에틸렌을보고 그 루모를 검사합니다. 왜? 우리는 호모에서 전자가 한 분자에서 다른 분자로 흐르도록해야하므로이 과정을 위해 점유되지 않은 루모 궤도를 사용해야합니다. 우리는 호모와 루모의 노드가 정렬되는 것을 봅니다;그것은 아령의 열리고 닫힌 반쪽이 정렬됩니다. 이것은 생성물 인 시클로 헥센의 전향 적 반응 및 형성을 유도한다.
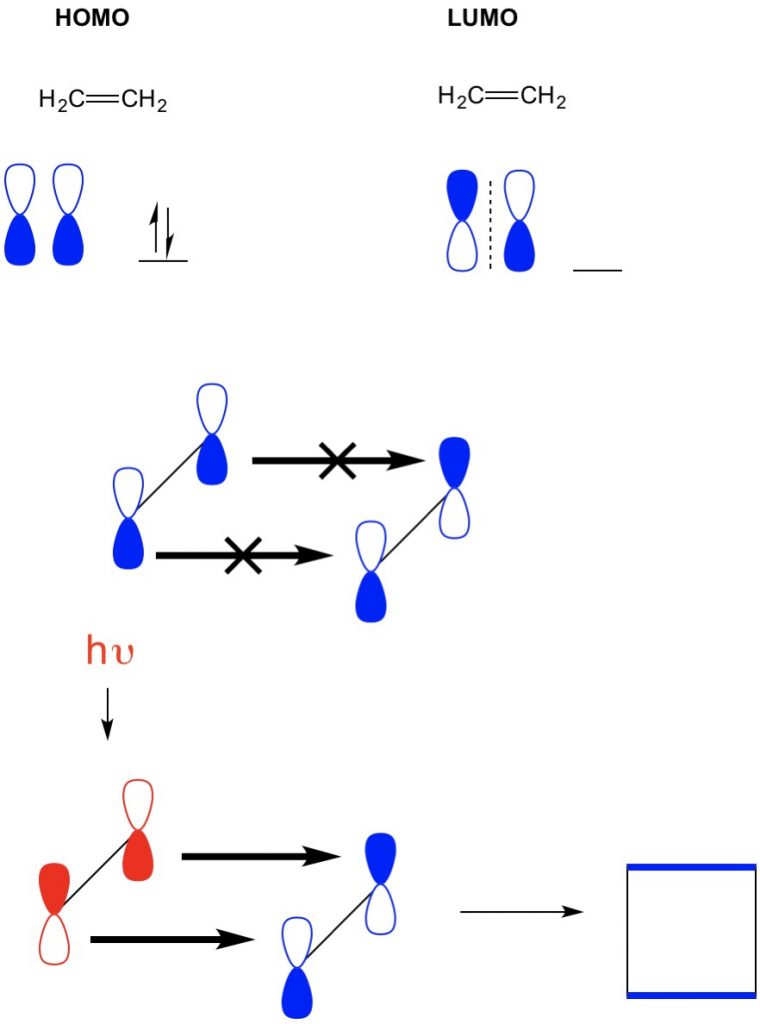
그러나,다른 예에서 우리는(2+2cycloaddition),우리가 호모 및 LUMO 에틸렌의 정렬하지 않습 따라서 금지하는 반응이다. 그러나 우리는 능력을 자극하는 전자서 호모를 더 높은 궤도 빛을 사용하여(hv)또는 열고,따라서 변경 HOMO. 우리는 이전 기사에서이 개념을 자세히 검토합니다. 우리가 이것을 할 때,호모의 에틸렌과 LUMO 의 바닥 상태 에틸렌 정렬하고 반응 생성 cyclobutane.
우리는 희망이 설명을 도왔다 명확히 이 개념의 MO 이론이다. 이것은 Orgo1 및 Orgo2 과정에서 흔히 볼 수있는 175 가지 이상의 반응에 대해 우리가 준비한 명확하고 간단한 expatiations 의 예입니다. 귀하의 연구 준비 요구에 오늘 가입하십시오!