小腸ブラシボーダー酵素
生体病態生理
小腸ブラシボーダー酵素
食物炭水化物とタンパク質の消化の最後のステップは、上皮細胞 消化のこの末端の段階に責任がある酵素は腸の内腔で自由、むしろ、enterocyteの原形質膜の必要な膜蛋白質としてつながれてではないです。 これらの酵素を収容する頂端原形質膜は、細胞から伸び、”ブラシ境界”を構成する多数の微絨毛から構成されている。 したがって、それらの微絨毛に埋め込まれた酵素は、ブラシ境界酵素と呼ばれる。
ブラシ境界酵素の密度および分布は、小腸の異なるセグメント間で異なり、しばしば動物の年齢に応じて変化する。 さらに、いくつかの場合において、そのような酵素の濃度は、食事によって調節され得る;例えば、高炭水化物食を与えられた動物におけるスクラーゼ−イソ
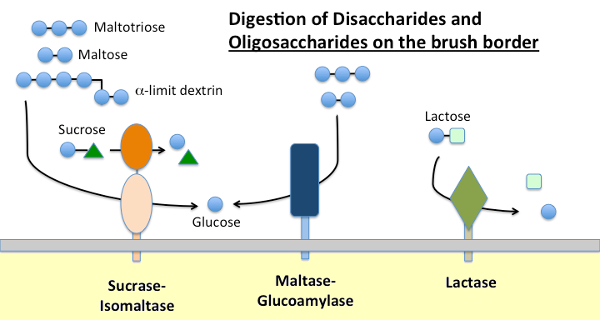
マルターゼ-グルコアミラーゼおよびスクラーゼ-イソマルターゼ
食事デンプンは、膵臓分泌物および多くの種では唾液中に存在するα-アミラーゼによ アミラーゼはデンプン中のα-1,4グリコシド結合を加水分解して、アミロペクチンの分岐点であるマルトース、短いオリゴ糖(例えばマルトトリオース)、いわゆるリミットデキストリンを生成する。 これらの分子のどれも小腸上皮を横切って吸収することができず、最終的にはグルコースへのさらなる加水分解を必要とする。
Maltase-glucoamylaseとsucrase-isomaltaseは、アミラーゼの作用によって提供される基質を用いて消化の終末段階を実行するブラシ境界膜に埋め込まれた密接に関連する酵素である。
- Maltase-glycoamylaseは二つの活性部位を有する。 マルターゼ部位は、マルトースまたはマルトトリオースから末端α-1,4-結合D-グルコース残基を加水分解し、α-D-グルコースを生成する。 グルコアミラーゼ部位はまた、α-1,4加水分解酵素活性を有するが、α-1,6グリコシド結合がα-1,4結合に隣接しているときに加水分解し、β-D-グルコースを遊離する。
- スクラーゼ-イソマルターゼはまた、異なる特異性を有する二つの活性部位を有する。 スクラーゼ部位は、スクラーゼのフルクトースおよびグルコースへの加水分解を触媒し、またマルトースを加水分解することができる。 イソマルターゼ部位は、限界デキストリンのα-1,6結合を消化するための主要なメカニズムとして重要である。
ラクターゼ
ラクターゼは、その名前が示すように、乳糖をガラクトースとグルコースに加水分解する二糖類であり、正式にはβ-グリコシダーゼである。 乳糖は牛乳中の主要な炭水化物であり、ラクターゼは若い哺乳動物の小腸ブラシ境界に豊富に存在する。 ヒトを含むほとんどの種では、離乳直後にラクターゼの発現が急落する。 大多数のヒトにおいて、成人期におけるラクターゼ活性のこの非持続性は、「乳糖不耐症」と関連している。 ラクターゼの持続性と非持続性の違いは遺伝的に決定される。
ペプチダーゼ
集合的に食事タンパク質に存在する多様なアミノ酸配列の多様性を加水分解することができるブラシボーダーペプチダーゼが多数存在する。 ペプチダーゼの主要なクラスは下記のものを含んでいます:ペプチダーゼからの末端のアミノ酸を加水分解する
- Exopeptidases。 これらの酵素のいくつかはC末端残基に対して活性を有し、他のものはN末端アミノ酸に作用する。 それらの活性は、遊離アミノ酸またはジペプチドをもたらす。 酵素の特定性および多様性の例として、aminopeptidase Pはdi-、三-およびオリゴペプチドからのn末端のアミノ酸をプロリンにつながるときだけ加水分解しますが、aminopeptidase Aはグルタミン酸塩およびアスパラギン酸塩のような末端の酸性アミノ酸の加水分解を触媒します。
- エンドペプチダーゼは、ペプチド鎖を内部的に切断し、様々な鎖長のより小さなペプチドをもたらす。
- 単一のジペプチダーゼもブラシ境界酵素として存在する。
エンテロペプチダーゼ(エンテロキナーゼ)は、トリプシノーゲンを膵臓からの主要なプロテアーゼの一つであるトリプシンに活性化する重要な活性を有する酵素である。 エンテロペプチダーゼは十二指腸に最も豊富に存在する。
リパーゼ
小腸のブラシ境界には多くのリパーゼが存在する。 これらにはホスホリパーゼB1、中性セラミダーゼ、アルカリ性スフィンゴミエリナーゼが含まれる。