化学学習者
座標共有結合とは何ですか?
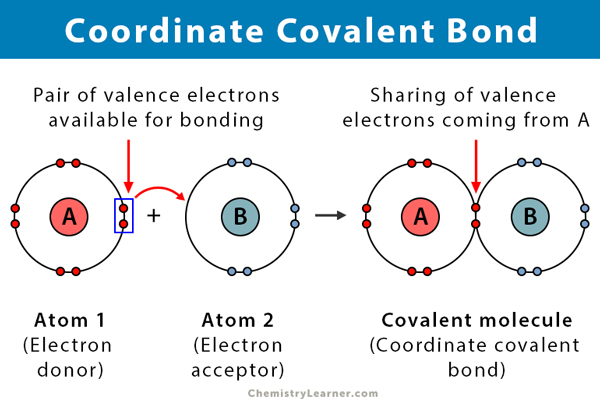
2つの原子が電子を共有すると共有結合が形成されます。 配位共有結合とも呼ばれる配位共有結合は、共有された電子対が原子の1つから来る共有結合の一種です。 核の両方が電子対を引き付けるため、原子は一緒に保持されています。 共有結合が形成されると、電子の起源を区別することは不可能である。 この種の結合は、典型的には、金属イオンと配位子との結合において観察される。 しかし、非金属もこの結合に参加することができます。 ルイス酸と塩基との反応は、配位共有結合である。
錯体イオンは、金属イオンと配位子と呼ばれる化合物の二つのものでできています。 配位子は、金属イオンと結合することができる孤立電子対を含む中性分子またはイオンである。 一般的な配位子はアンモニア(NH3)、水(H2O)、ハロゲン化物イオン(Cl-、Br-)である。 配位子は金属イオンと電子対を共有しているため、ルイス塩基と考えられている。 金属イオンは常に正であるため、孤立電子対には非常に魅力的です。
座標共有結合の事実と特性
座標共有結合は、共有結合のそれに多くの類似点を ここでは、その特性のいくつかは次のとおりです:
- 電子供与体と電子受容体の間で起こり、典型的には金属と配位子の間で起こる
- 異種原子間で起こる
- 原子のいずれかによって寄付された電子の共有によって形成される
- 剛体と方向性
- 極性
- 原子はオクテット則に従う
- 原子はオクテット則に従う
- 原子はオクテット則に従う
- 原子はオクテット則に従う
- 原子はオクテット則に従う
- 原子はオクテット則に従う
- 原子はオクテット則に従う
- 原子はオクテット則に従う
- 原子はオクテット則に従う
- 原子はオクテット則に従う電子を供与することはドナーと呼ばれ、それらを受け入れる原子はアクセプタと呼ばれます。
- 化合物は水に難溶性があります
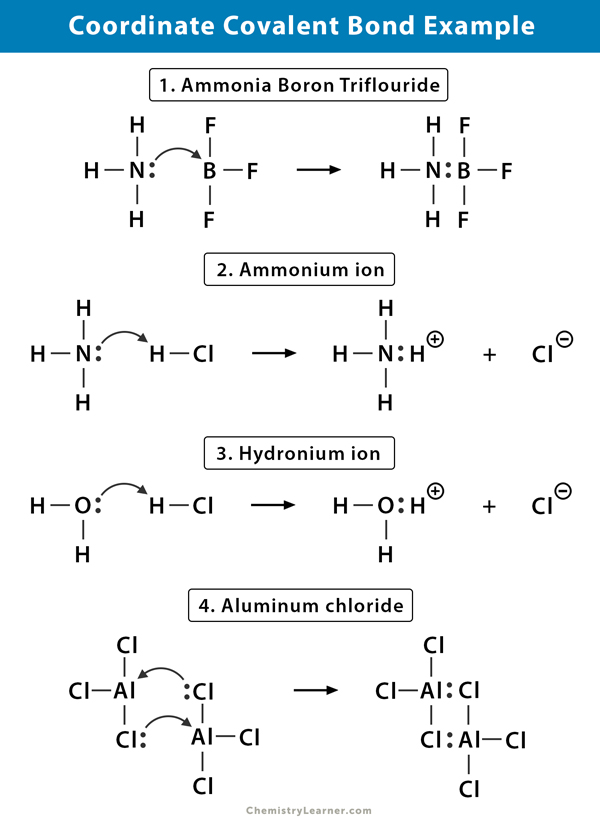
座標共有結合の例
ここでは、座標共有結合が存在する分子の例をいくつか示します。
アンモニウム(NH4+)イオン
アンモニウムイオンは、アンモニア(NH3)ガスと塩化水素(HCl)ガスとの反応から形成される。 NH4+では、水素の核だけが塩素から窒素に移動するため、第4の水素は座標共有結合によって結合されます。 水素の電子は塩素に残され、負の塩化物(Cl-)イオンを形成する。
アンモニア三フッ化ホウ素(NH3.BF3)
三フッ化ホウ素(BF3)は、ホウ素(B)原子の周りに希ガス構造を持たない化合物である。
三フッ化ホウ素(BF3)は、ホウ素(B)原子の周りに希ガス構造を持たない化合物である。
ホウ素はその価電子殻に三対の電子しか持たず、軌道を完成させるためには一対を必要とする。 したがって、BF3は電子欠損である。 アンモニア(NH3)分子の窒素(N)上の孤立電子対は、その欠乏を克服するために使用され、複雑な化合物は、座標共有結合を介して形成されます。塩化水素(HCl)ガスが水に溶解して塩酸(HCl aq。)、配位共有結合がヒドロニウムイオン中に形成される。 水素(H)核は水(H2O)分子に移され、水素を形成する電子の孤立した対を持っています。 したがって、Hは結合に電子を寄与しません。
塩化アルミニウム(Al2Cl6)
塩化アルミニウム(Al2Cl6)
塩化アルミニウム(Alcl3)中の結合は本質的に共有結合性である。
塩化アルミニウム(Al2Cl6)
塩化アルミニウム(Alcl3) それぞれのアルミニウム(Al)原子は、その価電子殻に二つの電子の欠損を有し、塩素(Cl)は孤立電子対を有する。 Alは隣接するAlcl3基上のCl原子と配位共有結合を形成する。 2つのAl原子のそれぞれがこれを行うので、塩化アルミニウムは式Al2Cl6を有する共有結合二量体分子である。一酸化炭素(CO)
炭素(C)はその価電子殻に4つの電子を持ち、酸素(O)は6つを持っています。
一酸化炭素(CO)
炭素(C)はその価電子殻に4つの電子を持ち、酸素(O)は6 炭素と酸素の両方が2つの電子を共有しています。 オクテット則は酸素に満たされているが、炭素上にはまだ二つの電子の欠損がある。 そのため、酸素は2つの電子を炭素と共有して、2つの規則的な(二重)共有結合に加えて、座標共有結合を形成します。