動物科学部-家畜に有毒な植物
ヒマシ豆の植物からのリシン毒素、Ricinus communis
リシンは知られている最も有毒な自然に起こ
ヒマシ豆の植物、Ricinus communisからの種子は、毒です人、動物、昆虫に。 主要な有毒な蛋白質の1つは彼が赤いbloodcellsの豆のエキスをテストし、それらが膠着するのを見たときにStillmarkによって1888年に示される”ricin”です。 今、私たちは凝集が原因であったことを知っていますRCA(Ricinus communisagglutinin)と呼ばれる別の毒素にも存在していました。 リシンは強力な細胞毒素であるが、弱いヘマグルチニンであり、asrcaは弱い細胞毒素であり、強力なヘマグルチニンである。
ヒマシ豆の摂取による中毒は、RCAが腸壁に浸透せず、静脈内投与しない限り赤血球に影響を与えないため、リシン、notRCAによるものである。 RCAが血に注入されれば、赤血球は溶血によって膠着し、破烈させます。
おそらく一ミリグラムのリシンだけが大人を殺すことができます。 人間の中毒の症状は、摂取から数時間以内に始まります。
症状は次のとおりです。
- 腹痛
- 嘔吐
- 下痢、時には血まみれ。
数日以内に
- 重度の脱水、
- 尿の減少、
- 血圧の低下があります。
死亡が3-5日以内に発生していない場合、被害者は通常回復します。ヒマシ豆の植物やネックレスから子供を遠ざけることをお勧めしますその種子で作られた。 実際には、小さな子供たちと一緒に家の中や周りにそれらを持っていないでください。 彼らは葉を摂取したり、種子を飲み込む場合、彼らはgetpoisoned可能性があります。 毒性の高い種子は、接触点で皮膚刺激を引き起こす。
種子が噛むことなく飲み込まれ、種子に損傷がない場合、それは消化管を無害に通過する可能性が最も高い。 但し、噛まれるか、または壊れ、そして次に飲み込まれれば、リシンの毒素は腸absorbedbyです。
ただ一つの種子が子供を殺すことができると言われています。 子供はより敏感です大人は嘔吐や下痢による体液喪失に陥り、すぐに完全に脱水されて死ぬことがあります。
庭のヒマシ豆の植物は、花や種子に許可されるべきではありません。
ヒマシ豆の植物、中毒、および油
 ヒマシ豆の植物、Ricinus communisは、その葉に見られる油のために、そのboldfoliageのためにいくつかの品種で”熱帯Africacultivated”(アルバーとアルバー)
ヒマシ豆の植物、Ricinus communisは、その葉に見られる油のために、そのboldfoliageのためにいくつかの品種で”熱帯Africacultivated”(アルバーとアルバー)
“茎の葉は、通常、わずかに鋸歯状のエッジと顕著な中心静脈を持つ八放射、尖ったリーフレットで構成されています。 多くの品種が緑ですが、いくつかは赤褐色です。”(Cooper and Johnson)花は緑色で目立たないが、着色された品種ではピンクまたは赤である。 多くの雌蕊は基部近くにあり、枝分かれした雌蕊は花の頂部近くにある。 魅力的な斑点のある種子を含む柔らかい棘のある果実植物の特徴である。 それは庭の装飾品として、時には観葉植物として栽培され、雑草として成長する。 それは南の年次および熱帯の多年生植物であり、”15フィートの高い屋外”に達するかもしれない。 それはEuphorbiacea(Spurge)の家族に属する木質のハーブです。
ヒマシ豆中毒-子供
 ヒマシ豆の植物やその種で作られたネックレスから子供を遠ざけることをお勧めします。 実際には、小さな子供たちと一緒に家の中や周りにもそれらを持っていません。 彼らは葉を摂取したり、種子を飲み込む場合、彼らはgetpoisoned可能性があります。 毒性の高い種子は、接触点で皮膚刺激を引き起こす。
ヒマシ豆の植物やその種で作られたネックレスから子供を遠ざけることをお勧めします。 実際には、小さな子供たちと一緒に家の中や周りにもそれらを持っていません。 彼らは葉を摂取したり、種子を飲み込む場合、彼らはgetpoisoned可能性があります。 毒性の高い種子は、接触点で皮膚刺激を引き起こす。
種子が噛むことなく飲み込まれ、種子に損傷がない場合、それは消化管を無害に通過する可能性が最も高い。 但し、噛まれるか、または壊れ、そして次に飲み込まれれば、リシンの毒素は腸absorbedbyです。
ただ一つの種子が子供を殺すことができると言われています。 子供はより敏感です大人は嘔吐や下痢による体液喪失に陥り、すぐに完全に脱水されて死ぬことがあります。
庭のヒマシ豆の植物は、花や種子に許可されるべきではありません。 Agoodの練習は、”芽にそれをニップ”することです。
殺人
 1978年、リシンは1978年にブルガリア政府に反対したブルガリアのジャーナリストであるゲオルギ-マルコフを暗殺するために使用された。 ロンドンのウォータールー駅近くのバス停で待っている間、彼は傘のポイントでwasstabbed。 彼らは、おそらくリシン毒素を含んでいた彼の足に埋め込まれた穿孔された金属ペレットを発見しました。
1978年、リシンは1978年にブルガリア政府に反対したブルガリアのジャーナリストであるゲオルギ-マルコフを暗殺するために使用された。 ロンドンのウォータールー駅近くのバス停で待っている間、彼は傘のポイントでwasstabbed。 彼らは、おそらくリシン毒素を含んでいた彼の足に埋め込まれた穿孔された金属ペレットを発見しました。
動物
 アブラムシは、ヒマシ豆の植物の葉の上に右に描かれ、師部を摂取することから中毒を受けやすい。 樹液吸盤は摂食の24時間以内に死亡した。
アブラムシは、ヒマシ豆の植物の葉の上に右に描かれ、師部を摂取することから中毒を受けやすい。 樹液吸盤は摂食の24時間以内に死亡した。
ヨーロッパのコーンボーラーと南部のコーンルートワームの幼虫は、2%のリシンで塗装された飼料にさらされたときに殺されました。 これらのような研究は、”天然”農薬を開発するために取られています。
ヒマシ豆は、オイルが抽出または140℃で20分間加熱することによって不活性化された後、いくつかの動物飼料の成分として使用されます。
ヒマシ豆は、140℃で20分間加熱することによって不活性化された。 家畜の飼料にヒマシ豆を使用する試みは、栄養価を維持しながらリシンを不活性化する異なる方法を伴う。 いくつかの研究では、このような熱処理を行っても毒性が残ることが示されている。 例えば、それは飼料を与えられたマガモのアヒルに致命的でした。 「肉の毒性は、熱安定性または成長阻害因子のいずれか、またはリシンの微量残基によるものであるはずである」(Okoye et al.) 羊を用いた研究では、オートクレーブされたヒマシ豆の食事は、悪影響なしに羊の配給量の10%に組み込むことができることが示
羊を用いた研究では、オートクレーブされたヒマシ豆の食事は、悪影響なしに羊の配給量の10%に組み込むことができることが示
家畜の中毒は、通常、ヒマシ人を飼料に偶発的に組み込むことによって起こります。 馬は特に脆弱です。
家畜に対するリシンの影響の詳細については、を参照してください。..”有毒植物ページ、Ricinus Communis、http://res.agr.ca./
ヒマシ油
ヒマシ豆は、薬用目的に使用されるヒマシ油を抽出するために押されています。 リシンは水溶性であるため油に分配されないため、ヒマシ油にはリシンが含まれていませんが、生産中にクロス汚染が発生した場合は含まれません。
それらを記述する詳細は、カナダの有毒植物情報システム、derek B.Munroの礼儀で、Castor Beanのリストの下で入手できます。
毒性作用のメカニズム
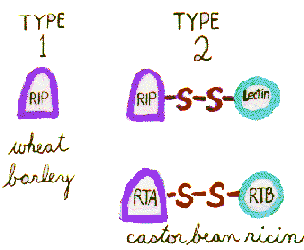 様々な植物からの多くの細胞傷害性タンパク質が同定されており、構造と機能の両方でリシンに関連している。 それらは特異的かつ不可逆的に核生物のリボソームを不活性化することによってタンパク質の合成を阻害する。
様々な植物からの多くの細胞傷害性タンパク質が同定されており、構造と機能の両方でリシンに関連している。 それらは特異的かつ不可逆的に核生物のリボソームを不活性化することによってタンパク質の合成を阻害する。
これらの”リボソーム不活性化タンパク質”(RIPs)は、典型的にはn-グリコシル化された30kDa単量体(タイプ1RIPs)である。 しかし、細胞表面のガラクトシドに結合し、リボソームに到達するために細胞質ゾルに入るためには、ガラクトース結合30kDaレクチンという第二のモノマーが必要である。 それらのモノマーはジスルフィド橋によって結合され、有毒なヘテロ二量体(タイプ2RIPs)を形成する。
小麦やバラなどのいくつかの植物は、タイプ1ripsのみを持ち、有毒ではありませんが、castorbean植物の種子などの他の植物は、自然界で最も強力な細胞毒の中にあるタイプ2RIPsを含んでいます。 リシヌス種子の5%はリシンとRCA(Ricinus communisagglutinin)で構成されています。
リシンはヘテロ二量体2型RIPである。 このリボソーム不活性化酵素(32kda)は、a鎖としても知られており、ガラクトース/N-アセチルガラクトサミン結合レクチン(34kDa)にジスルフィド結合によって連結され、B鎖とも呼ばれる。
リシン生合成
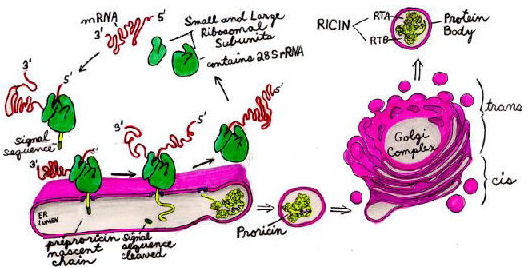
リシンとRCAは、成熟した種子の胚乳細胞で合成され、”タンパク質体”と呼ばれる細胞小器官、空胞コンパートメントに格納されています。 成熟した種子が発芽すると、毒素は加水分解によって破壊される数日以内に。
リシンは、A鎖とB鎖の両方を含むプレプロポリペプチドとしてsythesisを開始します。 Nh3末端のシグナル配列は小胞体(ER)への鎖を標的とし、その後切断される。 プロリシンポリペプチドが伸長すると、それはERの内腔内でN-グリコシル化される。 プロテインジスルフィドイソメラーゼは、プロリシン分子がそれ自身を折り畳むようにジスルフィド結合形成を触媒する。 プロリシンのundergoesfurtherのオリゴ糖の修正はゴルジの複合体のandthen内で蛋白質ボディに小胞の内で運ばれます。
リシンは、タンパク質体内のアネンドペプチダーゼによってタンパク分解性に切断されるまで触媒的に活性ではない。 これは、単一のジスルフィド結合によってまだ連結されているa鎖とB鎖にポリペプチドを分割する。 リシンはそれまで不活性であるため、合成と輸送の間に何らかのプロリシンが誤ってサイトゾルに通過した場合に備えて、植物はそれ自身のリボソームを中毒させることを避ける。
リシン酵素作用
ヘテロ二量体の一部であるリシンは、28S rRNAの特定のアデニンに結合し、デプリネートする酵素である。 リボソームのアデニンは、酵素の裂け目で二つのチロシン環の間に挟まれ、酵素のグリコシダーゼ作用によって加水分解される。 標的アデニンは、特異的なRNA配列であり、異常なテトラヌクレオチドループGAGAを含む。 リシンは植物のリボソームよりも動物に対して活性であり、無傷の細菌のリボソームは一般的に感受性ではない。
リシン構造
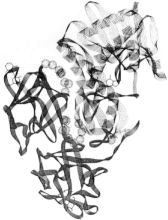 Lordらのこの図は、x線結晶学データからモデル化されたリシンの3次元リボン図を示しています。右上半分の点線のリボンはa鎖であり、左下半分の実線のリボンはB鎖である。 A鎖(またはRTA)は267アミノ酸球状タンパク質である。
Lordらのこの図は、x線結晶学データからモデル化されたリシンの3次元リボン図を示しています。右上半分の点線のリボンはa鎖であり、左下半分の実線のリボンはB鎖である。 A鎖(またはRTA)は267アミノ酸球状タンパク質である。
それは8αヘリックスと8ベータシートを持っています。 基質結合部位は基質アデニン環によって裂け目である。 B鎖(またはRTB)は、abarbellのような形をした262アミノ酸タンパク質です。
それぞれの末端にガラクトースの結合部位がある(ラクトース)。 これら二つのサイトは、特定の膜糖(ガラクトースとN-アセチルガラクトサミン)に水素結合を可能にします。 ジスルフィド橋(-S-S-)はRtb(右端、中央)とRTAwithと合流する。 球は閉じ込められた水分子です。
リシン取り込み
リシンのRTB部分は、ガラクトースで終わる細胞表面で糖タンパク質と糖脂質の両方に結合する。 それはガラクトースのための二つの結合部位を有し、106から108個のリシン分子が細胞ごとに結合することができる。 しかし、細胞質ゾルに入る単一分子だけで1,500以上のリボソームを不活性化し、細胞を死滅させることができる。
図に示すように、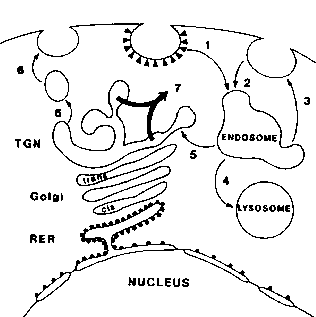 リシンの内在化のための経路は、
リシンの内在化のための経路は、
- コーティングされたピットおよび小胞によるエンドサイトーシス、または
- 滑らかなピットおよび小胞によるエンドサイトーシスを含む。 小胞はアネンドソームと融合する。
- 多くのリシン分子がエキソサイトーシスによって細胞表面に戻されるか、または
- 小胞がリシンが破壊されるリソソームに融合することがある。
- リシン含有小胞がトランスゴルジネットワーク(TGN)に融合すると、まだ
- 細胞表面に戻る可能性があります。
- RTBによって助けられるRTAがTGNmembraneを突き通し、cytosolに解放されるとき有毒な行為は起こります。
サイトゾルの中に入ると、rtaはリボソームの脱プリン化を触媒し、タンパク質合成を停止させる。
免疫毒素の治療的応用
リシンは、RTAサブユニットを不要な細胞に優先的に結合する抗体または増殖因子に結合させることにより、癌細胞などの特 これらの免疫毒素はin vitroの適用、例えば骨髄の移植のために非常によく働きました。 彼らは多くのin vivoの状況で非常によく働いていないが、研究のこの分野の進歩は、将来のための約束を示しています。
IN VITROアプリケーション
骨髄移植手順では、rta-immunotoxinshaveは、組織適合性ドナーから採取した骨marrowtakedのTリンパ球を破壊するために正常に使用されて これは、「移植片対宿主病」(GVHD)と呼ばれる問題である、ドナー骨髄の拒絶反応を減少させる。 ステロイド耐性の急性GVDH状況では、RTA-免疫毒素が助けられた状態を緩和する。 また、自己骨髄移植では、患者自身の骨髄のサンプルを抗T細胞免疫毒素で処理し、T細胞白血病およびリンパ腫における悪性T細胞を破壊する。
in VIVOアプリケーション
“固形腫瘍のin vivo治療のために、かなりの問題は、腫瘍塊への免疫毒素(IT)の貧弱なアクセスに起因することができます;IT特異性の欠如、腫瘍細胞heterogeneity、抗原脱落、破壊またはITの迅速なクリアランス、および用量制限の副作用”。 (Lord et al.). リシン-イムノトキシンで治療された入院患者に遭遇する一般的な問題の一つは、低アルブミン血症、体重増加および肺水腫につながる血管からの流体の漏出である”血管漏出症候群”である。 “癌およびエイズの臨床使用のための免疫毒素および療法を拡大し、開発するための研究努力は組換えDNAの技術を利用する作戦と続きます(Lord et al.).
Toxigenic Ablation
Toxigenes
“Toxigenesは、強力な毒素、例えばRTAをコードするDNAが組織または開発段階特異的プロモーターおよび/またはエンハンサーの転写制御下に配置されているDNA融合である。 細胞内で発現すると、トキシゲン生成物は細胞死を引き起こす。 トランスジェニック動物や植物におけるアトキシゲンの導入と発現は、発生細胞系統を研究したり、変性疾患の動物モデルを生成するために使用す”(Lord et al.)
自殺輸送
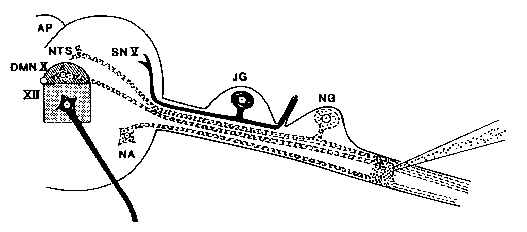
図は、迷走神経へのリシンの注入とその後のニューロンの破壊(破線のニューロンが破壊され、固体ニュー神経科学者は、神経にリシンを注入することによって選択的にニューロンを破壊することができます。
神経科学者は、神経にリシンを注入するこ 逆行性軸索輸送機構は、リボソームが局在している神経細胞体に毒素をもたらす。
超微細構造解析は、リシンが最初にポリリボソームの分散を引き起こし、その後、粗い小胞体が滑らかな小胞に分解することを明らかにする。 細胞体(ペリカリオン)が膨潤し、核が縮退するニューロン全体が崩壊する。
リシンはN-アセチルガラクトサミン結合レクチンであるため、グリコシル化の神経パターンの特異性が異なる異なるレクチンで使用することができる。 自殺輸送がthetoxinの注入の後で観察されるとき、神経の細胞の表面のNアセチルガラクトサミンの残余の存在を確認します。 自殺輸送における戦略は、リシンに敏感であるため、成人の末梢感覚および運動ニューロンの研究に非常によく働く。
成人の中枢神経系のニューロンはリシンによるアブレーションに耐性があるのに対し、若い発達中の脳は敏感であり、脳の発達はCNSニューロンのグリコシル ガラクトセターミナル残基は、シアル酸の添加によってクリップされるかマスクされるかのいずれかである。
自殺輸送実験では、多くの場合、いくつかのリシンが動物の全身中毒を引き起こし、thenerveから漏れます。 この問題は、リシン抗血清を同時に投与することによって回避することができる。
自殺輸送戦略を使用することの価値は要約されています(Wileyand Oeltmannから):
- ニューロンの解剖学的マッピング
- 運動ニューロン変性疾患のモデリング
- 末梢神経損傷と修復機構の結果を研究
- 細胞神経伝達物質受容体のマッピング
- 三叉神経ニューロンにおける潜伏期単純ヘルペスウイルスの根絶
- グリア線維束の生産と分析
- 馬神経腫の治療
アルバー、j.i.、およびd.M.アルバー。 (1993)赤ちゃんの安全な観葉植物とカットフラワー: 同じ屋根の下で安全に子供や植物を維持するためのガイド。株式会社ストーリーコミュニケーションズ、パウナル、バーモント州。
クーパー、M.R.、A.W.ジョンソン。 (1994)有毒植物および菌類:イラストレーションガイド。 CAB国際動物衛生局、ウェイブリッジ、ロンドン。
Czapla、T.H.、およびI.A.Johnston。 (1990)ヨーロッパのコーンボーラー(鱗翅目:pyralidae)とサザンコーンルートワーム(鞘翅目:chrysomelidae)の幼虫の発達に対する植物レクチンの影響。 J.Econ. アントモール、ランハム、Md。:アメリカ昆虫学会,83(6):2480-2485.
フランケル、A.E. ら、(1 9 9 3)Immunotoxin Therapy o f Cancer. 腫瘍学(ハンティントン)、7(5):69-78;discussion79-80、83-6。
Knight,B.(1979)Ricin-強力な殺人毒。 Br. メッド J.278:350-351。
Lord,J.M.,Roberts,L.M.,J.D.Robertus.
(1994). FASEB J.Feb;8(2):201-8.
Matthews,R.W.,J.R.Matthews(1978). 昆虫の行動、パブ。 株式会社ワイリーアンドサンズ ^『ニューヨーク』、507頁。
Okoye、JOA、Enunwaonye、CA。 Okorie,A.U.and F.O.I.Anugwa(1987).———– 鳥の病原菌。 16(2):283-290.
Olaifa,J.I.,Matsumura,F.,Zeevaart,J.A.D.,Mullin,C>A>、およびP.Charalambous。 (1991)ヒマシ豆の植物に与えられた緑のモモのアブラムシのricinineの致死量mysus-persicae suzler。 植物科学 (リムリック)、73(2):253-256。Purushotham,N.P.,Rao,M.S.,およびG.V.Raghavan(1986). ヒツジの濃縮物の混合物のofcastor食事の利用。 インドのJ.アニム。 サイ…56(10):1090-1093.
Robertus,J.D.(1988). 毒素の構造。 がん治療。 37:11-24。
Robertus,J.D.(1991)細胞傷害性グリコシダーゼであるリシンの構造と作用。 セム 細胞Biolで。 2:23-30.Sorpe,(1 9 9 1)Immunotoxins containing ricin o r Itsa chain,Sem. 細胞Biolで。 2:47-58.Oeltmann,(1 9 9 1)Ricin and Related Plant Toxins:Mechanisms o f Action and Neurobiological Applications;In,Handbook o f Natural Toxins,Vol.6、エド。 R.F.Keeler and A.T.Tu,Marcel Dekker,Inc.、ニューヨーク。