タグ付きの投稿”MO理論;環化付加;有機化学;HOMO;LUMO;共役系”
共役系反応における最も挑戦的な概念の一つは、分子軌道相互作用、またはMO理論です。 この原則の基本は把握するのが難しいかもしれませんが、あなたがそれらを理解していれば、正しい反応条件と反応の結果を予測する上で非常に StudyOrgoでは、あなたの研究準備のお手伝いをするためにMO理論への基本の簡単な説明を考案しました。
MO理論の原理
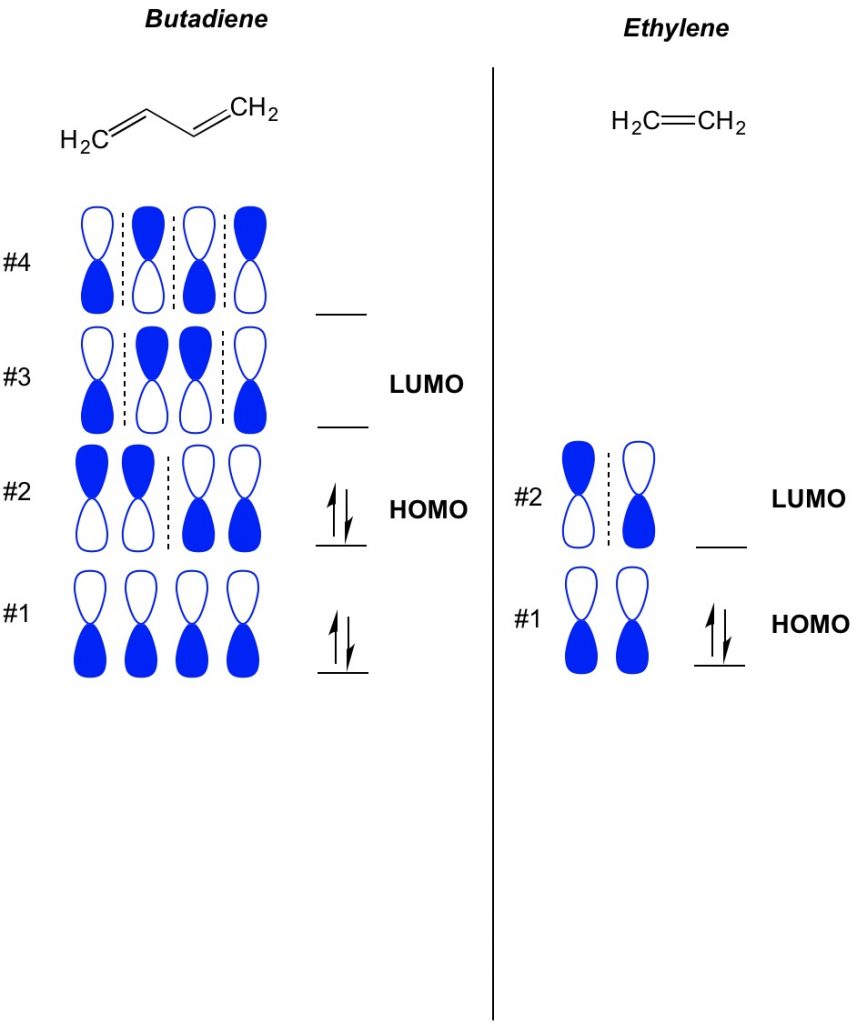
MO理論の基本的な概念は、pi結合系に存在する軌道の交互のパターンを記述することです。 原子を中心としたダンベル軌道の各半分の向きを太字または開いているものとして説明します。 覚えておいてください、結合軌道と反結合軌道があります。 基本的に、ノードの数が少ない軌道(破線で示すダンベル軌道の向きのスイッチ)は結合軌道のように振る舞い、ノードの数が多い軌道は反結合軌道のように振る舞う。 分子上でどの軌道が占有されているかを判断するには、共役系にいくつのπ結合があるかを数えます。 以下はブタジエンの例である。 それは4つのπ電子を持っているので、我々は最初に最低分子軌道を埋める、各軌道に2つ。 したがって、ブタジエン中の最も高い占有分子軌道、すなわちホモは#2である。 その結果、ブタジエン中の最も低い占有されていない分子オビタール、またはLUMOは、#3である。 これをエチレンに拡張し、2π電子では、分子軌道#1がHOMOであり、分子軌道#2がLUMOであることがわかります。
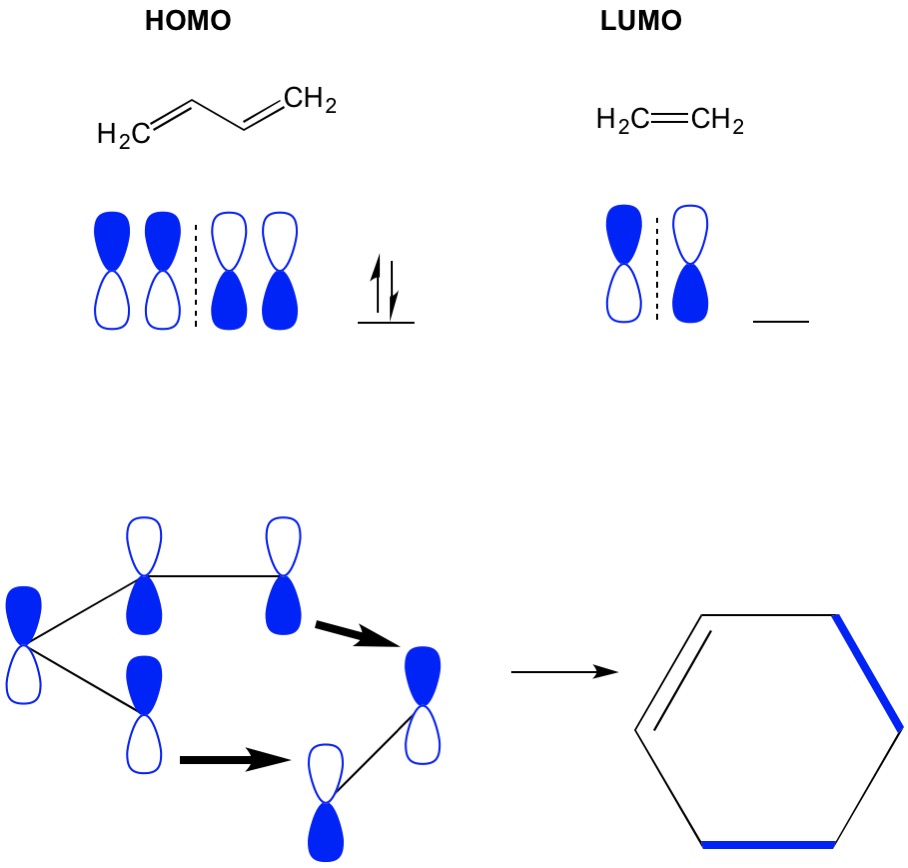
環化付加MO理論
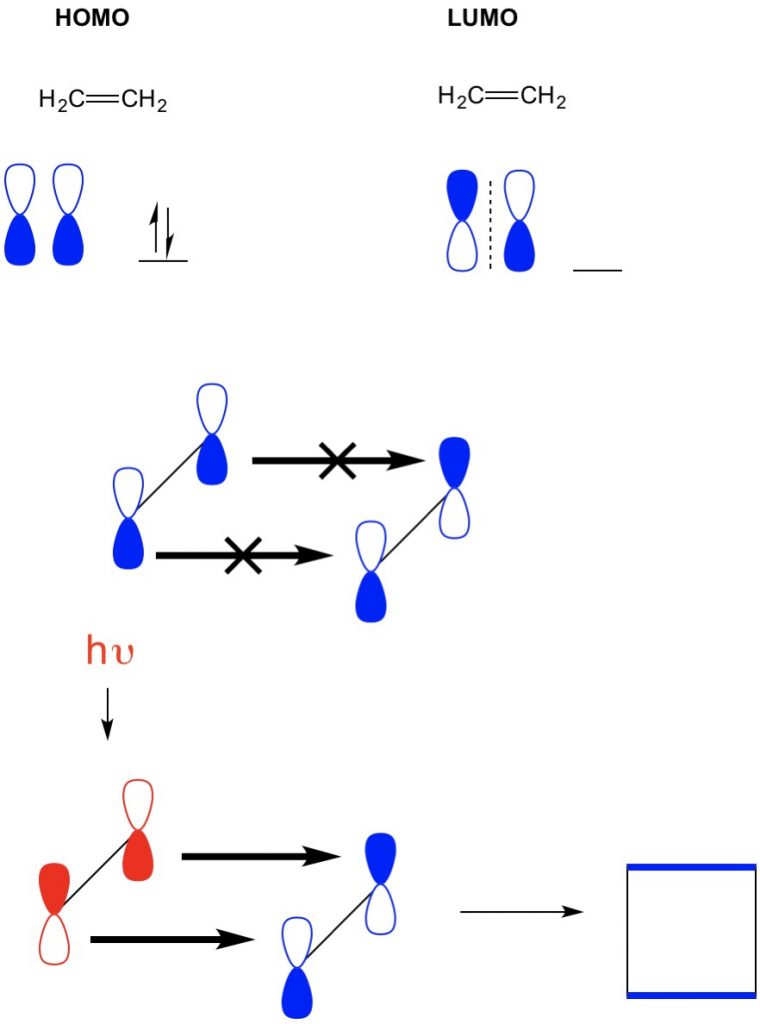
環化付加反応は、共役系中のpi電子の再配置による新しいC-Cシグマ結合の形成を記述すること したがって、我々は反応を駆動するためにπ電子の分子軌道を使用する必要があります。 最も単純なディールスアルダー反応(4+2環化付加)であるブタジエンとエチレンの反応を見てみましょう。 我々は、最も共役分子、ブタジエンから開始し、そのホモを調べます。 次に、最小共役分子であるエチレンを見て、そのLUMOを調べます。 どうして? 我々は、ある分子から別の分子に流れるためにホモからの電子を必要とするので、我々はこのプロセスのために占有されていないLUMO軌道を使用する必 我々は、ホモとLUMOのノードが整列していることがわかります。 これは、前方反応および生成物、シクロヘキセンの形成をもたらす。しかし、我々は(2+2環化付加)を持っている別の例では、我々はエチレンのホモとLUMOが整列していないので、反応を禁止参照してください。
しかし、我々は(2+2環化付加)を持っている別の例では、エチレンのホモとLUMOが整列していないので、反応を禁止しています。 しかし、我々は光(hv)または熱を使用してHOMOからより高い軌道に電子を励起し、したがってHOMOを変化させる能力を持っています。 この概念については、前回の記事で詳しく説明します。 これを行うと,励起エチレンのHOMOと基底状態エチレンのLUMOが整列し,反応はシクロブタンを生成する。
この説明がMO理論のこの概念を明確にするのに役立つことを願っています。 これは、私たちが一般的にOrgo1とOrgo2のコースで見られる175以上の反応のために準備した明確で簡単なexpatiationsの例です。 あなたの研究の準備のニーズのために今日サインアップ!