アミンとpKaHの塩基度
“共役酸のpKa”、別名”pKaH”を使用して、アミンの塩基度を定量化
アミンの塩基度を測定するにはどうすればよいですか? ポイントのケース:より強いベースは何ですか:ピリジンまたはピペリジン?
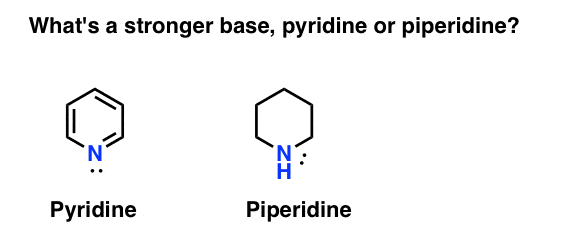
あなたはピペリジンを言った場合、おめでとう–それは確かに強しかし、なぜですか?
そして、どのくらい強いですか? どのようにこれらの質問に答えようとしていますか? 結局のところ、pKaを調べることで酸の強さを簡単に比較することができます。塩基でも同じことができるはずではありませんか?
はい、ある意味で。 ここでは、今日のための二つの重要なポイントです:
- アミンの塩基度を定量化するための最良の方法は、その共役酸のpKaを調べることです。
- 共役酸のpKaが高いほど、塩基は強くなります。
- 共役酸のpKaが高いほど、塩基は強くなります。 この記事では、pka値を使用してアミンの塩基度を比較する方法の具体的な例をいくつか示します。
次の記事では、アミンの塩基性の基礎となるいくつかの重要な傾向を探ります。
目次
- クイックレビュー:酸、塩基、共役酸、および共役塩基
- 酸性度を測定するためにpKaを使用して
- アミンの塩基度を定量化するためにpKaを使用して
- “共役酸のPka”は、”pKaH”と略記することができます
- アミンの相対塩基度を決定するためにpKaHを使用して
- いくつかの注意事項のためのpka値アミン
- アミンの塩基度を支配する重要な要因は何ですか?
- 注意事項
1. クイックレビュー: 酸、塩基、共役酸、および共役塩基
最初に、いくつかの塩基度の基礎をすばやく見直しましょう。
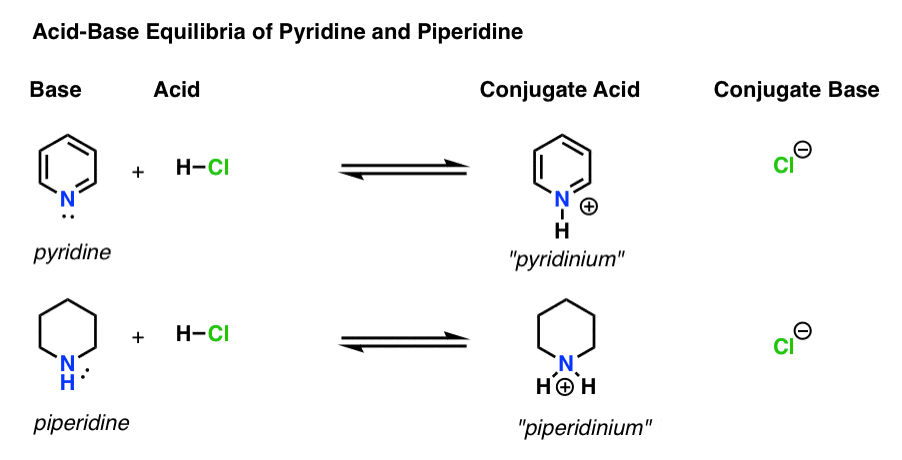
すべての酸-塩基反応には4つのアクターがあります。
塩基は、h+(「陽子」または「水素核」としても知られている)に孤立した対を供与する種である。 これは、Hフォームへの新しい結合(例えばピリジン、以下)です
- 共役酸は、塩基がHへの結合を形成した後に生じる種です(例えば、新しいn–H結合を有する”ピリジニウム”)
- 酸はH+を失う種です。 それはHへの結合が壊れる場所です(例えば H-Cl)
- 共役塩基は、酸がh+を塩基に供与した後に残る種です(例:Cl-)
ここではピリジンとピペリジンが作用しています。 形成され、壊れた結合に従うことによって、各アクターを識別することができます。p>
2。 酸性度を測定するためにpKaを使用する
すべての酸-塩基反応は、順方向反応と逆方向反応の間の平衡として書くことができます。
我々は、酸性度定数Kaは、種がh+と共役塩基を与えるために解離するのがいかに簡単かの尺度であることを見てきました。
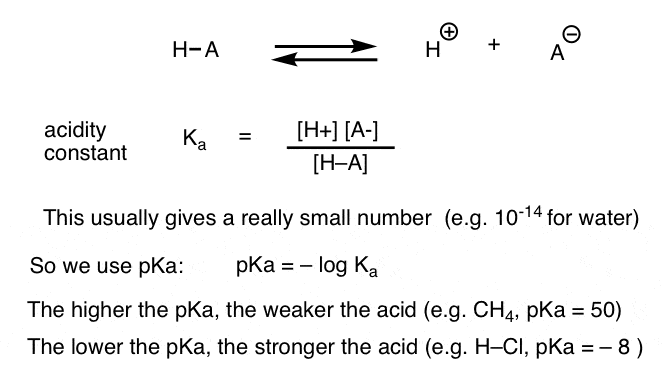
便宜上、我々はおなじみのpHスケールに似ていますが、それは厳密に水性溶媒に限定されないので、14を超えて拡張することができますpKaと呼ばれるKaの負のログを使用します。 pKa値は、非常に強い酸(例えば、ヨウ化水素酸、H–I)の場合は-10程度から、特定の炭化水素(例えば、エタン)の場合は50以上の範囲である。どのように我々は塩基度を測定するために、これらの概念を適用することができますか?
我々は物事を切り替えて、種がH+とどのように容易に結合するかの平衡である用語Kbを定義し、pKbをその負の対数として定義し、それらのpKb値を見てp>
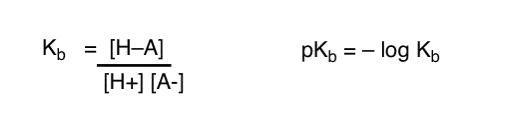
はい…. できる そうかな 私たちがしなければならなかった場合。 しかし、一般的に、この主題に関する有機化学者の意見は”Screw pKb”です。結局のところ、pKa値は何千もの有機分子について測定されてきました。
誰もが本当にpKb値の巨大なセットを覚えておく必要がありますか? 地獄はダメだ!代わりに、pka値を塩基度の間接的な測定値として簡単に使用できます。
代わりに、塩基度の間接的な測定値としてpKa値を使用できます。 ここではどのようにです。
3. Pka値を使用してアミンの塩基度を定量化する
毎晩自分自身に暗唱する価値がある散文のこれら二つの不滅の行を思い出してください:
- 酸が強
- 酸が弱いほど共役塩基が強くなります。
ピリジン(”ピリジニウム”)の共役酸のpKaを測定しました。 それは約5.2です。 また、ピペリジンの共役酸のpKaの値もあります。
それは約11です。
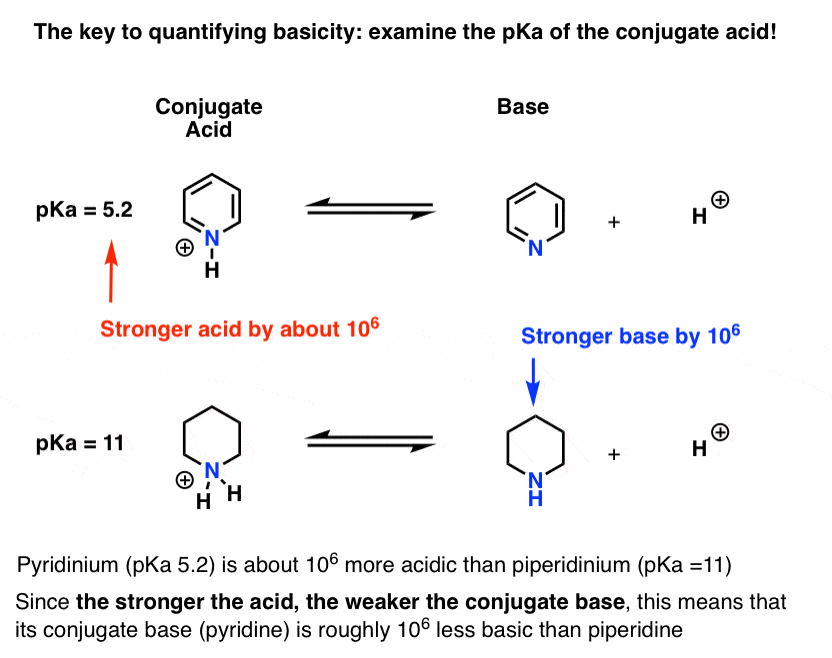
これらのpKa値から、ピリジンの共役酸はピペリジンの共役酸よりも約6pKa単位で強いことがわかります。 各pKa単位は10の係数を表すので、それは約100万の係数です。
“酸が強いほど共役塩基が弱い”ので、ピリジンはピペリジンよりも1万倍弱い塩基である。
4. 「共役酸のpKa」は「pKaH」と略記することができます
用語は、「共役酸のpKa」は、定期的に使用する一口のビットです。 自然に怠け者なので、一般的な使用のためにこれを少し凝縮したいと思います。塩基の共役酸(”b”)は”BH”であるため、”塩基の共役酸のpKa”をそのpKaHとして省略することができます。
塩基の共役酸(”b”)は”BH”であるため、”塩基の共役酸のpKa”をそのpKaHとこれは、ピリジンのpKaHが5.2であり、ピペリジンのpKaHが11であると言うことができます。
これは、ピリジンのpKaHが5.2であり、ピペリジンのpKaHが11であるとその後、文献を掘り下げて、それを比較するための他の拠点を見つけることができます。
例えば、アンモニア(NH3)は正確にどのように基本的ですか?
アンモニアの共役酸であるNH4(+)は9.2である。 同様に、アンモニアのpKaHは9.2であると言うことができます。 これは塩基度のスケールでピリジンとピペリジンの間にそれを置きます。p>
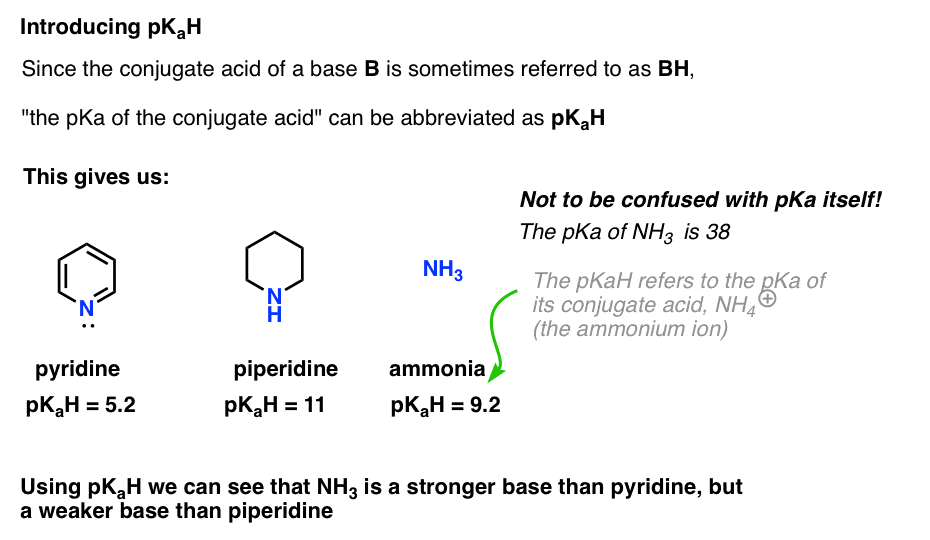
pKaHとpKaを混同しないことは非常に重要であることに注意してください。

アンモニアのpKaHは9.2であり、その共役酸NH4(+)の酸性度を測定する。アンモニア自体のpKaは38であり、NH3の解離の平衡定数を測定して、その共役塩基、NH2(-)およびH+を与える。
アンモニア自体のpKaは38であり、NH3の解離の平衡定数を測定して、nh2(-)およびH+を与える。
これは、末端アルキンを脱プロトン化するために使用される強塩基(Nanh2)として以前に遭遇したことがあるかもしれない(pKa=25)。
それは38がアミドイ PKaHを使用すると、NH2(-)はNH3よりも基本的な約(38–9)=29桁であると判断できます。
5. PKaHを使用してアミンの相対的な塩基度を決定する
pKaHを使用して塩基の相対的な強さを決定することは非常に有用なトリックです。ここでは、窒素含有分子のいくつかの代表的な例があります。
以下はそれらの共役酸のpKaである。ここで最強の基地は何ですか?
最も弱いのは何ですか?
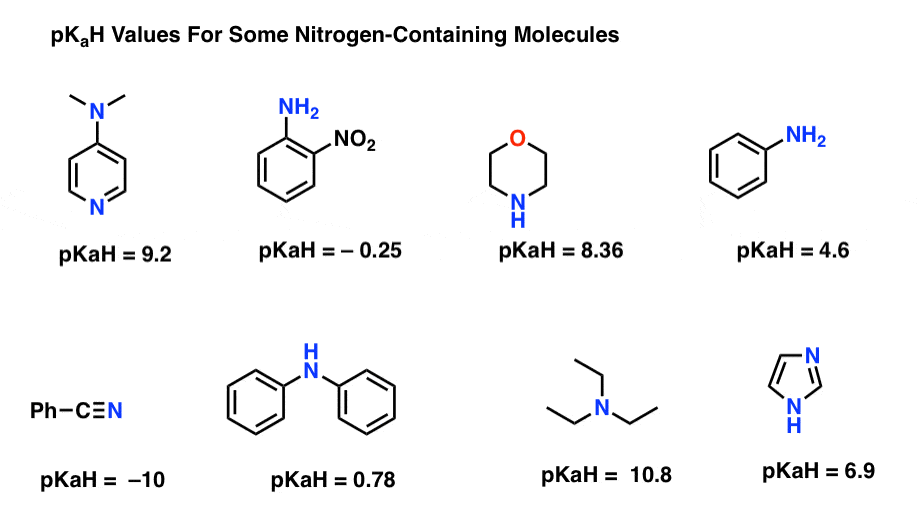
ここでの最低pKaH値は、ニトリル(左下)の-10です。 これは、ニトリルがこれらの分子のすべての中で最も塩基性が低いことを意味する。
ここでの最高のpKaH値は、トリエチルアミンの10.8です。 それはtriethylamineをリストされているそれらすべてから最も強い基盤にする。
アミンのpKa値に関するいくつかの注意事項
特にこのトピックに関する他のオンラインソースを読むときには、注意すべき二つのこと。まず、アミンのpKaH値は、説明なしにpKa値として報告されることがあります。
最初に、アミンのpKaH値は、説明なしにpKa値として報告されることがあり 最高のpKaテーブルはこれを行うことはありませんが、あなたが始めたばかりのときに籾殻から小麦を選別するのは難しいです。あなたはアミンのための異常に低いpKa値が表示された場合、それはおそらく共役酸のpKaHを参照しています。
たとえば、メチルアミン(CH3NH2)のpKaが10.63としてリストされているpKa表があります。それは低いです。
うまくいけば、この時点で、アミンのpKaの10のような値は、特に密接に関連するNH3のpKaが38であるため、奇妙なものとしてあなたを打つべきです。
10.63の値は、実際にはメチルアミン自体ではなく、メチルアミンの共役酸のpKaを指します。 それはpKaH値です。
同様に、同じ表にトリメチルアミンが9.8のpKaを有するものとして記載されている。 繰り返しますが、これは実際にはそのpKaHです。 トリメチルアミンの実際のpKa値を見つけることはできませんが、トリメチルアミンの共役塩基はカルバニオン(CH3)2N–CH2(-))であるため、>40であると推測します。混乱の第二に、あまり一般的ではない原因は、時にはアミンのpKaHが9.2としてNH3のpKbを報告するこの表のように、そのpKbとして報告されていることで これは不正確です。繰り返しになりますが、pKb値は学部の有機化学ではあまり出てきませんが、DAT/MCATに登場することがあると言われています。
7. アミンの塩基性を支配する重要な要因は何ですか?これで、少なくともアミンとその共役酸のpKa値を定量化して解釈する方法を学んだので、重要な質問を始めることができます:なぜですか? アミンの塩基性を支配する重要な要因は何ですか? 重要な傾向は何ですか?たとえば、なぜピリジンはピペリジンよりも弱い塩基ですか?
なぜニトリルはさらに弱い塩基ですか? なぜ電子吸引基はアミンを弱い塩基にする傾向があるのですか?良いニュースは、酸性度を支配する要因を既に理解している場合は、まったく同じ原則を適用するだけですが、逆に適用する必要があるということです。
次の記事でそれについて説明します。
アミンの塩基性に影響を与える五つの要因
注
脚注1。 非塩基である多くの酸(孤立電子対を欠くNH4のような)および孤立電子対を受け入れることができないCl(-)のような非酸である多くの塩基がある。 したがって、”酸が強いほど、塩基が弱い”と言うのは間違っています。
脚注2。 それは溶媒として水を使用して得られた測定です。 ジメチルスルホキシド(DMSO)を溶媒として使用すると得られる別の値3.4が表示されることがあります。 Bordwell pKaテーブル(DMSO)を参照してください