Posts Tagged “Teoria MO; cicloaddizione; chimica organica; HOMO; LUMO; sistema coniugato”
Uno dei concetti più impegnativi nelle reazioni del sistema coniugato è interazioni orbitali molecolari, o teoria MO. Le basi di questo principio possono essere difficili da afferrare, ma saranno molto istruttive nel predire le condizioni di reazione corrette e l’esito della reazione se le capisci, il che ti darà un grande vantaggio sui futuri quiz ed esami. Noi di StudyOrgo abbiamo ideato una semplice spiegazione delle basi della teoria MO per aiutarti con i tuoi preparativi di studio.
Principi della Teoria MO
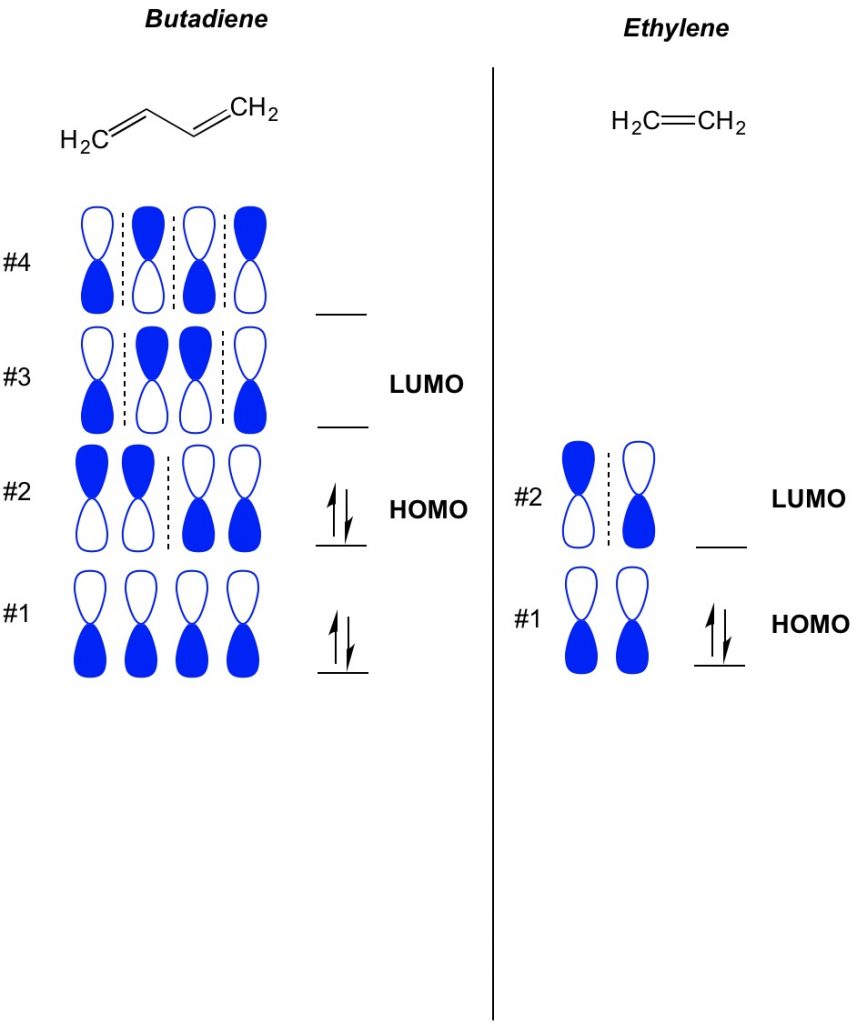
Il concetto di base della teoria MO è quello di descrivere i modelli alternati di orbitali che esistono nei sistemi di legame pi. Descriviamo l’orientamento di ogni metà dell’orbitale del manubrio centrato attorno a un atomo come audace o aperto. Ricorda, ci sono orbitali di legame e antibonding. Essenzialmente, gli orbitali con un numero inferiore di nodi (interruttori nell’orientamento dell’orbitale del manubrio che mostriamo con la linea tratteggiata) si comportano più come orbitali di legame mentre gli orbitali con un numero maggiore di nodi si comportano come orbitali anti-legame. Per determinare quali orbitali sono occupati sulla tua molecola, conta semplicemente quanti legami pi hai nel tuo sistema coniugato. Di seguito è riportato un esempio di butadiene. Ha 4 elettroni pi, quindi riempiamo prima gli orbitali molecolari più bassi, due in ogni orbitale. Pertanto, il più alto orbitale molecolare occupato, o HOMO, in butadiene è #2. Di conseguenza, il più basso obital molecolare non occupato, o LUMO, in butadiene è #3. Possiamo estenderlo all’etilene e vedere che con 2 elettroni pi, l’orbitale molecolare # 1 è l’HOMO e l’orbitale molecolare # 2 è il LUMO.
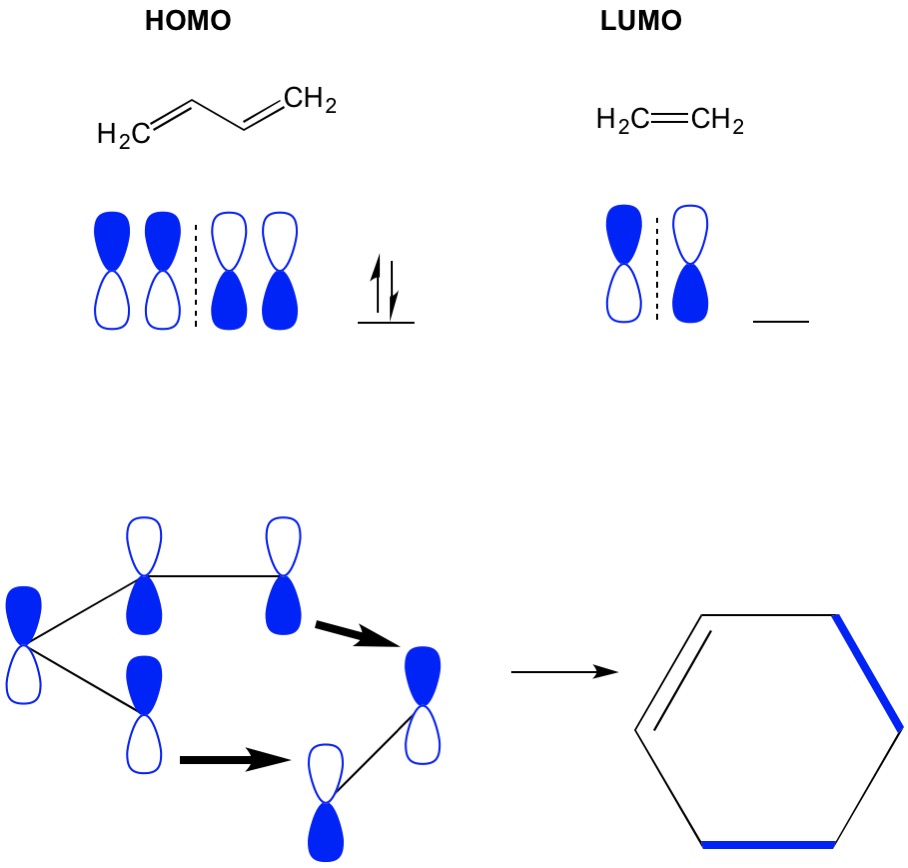
Teoria delle cicloaddizioni MO
Ricorda che le reazioni di cicloaddizione descrivono la formazione di nuovi legami C-C sigma attraverso il riarrangiamento degli elettroni pi in un sistema coniugato. Pertanto, abbiamo bisogno di usare gli orbitali molecolari degli elettroni pi per guidare la reazione. Prendiamo la reazione di butadiene con etilene, la più semplicistica reazione di Diels Alder (4 + 2 cicloaddizione). Iniziamo con la molecola più coniugata, il butadiene ed esaminiamo il suo HOMO. Quindi guardiamo la molecola meno coniugata, l’etilene ed esaminiamo il suo LUMO. Perché? Abbiamo bisogno che gli elettroni di un HOMO fluiscano da una molecola all’altra, quindi dobbiamo usare l’orbitale LUMO che non è occupato per questo processo. Vediamo che i nodi dell’HOMO e del LUMO si allineano; cioè le metà aperte e chiuse dei manubri si allineano. Ciò porta ad una reazione in avanti e alla formazione del prodotto, cicloesene.
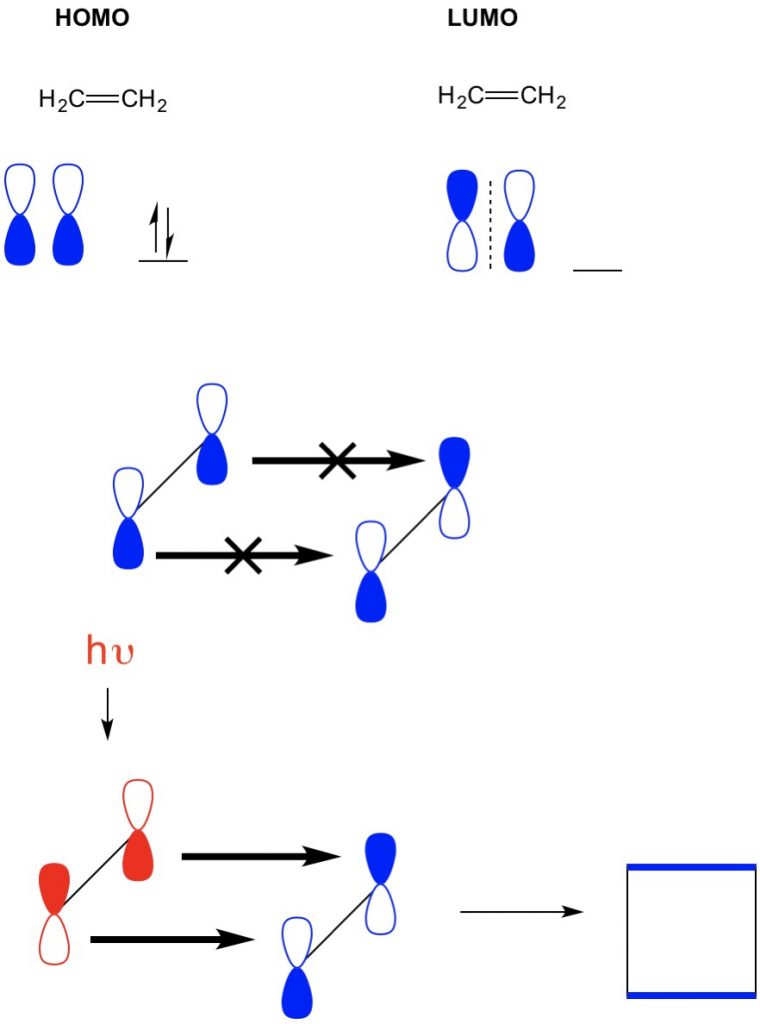
Tuttavia, in un altro esempio in cui abbiamo una (2+2 cicloaddizione), vediamo che l’HOMO e il LUMO dell’etilene non si allineano impedendo così la reazione. Tuttavia, abbiamo la capacità di eccitare gli elettroni dall’HOMO ad un orbitale superiore usando la luce (hv) o il calore, cambiando così l’HOMO. Esaminiamo questo concetto in dettaglio in un precedente articolo. Quando lo facciamo, l’HOMO dell’etilene eccitato e il LUMO dell’etilene dello stato fondamentale si allineano e la reazione produce ciclobutano.
Speriamo che questa descrizione abbia aiutato a chiarire questi concetti della teoria MO. Questo è un esempio delle espatriazioni chiare e semplici che abbiamo preparato per oltre 175 reazioni comunemente viste nei corsi Orgo1 e Orgo2. Iscriviti oggi per le vostre esigenze di preparazione allo studio!