Piccola Spazzola Intestinale Confine Enzimi
VIVO Fisiopatologia
Piccola Spazzola Intestinale Confine Enzimi
Il passo finale nella digestione dei carboidrati alimentari e proteine si verifica sul viso del piccolo enterociti intestinali, nelle immediate vicinanze dei trasportatori che traghetti il conseguente zuccheri e aminoacidi nelle cellule epiteliali. Gli enzimi responsabili di questa fase terminale della digestione non sono liberi nel lume intestinale, ma piuttosto, legati come proteine di membrana integrali nella membrana plasmatica dell’enterocita. La membrana plasmatica apicale che ospita questi enzimi è composta da numerosi microvilli che si estendono dalla cellula e costituiscono il “bordo della spazzola”. Quindi, gli enzimi incorporati in quei microvilli sono indicati come enzimi di confine pennello.
La densità e la distribuzione degli enzimi del bordo del pennello differiscono tra i diversi segmenti dell’intestino tenue e spesso variano a seconda dell’età dell’animale. Inoltre, in alcuni casi la concentrazione di tali enzimi può essere modulata dalla dieta; ad esempio, la quantità di enzima sucrasi-isomaltasi aumenta negli animali alimentati con una dieta ricca di carboidrati.
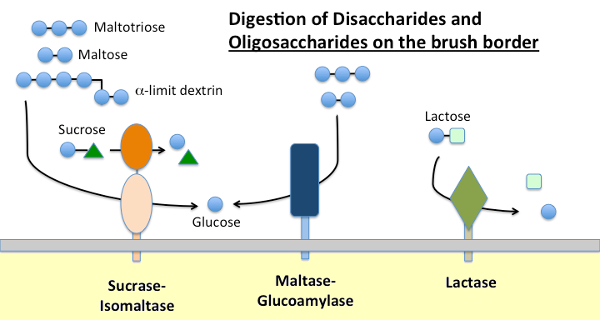
Maltasi-glucoamilasi e Sucrasi-Isomaltasi
L’amido alimentare viene digerito dall’α-amilasi presente nelle secrezioni pancreatiche e, in molte specie, nella saliva. L’amilasi idrolizza i legami glicosidici α-1,4 interni nell’amido per generare maltosio, oligosaccaridi corti (ad esempio maltotriosio) e le cosiddette destrine limite, che sono punti di diramazione nell’amilopectina. Nessuna di queste molecole può essere assorbita attraverso il piccolo epitelio intestinale e richiede un’ulteriore idrolisi, in definitiva in glucosio.
La maltasi-glucoamilasi e la sucrasi-isomaltasi sono enzimi strettamente correlati incorporati nella membrana del bordo del pennello che eseguono le fasi terminali della digestione utilizzando substrati forniti dall’azione dell’amilasi:
- La maltasi-glicoamilasi ha due siti attivi. Il sito della maltasi idrolizza i residui terminali di d-glucosio legati all’α-1,4 da maltosio o maltotriosio, generando α-D-glucosio. Il sito della glucoamilasi inoltre ha quell’attività dell’idrolasi α-1,4 ma inoltre idrolizza i legami glicosidici α-1,6 quando sono adiacenti ad un legame α-1,4, liberante β-D-glucosio.
- La sucrasi-isomaltasi ha anche due siti attivi con diverse specificità. Il sito della sucrasi catalizza l’idrolisi della sucrasi in fruttosio e glucosio ed è anche in grado di idrolizzare il maltosio. Il sito di isomaltasi è importante come il meccanismo principale per digerire i legami α-1,6 delle destrine limite.
Lattasi
La lattasi, come suggerisce il nome, è una disaccaridasi che idrolizza il lattosio in galattosio e glucosio; formalmente, è una β-glicosidasi. Il lattosio è il principale carboidrato nel latte e la lattasi è abbondantemente presente nel piccolo bordo della spazzola intestinale dei giovani mammiferi. Nella maggior parte delle specie, compresi gli esseri umani, l’espressione della lattasi precipita poco dopo lo svezzamento. Nella maggior parte degli esseri umani, questa non persistenza dell’attività della lattasi in età adulta è associata a “intolleranza al lattosio”. La differenza tra persistenza della lattasi e non persistenza è geneticamente determinata.
Peptidasi
Esistono un gran numero di peptidasi a bordo pennello, che collettivamente possono idrolizzare la diversa diversità della sequenza aminoacidica presente nelle proteine alimentari. Le classi principali di peptidasi includono:
- Esopeptidasi che idrolizzano gli amminoacidi terminali dai peptidi. Alcuni di questi enzimi hanno attività contro i residui del C-terminale ed altri funzionano sugli amminoacidi del N-terminale. La loro attività produce aminoacidi liberi o dipeptidi. Come esempio di specificità e diversità enzimatica, l’aminopeptidasi P idrolizza l’amminoacido N-terminale da di -, tri-e oligopeptidi ma solo se sono legati alla prolina, mentre l’aminopeptidasi A catalizza l’idrolisi di amminoacidi acidi terminali come glutammato e aspartato.
- Le endopeptidasi fendono internamente le catene peptidiche, producendo peptidi più piccoli di varia lunghezza della catena.
- Esiste anche una singola dipeptidasi come enzima bordo pennello.
Enteropeptidase, anche conosciuto come enterokinase, è un altro enzima del bordo della spazzola che ha l’attività importante di catalizzare l’activiation del tripsinogeno in tripsina, una delle proteasi principali dal pancreas. L’enteropeptidasi è presente più abbondantemente nel duodeno.
Lipasi
Un certo numero di lipasi sono presenti nel bordo del pennello dell’intestino tenue. Questi includono fosfolipasi B1, ceramidasi neutra e sfingomielinasi alcalina.