Bassa Tensione Glaucoma: Un Ossimoro in Oftalmologia
Ciro Costagliola, MD1; Luca Agnifili, MD, PhD2; Leonardo Mastropasqua, MD2; Alfonso di Costanzo, MD1 (Visualizzare autore affiliazioni)
Suggerito per la citazione di questo articolo: Costagliola C, Agnifili L, Mastropasqua L, di Costanzo A. a Bassa Tensione Glaucoma: Un Ossimoro in Oftalmologia. Prev Dis cronica 2019;16: 180534. DOI:http://dx.doi.org/10.5888/pcd16.180534external icona.
Il termine glaucoma si riferisce a un gruppo di condizioni oculari caratterizzate da danni progressivi al nervo ottico e perdita del campo visivo (1). La neuropatia ottica glaucomatosa è dovuta alla progressiva perdita di cellule gangliari retiniche; un’elevata pressione intraoculare (IOP) è uno dei principali fattori di rischio. IOP può agire direttamente, con un effetto meccanico, o indirettamente, influenzando l’afflusso di sangue (2). I fattori che influenzano la progressione della neuropatia ottica glaucomatosa includono l’età avanzata, lo stadio avanzato della malattia, l’IOP più alto e le emorragie del disco (3). Nei pazienti con glaucoma primario ad angolo aperto (POAG), l’aumentata resistenza al deflusso acquoso attraverso la rete trabecolare è il principale colpevole di IOP elevato. Tuttavia, nonostante un adeguato controllo della PIO, la neuropatia ottica glaucomatosa può spesso continuare a progredire. Pertanto, vengono riconosciuti fattori non correlati alla IOP, con il più importante è una diminuzione dell’afflusso di sangue al nervo ottico (4).
Altri fattori non correlati alla IOP includono la tossicità del glutammato, lo stress ossidativo, l’autoimmunità e la disregolazione vascolare (3). Il glaucoma a bassa tensione (LTG) è definito come una forma di glaucoma che imita da vicino POAG, ma i livelli di IOP sono all’interno della gamma normale e la probabile patogenesi è vascolare.
Le domande controverse sono 1) LTG è una malattia sullo spettro di POAG (sul lato sinistro della distribuzione di IOP, ai livelli più bassi)?, 2) l’aspetto del disco ottico è secondario all’ipoperfusione del nervo ottico a causa di malattie vascolari?, o 3) dovrebbe LTG essere incluso in uno spettro di neuropatie ottiche congenite e acquisite che possono simulare neuropatia ottica glaucomatosa?
Top
Il glaucoma a bassa tensione è una malattia nello spettro del glaucoma primario ad angolo aperto?
Quando nel 1857 Albrecht von Graefe descrisse una forma di glaucoma che manifestava danni alla testa del nervo ottico e un angolo di camera anteriore aperto, con IOP all’interno dell’intervallo di riferimento, la tonometria digitale della palpazione era considerata il gold standard. Se avesse usato un tonometro a impressione per misurare IOP, la principale lacuna della tonometria sarebbe stata che spostava così tanto fluido al contatto con l’occhio che le letture misurate sarebbero altamente variabili e imprecise. Al contrario, se avesse usato la tonometria di indentazione, non avrebbe considerato l’errata classificazione risultante dalla presenza di una sottile corneale centrale (1). Molte diagnosi di LTG erano per gli occhi con cornee sottili e si basavano su falsi valori bassi per IOP, una scoperta che getta alcuni dubbi sulla diagnosi di LTG (5). Inoltre, l’assenza di IOP elevata deve essere riscontrata su misurazioni eseguite più di una volta o durante il giorno, poiché la IOP mostra fluttuazioni diurne e notturne nei soggetti sani e ancor più nei pazienti con POAG o LTG (6). Per le variazioni nella IOP, si possono distinguere 3 popolazioni di pazienti LTG: pazienti senza fluttuazioni IOP, pazienti con acrofasi IOP diurna (la cresta o il picco di un ciclo) e pazienti con acrofasi IOP notturna (7). I pazienti delle ultime 2 categorie devono essere considerati veri pazienti con POAG piuttosto che pazienti con LTG, nei quali si verifica neuropatia ottica glaucomatosa nonostante la normale IOP. È probabile che i pazienti con acrofasi diurna o notturna siano stati arruolati in studi basati sulla teoria meccanica; la riduzione della IOP potrebbe rallentare la progressione della perdita del campo visivo solo in questi pazienti (8). I dati dello studio sul trattamento del glaucoma a bassa pressione hanno evidenziato il ruolo della PIO nella patogenesi dell’LTG; la progressione della perdita del campo visivo è stata ridotta del 9,1% con timololo 0,5% e del 39,1% con brimonidina 0,2% dopo 2 anni di trattamento (8). Tuttavia, in questo studio, i valori di IOP sono stati registrati esclusivamente durante il giorno. Pertanto, non è noto se i pazienti con un campo visivo peggiore avessero una IOP acrofasi notturna. Altri studi su LTG asimmetrico hanno riferito che l’occhio con IOP più alto mostra un danno glaucomatoso maggiore rispetto all’occhio con IOP inferiore, che sostiene il ruolo di IOP nella patogenesi (9). Eppure, in tutti questi studi clinici IOP è stato misurato solo durante le ore di ufficio; così, il comportamento di IOP notturna non è stato registrato. Un recente studio in cui le curve IOP nychthemeral sono state valutate con un sensore telemetrico ha mostrato un’acrofasi notturna con picchi IOP in pazienti con LTG, sebbene questi picchi fossero a livelli significativamente più bassi rispetto ai picchi trovati tra i pazienti con POAG (7). Questo studio ha riferito che la IOP ha raggiunto il picco di notte nel 40%-80% dei pazienti con glaucoma di tensione normale e il modello in questi pazienti era simile al modello in pazienti con POAG. Nelle curve di 24 ore, i pazienti con LTG e POAG avevano schemi di IOP più pronunciati di sera e di notte rispetto al mattino, con più picchi e maggiore fluttuazione della IOP durante la notte rispetto alla sera (7). Altri fattori possono corroborare l’ipotesi di uno stress meccanico primario correlato alla IOP in LTG, come la presenza di cambiamenti nelle vie di deflusso dell’umore acqueo simili a quelle che si verificano in POAG (10).
Nei pazienti in cui l’LTG può essere considerata una malattia nello spettro di POAG, devono essere implementate strategie diagnostiche e terapeutiche simili a quelle per i pazienti con glaucoma iperbarico, con l’aiuto di un oftalmologo (Figura).
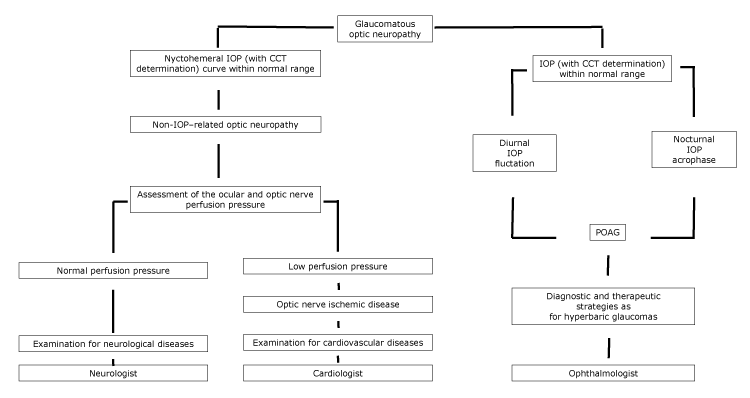
Figura.
Proposto diagramma di flusso di neuropatia ottica, con riferimento specialistico, secondo le caratteristiche IOP nychthemeral. Abbreviazioni: CCT, spessore corneale centrale; IOP, pressione intraoculare; POAG, glaucoma primario ad angolo aperto.
Top
L’aspetto del disco ottico è secondario all’ipoperfusione del nervo ottico dovuta a malattie vascolari?
Nei pazienti con LTG e curve IOP nychthemeral normali, i fattori meccanici non possono essere responsabili della neuropatia ottica; possono essere coinvolti fattori indipendenti dalla pressione, con alterazioni vascolari potenzialmente le più importanti (5). Una neuropatia ottica di tipo glaucomatoso può essere osservata in pazienti con anamnesi di evento cardiovascolare o con aterosclerosi cronica o arteriopatia ostruttiva (11). Riduzione della velocità del flusso sanguigno nelle arterie retrobulbari e nella circolazione cerebrale, bassa pressione diastolica e diametro del vaso retinico centrale più piccolo sono stati osservati anche in pazienti con LTG (5). In questi pazienti, la patogenesi della malattia è dovuta ad una ridotta pressione di perfusione oculare, legata principalmente alla disregolazione vascolare primaria o ad una disfunzione generalizzata del sistema nervoso endoteliale o autonomo (5,11). Tuttavia, non è chiaro se questi fattori fossero la causa o il risultato della neuropatia ottica. Da un punto di vista clinico, LTG mostra una maggiore incidenza di emorragie del disco ed è più frequentemente associata a malattie vascolari come emicrania, apnea ostruttiva del sonno o sindrome di Raynaud rispetto a IOP (5). Infine, circa la metà dei pazienti LTG con malattia pre-perimetrica mostra progressione del danno nonostante i normali valori di IOP (12). Tutti questi risultati suggeriscono l’importante ruolo della disregolazione vascolare.
Nei pazienti con malattie cardiovascolari, la coppettazione del disco ottico può tendere a non progredire se la causa sottostante della neuropatia ottica è stata controllata. Inoltre, i pazienti LTG possono mostrare atrofia circumpapillare e microinfarti corticali cerebrali, che sono segni di ischemia (5). Nei pazienti in cui le malattie vascolari inducono un’ipoperfusione del nervo ottico, deve essere condotto un esame diagnostico completo per le malattie cardiovascolari, con l’aiuto di un cardiologo (Figura).
Top
LTG dovrebbe essere incluso in uno spettro di neuropatie ottiche congenite e acquisite in grado di simulare una neuropatia ottica glaucomatosa?
Quando sono state escluse le cause più frequenti di coppettazione del disco ottico, si deve considerare la possibilità di una neuropatia ottica neurodegenerativa. Questi casi sono i più frustranti, perché il danno del disco ottico progredisce anche dopo che la IOP è stata abbassata. Molte neuropatie ottiche congenite e acquisite sono incluse in questo gruppo di casi e la differenziazione tra coppettazione glaucomatosa e nonglaucomatosa può essere impegnativa anche per gli osservatori esperti (13). Tra le forme congenite di coppettazione del disco ottico, megalopapilla, atrofia ottica autosomica dominante e neuropatia ottica ereditaria Leber potrebbero produrre uno scavo del disco ottico che simula la neuropatia ottica glaucomatosa.
Le neuropatie acquisite potrebbero essere secondarie a cause infiammatorie, compressive, tossiche e traumatiche. La neurite ottica può produrre un aumento del rapporto tazza-disco che, sebbene unilaterale, può essere confuso con la neuropatia ottica glaucomatosa. Lesioni compressive tra cui meningioma, adenoma ipofisario, craniofaringioma e aneurisma dell’arteria carotide interna possono portare a coppettazione asimmetrica del disco ottico e erroneamente attribuita a LTG. L’avvelenamento da metanolo ed etambutolo potrebbe produrre una coppettazione bilaterale del disco ottico simile alla neuropatia ottica glaucomatosa, secondaria alla perdita assonale. Pertanto, quando si osserva una tazza allargata asimmetrica, è necessaria un’ulteriore indagine neuro-oftalmologica (13).
Infine, tra le condizioni che portano alla coppettazione del disco ottico, l’invecchiamento ha un ruolo principale. Harju et al hanno scoperto che il grado di coppettazione del disco ottico è aumentato nei partecipanti allo studio più anziani sani a causa della perdita fisiologica di fibre. La loro popolazione in studio era appropriata e rappresentava un insieme di occhi sani senza glaucoma; durante gli 11 anni di follow-up, nessun partecipante allo studio ha sviluppato cambiamenti del campo visivo e non è stato registrato alcun aumento significativo della PIO (14). In quest’ultimo caso, deve essere condotto un esame diagnostico completo per le malattie neurologiche, con l’aiuto di un neurologo (Figura).
I miglioramenti nelle tecniche diagnostiche rendono più facile di prima classificare la coppettazione del disco ottico; una descrizione delle caratteristiche del disco ottico combinata con l’imaging dello strato di fibra del nervo retinico e la topografia del disco ottico consente la differenziazione tra coppettazione del disco ottico glaucomatoso e nonglaucomatoso. Inoltre, un’attenta analisi della storia del paziente, insieme alla valutazione morfologica e funzionale del nervo ottico, aiuta a identificare i disturbi.
Il termine LTG potrebbe essere un ossimoro, un ricordo nostalgico del passato quando una diagnosi definita non era possibile. Usare il termine è come usare la parola “febbre” quando non c’è alta temperatura o dire festina lente (“più fretta, meno velocità”). Il termine LTG può essere fuorviante o impreciso, perché si riferisce a un problema meccanico di IOP, mentre la coppettazione del disco ottico e la perdita del campo visivo negli occhi con normale pressione intraoculare sono causati da altri fattori. Pertanto, in presenza di coppettazione del disco ottico con IOP normale, gli oftalmologi dovrebbero indagare su altre cause plausibili di danno al nervo ottico oltre alla pressione intraoculare.
Top
Riconoscimenti
Questo studio non ha ricevuto sovvenzioni specifiche da alcuna agenzia di finanziamento nei settori pubblico, commerciale o senza scopo di lucro.
Top
Informazioni sull’autore
Autore corrispondente: Luca Agnifili, MD, PhD, Clinica Oftalmologica, Via dei Vestini, 66100, Chieti (CH), Italia. Telefono: +39-0871-358489. E-mail: [email protected].
Autore Affiliazioni: 1dipartimento di Medicina e Scienze della Salute, Università del Molise, Campobasso, Italia. 2dipartimento di Medicina e Scienza dell’invecchiamento, Clinica oftalmologica, Università G. d’Annunzio of Chieti-Pescara, Chieti, Italy.
Top
- Coleman AL, Miglior S. Risk factors for glaucoma onset and progression. Surv Ophthalmol 2008;53(6, Suppl):S3–10. CrossRefexternal icon PubMedexternal icon
- Costagliola C, dell’Omo R, Romano MR, Rinaldi M, Zeppa L, Parmeggiani F. Pharmacotherapy of intraocular pressure: part I. Parasympathomimetic, sympathomimetic and sympatholytics. Expert Opin Pharmacother 2009;10(16):2663–77. CrossRefexternal icon PubMedexternal icon
- Weinreb RN, Aung T, Medeiros FA. The pathophysiology and treatment of glaucoma: a review. JAMA 2014;311(18):1901–11. CrossRefexternal icon PubMedexternal icon
- Cherecheanu AP, Garhofer G, Schmidl D, Werkmeister R, Schmetterer L. Ocular perfusion pressure and ocular blood flow in glaucoma. Curr Opin Pharmacol 2013;13(1):36–42. CrossRefexternal icon PubMedexternal icon
- Mastropasqua R, Fasanella V, Agnifili L, Fresina M, Di Staso S, Di Gregorio A, et al. Advance in the pathogenesis and treatment of normal-tension glaucoma. Prog Brain Res 2015;221:213–32. CrossRefexternal icon PubMedexternal icon
- Moon Y, Lee JY, Jeong DW, Kim S, Han S, Kook MS. Relationship between nocturnal intraocular pressure elevation and diurnal intraocular pressure level in normal-tension glaucoma patients. Invest Ophthalmol Vis Sci 2015;56(9):5271–9. CrossRefexternal icon PubMedexternal icon
- Agnifili L, Mastropasqua R, Frezzotti P, Fasanella V, Motolese I, Pedrotti E, et al. Circadian intraocular pressure patterns in healthy subjects, primary open angle and normal tension glaucoma patients with a contact lens sensor. Acta Ophthalmol 2015;93(1):e14-21. CrossRefexternal icon PubMedexternal icon
- De Moraes CG, Liebmann JM, Greenfield DS, Gardiner SK, Ritch R, Krupin T; Gruppo di studio per il trattamento del glaucoma a bassa pressione. Fattori di rischio per la progressione del campo visivo nello studio di trattamento del glaucoma a bassa pressione. Am J Ophthalmol 2012;154 (4): 702-11. CrossRefexternal icon PubMedexternal icon
- Cartwright MJ, Anderson DR. Correlazione del danno asimmetrico con pressione intraoculare asimmetrica nel glaucoma a tensione normale (glaucoma a bassa tensione). Arch Ophthalmol 1988;106 (7): 898-900. CrossRefexternal icon PubMedexternal icon
- Agnifili L, Carpineto P, Fasanella V, Mastropasqua R, Zappacosta A, Di Staso S, et al. Conjunctival findings in hyperbaric and low-tension glaucoma: an in vivo confocal microscopy study. Acta Ophthalmol 2012;90(2):e132–7. CrossRefexternal icon PubMedexternal icon
- Hayreh SS, Jonas JB. Appearance of the optic disk and retinal nerve fiber layer in atherosclerosis and arterial hypertension: an experimental study in rhesus monkeys. Am J Ophthalmol 2000;130(1):91–6. CrossRefexternal icon PubMedexternal icon
- Collaborative Normal-Tension Glaucoma Study Group. Comparison of glaucomatous progression between untreated patients with normal-tension glaucoma and patients with therapeutically reduced intraocular pressures. Am J Ophthalmol 1998;126(4):487–97. CrossRefexternal icon PubMedexternal icon
- Fraser CL, White AJ, Plant GT, Martin KR. Optic nerve cupping and the neuro-ophthalmologist. J Neuroophthalmol 2013;33(4):377–89. PubMedexternal icon
- Harju M, Kurvinen L, Saari J, Vesti E. Change in optic nerve head topography in healthy volunteers: an 11-year follow-up. Br J Ophthalmol 2011;95(6):818–21. CrossRefexternal icon PubMedexternal icon
Top