Basicità delle ammine e pKaH
Quantificando la basicità delle ammine, usando “Il pKa dell’acido coniugato”, alias”pKaH ”
Come si misura la basicità di un’ammina? Caso in questione: qual è una base più forte: piridina o piperidina?
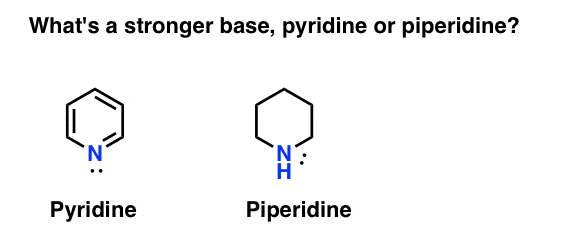
Se hai detto piperidina, congratulazioni – è davvero una base più forte.
Ma perché? E quanto più forte? Come si fa a cercare di rispondere a queste domande? Dopo tutto, possiamo facilmente confrontare la forza degli acidi esaminando i loro pKa. Non dovremmo essere in grado di fare lo stesso con le basi?
Sì, in un certo senso. Ecco due punti chiave per oggi:
- Il modo migliore per quantificare la basicità di un’ammina è esaminare il pKa del suo acido coniugato.
- Più alto è il pKa dell’acido coniugato, più forte è la base.
In questo post mostreremo alcuni esempi specifici di come utilizzare i valori pKa per confrontare la basicità delle ammine.
In un post successivo, esploreremo alcune tendenze chiave alla base della basicità delle ammine.
Sommario
- Quick Review: Acidi, Basi, Coniugato Acidi, e Coniugato Basi
- Utilizzo di pKa Per Misurare l’Acidità
- Utilizzo di pKa Per Quantificare La Basicità Delle Ammine
- La “pKa Dell’Acido Coniugato” Può Essere Abbreviato Come “pKaH”
- Utilizza pKaH Per Determinare La Relativa Basicities Di Ammine
- Alcune Parole Di Cautela Su Valori di pKa Di Ammine
- Quali sono i principali Fattori che Regolano La Basicità Delle Ammine?
- Note
1. Revisione rapida: Acidi, basi, acidi coniugati e basi coniugate
In primo luogo, esaminiamo rapidamente alcune basi di basicità.
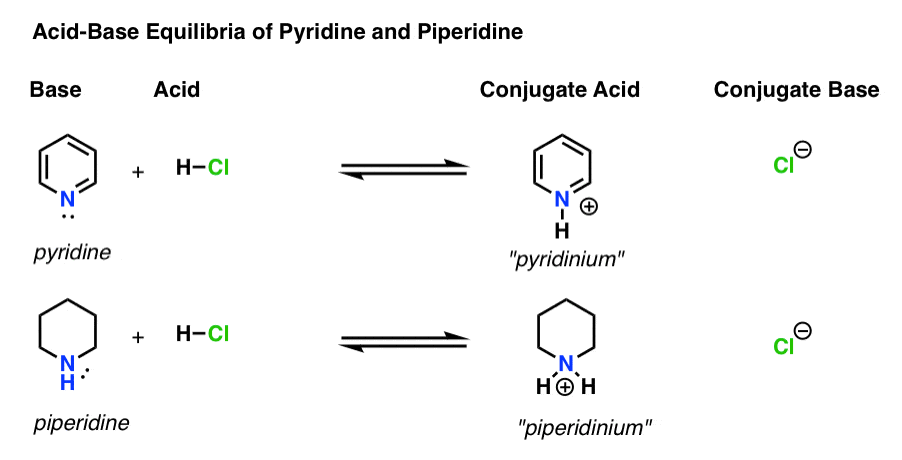
Ci sono quattro attori in ogni reazione acido-base.
- La base è la specie che dona una coppia solitaria a H+ (noto anche come “protone” o “nucleo di idrogeno”). È dove si forma il nuovo legame con H (ad esempio piridina, sotto)
- L’acido coniugato è la specie che risulta dopo che la base forma un legame con H (ad esempio “pyridinium” , che ha un nuovo legame N–H)
- L’acido è la specie che perde H+ . È dove si rompe il legame con H (ad esempio H-Cl)
- La base coniugata è la specie che rimane dopo che l’acido dona H+ alla base (ad esempio Cl-)
Ecco piridina e piperidina in azione. Seguendo i legami che si formano e si rompono, puoi identificare ogni attore.
2. Usando pKa Per misurare l’acidità
Ogni reazione acido-base può essere scritta come un equilibrio tra una reazione in avanti e una inversa. Abbiamo visto che la costante di acidità, Ka, è una misura di quanto facilmente una specie si dissocia per dare H+ e la base coniugata.
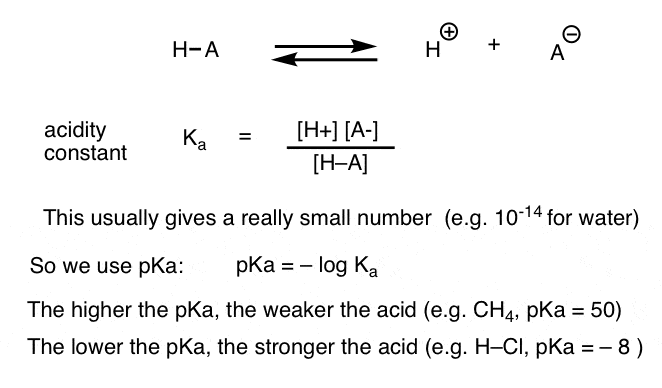
Per comodità, usiamo il log negativo di Ka, chiamato pKa, che è simile alla scala pH familiare ma può estendersi oltre 14 perché non è strettamente limitato al solvente acquoso. I valori di pKa vanno da -10 circa per gli acidi molto forti (ad esempio acido idroiodico, H–I) a 50 e oltre per alcuni idrocarburi (ad esempio etano).
Come possiamo applicare questi concetti per misurare la basicità? Non potremmo cambiare le cose e definire un termine, Kb , che è l’equilibrio per quanto facilmente una specie si combina con H+, definire pKb come il suo registro negativo e confrontare le basi guardando i loro valori pKb?
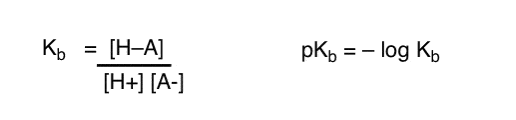
Sì…. potremmo. Credo di si’. Se fosse necessario. Ma in generale, l’opinione dei chimici organici su questo argomento è “Vite pKb”.
Dopo tutto, i valori di pKa sono stati misurati per migliaia di molecole organiche. Qualcuno vuole davvero ricordare anche un enorme set di valori pKb? Col cavolo!
Invece, possiamo facilmente usare i valori pKa come misura indiretta della basicità. Ecco come.
3. Usando i valori pKa per quantificare la basicità delle ammine
Ricorda queste due linee immortali di prosa, vale la pena recitare a te stesso ogni notte:
- Più forte è l’acido, più debole è la base coniugata.
- Più debole è l’acido, più forte è la base coniugata.
È stato misurato il pKa per l’acido coniugato della piridina (“pyridinium”). Si tratta di 5.2 .
Abbiamo anche un valore per il pKa per l’acido coniugato di piperidina. Sono circa le 11 .
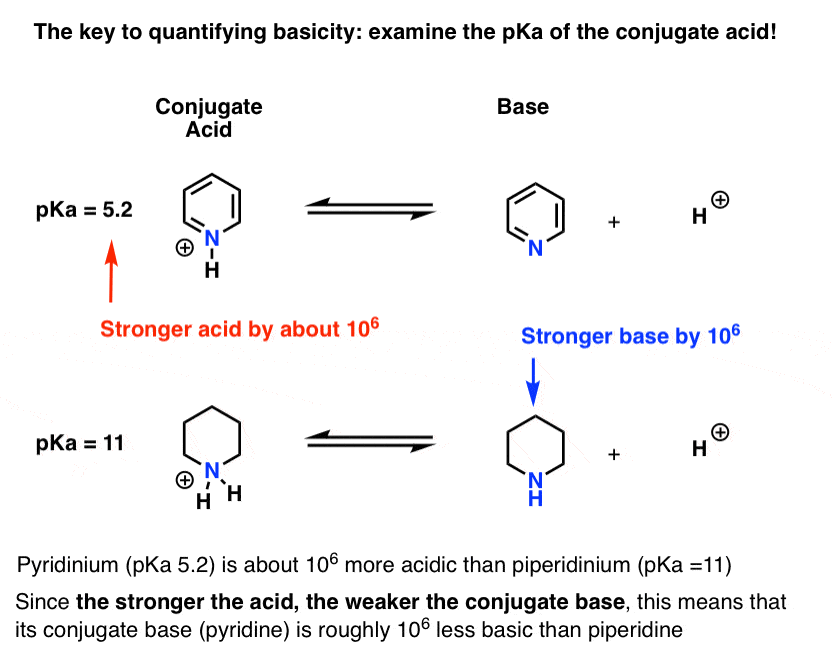
Da questi valori pKa, possiamo dire che l’acido coniugato della piridina è più forte dell’acido coniugato della piperidina di circa 6 unità pKa. Poiché ogni unità pKa rappresenta un fattore di 10, questo è un fattore di circa 1 milione.
Poiché “più forte è l’acido, più debole è la base coniugata”, la piridina è quindi una base più debole della piperidina di un fattore di 1 milione.
4. “Il pKa dell’acido coniugato” Può essere abbreviato come “pKaH”
Il termine, “pKa dell’acido coniugato” è un po’ un boccone da usare regolarmente. Essendo naturalmente pigri, vorremmo condensare questo un po ‘ per uso comune.
Poiché l’acido coniugato di una base (“B”) è “BH”, possiamo abbreviare “il pKa dell’acido coniugato di una base” come suo pKaH.
Questo ci permette di dire che la pKaH della piridina è 5.2, e la pKaH della piperidina è 11.
Possiamo quindi scavare nella letteratura per trovare altre basi per confrontarla.
Ad esempio, esattamente quanto è fondamentale l’ammoniaca (NH3) ? L’acido coniugato di ammoniaca, NH4 (+), è 9.2 . Equivalentemente, possiamo dire che il pKaH di ammoniaca è 9.2. Questo lo mette tra piridina e piperidina sulla scala di basicità.
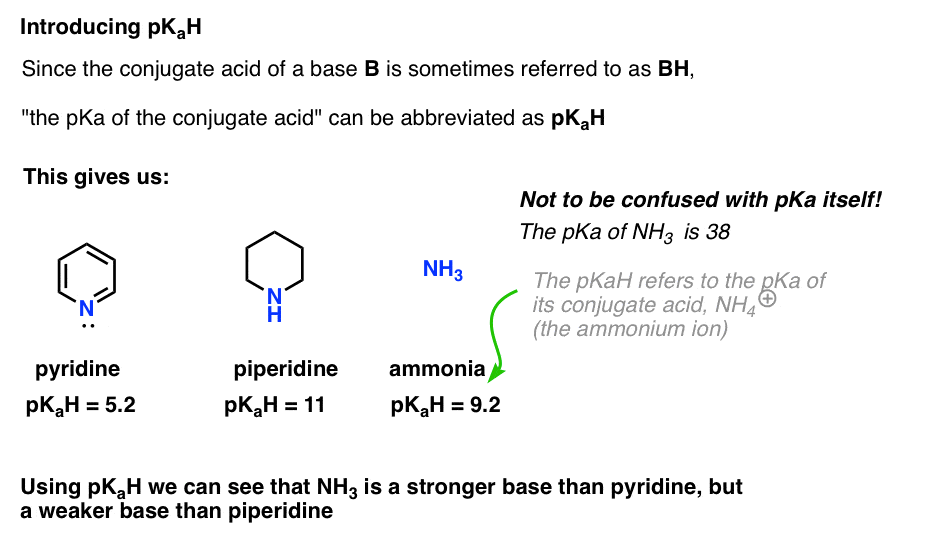
Si noti che è molto importante non confondere pKaH con pKa. Il pKaH di ammoniaca è 9.2, che misura l’acidità del suo acido coniugato, NH4(+).
Il pKa dell’ammoniaca stessa è 38, che misura la costante di equilibrio per la dissociazione di NH3 per dare la sua base coniugata, NH2(-) e H+.
Ciò significa che 38 è il pKaH dello am ammide NH2 ( – ), che potresti aver incontrato prima come base forte (NaNH2) usata per deprotonare gli alchini terminali (pKa =25). Usando pKaH, possiamo determinare che NH2 ( – ) è circa (38-9) = 29 ordini di grandezza più basilari di NH3 !
5. Usare pKaH per determinare le basi relative delle ammine
Usare pKaH per determinare i punti di forza relativi delle basi è un trucco piuttosto utile.
Ecco alcuni esempi rappresentativi di molecole contenenti azoto. Di seguito è riportato il pKa dei loro acidi coniugati.
Qual è la base più forte qui? Qual è il più debole?
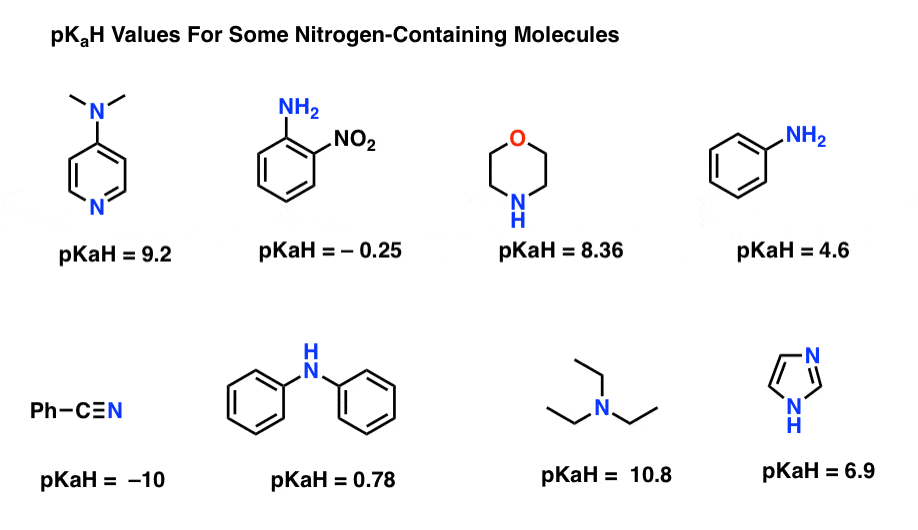
Il valore pKaH più basso qui è -10 per il nitrile (in basso a sinistra). Ciò significa che il nitrile è il meno fondamentale di tutte queste molecole.
Il valore pKaH più alto qui è 10,8 per la trietilammina. Ciò rende la trietilammina la base più forte di tutte quelle elencate.
Alcune parole di cautela sui valori pKa per le ammine
Due cose a cui prestare attenzione, specialmente quando si leggono altre fonti online su questo argomento.
In primo luogo, a volte i valori pKaH per le ammine sono riportati come valori pKa , senza spiegazioni. I migliori tavoli pKa non lo faranno, ma è difficile ordinare il grano dalla pula quando sei appena agli inizi.
Se vedi un valore pKa anomalo basso per un’ammina, probabilmente si riferisce al pKaH dell’acido coniugato.
Ad esempio, ecco una tabella pKa in cui il pKa di metilammina (CH3NH2) è elencato come 10.63.
Questo è basso. Speriamo che a questo punto, un valore di 10 per un pKa di un’ammina dovrebbe sembrarti strano, soprattutto perché il pKa dell’NH3 strettamente correlato è 38.
Il valore di 10,63 si riferisce effettivamente al pKa dell’acido coniugato di metil ammina, NON alla metilammina stessa. È un valore pKaH.
Allo stesso modo, la stessa tabella elenca la trimetilammina come avente un pKa di 9.8 . Ancora una volta, questo è in realtà il suo pKaH. Non riesco a trovare un valore pKa effettivo per la trimetilammina, ma immagino che sia >40, poiché la base coniugata della trimetilammina è il carbanione (CH3)2N–CH2(–) ).
Una seconda, meno comune fonte di confusione è che a volte il pKaH di un’ammina è riportato come il suo pKb, come in questa tabella che riporta il pKb di NH3 come 9.2 . Questo è impreciso.
Ancora una volta, i valori pKb non vengono molto in chimica organica universitaria, anche se mi è stato detto che a volte fanno la loro comparsa sul DAT / MCAT.
7. Quali fattori chiave regolano la basicità delle ammine?
Ora che abbiamo imparato almeno come quantificare e interpretare i valori pKa delle ammine e dei loro acidi coniugati, possiamo iniziare a porre la domanda chiave: perché? Quali fattori chiave regolano la basicità delle ammine? Quali sono le tendenze importanti?
Ad esempio, perché la piridina è una base più debole della piperidina? Perché i nitrili sono basi ancora più deboli? Perché i gruppi di ritiro degli elettroni tendono a rendere le basi più deboli delle ammine?
La buona notizia è che se già comprendi i fattori che governano l’acidità, devi semplicemente applicare gli stessi identici principi – ma al contrario!
Ne parleremo nel prossimo post. Cinque fattori che influenzano la basicità delle ammine
Note
Nota 1. Ci sono molti acidi che non sono basi (come NH4 che manca di una coppia solitaria) e molte basi che sono non acidi, come Cl (-), che è incapace di accettare una coppia solitaria. Quindi, dire” più forte è l’acido, più debole è la base ” è sbagliato.
Nota 2. Questa è la misura ottenuta usando l’acqua come solvente. Si potrebbe vedere un altro valore, 3.4, che si ottiene quando dimetilsolfossido (DMSO) è usato come solvente. Vedi Tabelle Bordwell pKa (DMSO)