Inseminación Intrauterina en el Perro

En: Recent Advances in Small Animal Reproduction, P. W. Concannon, G. England y J. Verstegen (Eds.) Editorial: Servicio Internacional de Información Veterinaria (www.ivis.org), Ithaca, Nueva York, EE.UU.
Inseminación Intrauterina en el Perro Utilizando el Catéter Trans-Cervical Escandinavo y una Comparación con otros Métodos ( 2-Feb-2001)
C. Linde-Forsberg
Facultad de Medicina Veterinaria, Departamento de Obstetricia y Ginecología, Universidad Sueca de Ciencias Agrícolas, Uppsala, Suecia
Introducción
El interés por la preservación del semen canino y la inseminación artificial (IA) está aumentando constantemente en todo el mundo, pero cada año se publican comparativamente pocos estudios en este campo, y es particularmente difícil encontrar datos de inseminaciones artificiales utilizando semen fresco, o semen conservado de acuerdo con varios métodos para enfriar, congelar y descongelar, y también comparar resultados cuando son diferentes se utilizan técnicas para realizar las inseminaciones. Una de las razones de la escasez de datos es que es costoso hacer estudios experimentales en perros, y pocos centros de investigación pueden mantener colonias de perros lo suficientemente grandes para este tipo de estudios. Otra razón es que la mayoría de las grandes empresas que procesan y distribuyen semen canino para criadores de perros trabajan sobre una base puramente comercial, y aunque algunas de ellas parecen llevar registros de sus resultados, no se divulgan estos resultados, ni la composición de los extensores ni los métodos para la conservación del semen. Cualquier conocimiento así adquirido, por lo tanto, permanecerá con las diferentes compañías, y no será de beneficio para el mundo científico, y por lo tanto tampoco para los criadores de perros en general. Los únicos estudios sobre inseminación artificial canina que reportan resultados de fertilidad de un gran número de inseminaciones son los de Seager et al., en 156 AIs de semen descongelado congelado utilizando deposición vaginal, Linde-Forsberg & Forsberg en 470 y 527 AIs respectivamente, utilizando tanto semen fresco, refrigerado extendido y congelado descongelado como IA vaginal e intrauterina, Linde-Forsberg et al., en 327 AIs de semen descongelado congelado, comparando IA vaginal e intrauterina, Linde-Forsberg reportando en 2041 AIs con semen fresco y refrigerado extendido y congelado descongelado y usando IA vaginal e intrauterina, y Thomassen et al., en 312 AIS congelados descongelados principalmente intrauterinos. Una serie de factores son de importancia para determinar la tasa de éxito de la inseminación artificial en perros, como cuándo y cuántas veces durante el ciclo estral de la perra se realiza la IA, la calidad y el manejo del semen, y la técnica de inseminación. Se puede encontrar más información sobre esas facetas en las referencias citadas. Este trabajo solo tratará sobre las técnicas de inseminación y los efectos del sitio de deposición de semen. Los estudios clínicos recientes han destacado la importancia de la inseminación artificial intrauterina en contraposición a la intravaginal en el perro y son los primeros en demostrar resultados significativamente mejores cuando el semen se depositó en el útero en lugar de en la vagina. En el estudio de Linde-Forsberg et al., la tasa de partos con deposición intrauterina de semen congelado fue de 84,4% en comparación con 58.9% utilizando deposición vaginal, y el tamaño medio de la camada fue de 5,4 + 3,0 en comparación con 4,0
+2,7 crías/camada (P<0,001). Los datos de fertilidad de 2041 inseminaciones artificiales son perros, realizados en perras suecas entre 1990 y 1998 y reportados al Kennel Club dentro de 2 semanas, (i. e. antes de que se pudiera haber realizado una prueba de embarazo para evitar sesgos en los resultados), mostró que se obtuvieron tasas de partos y tamaños de camada significativamente más altos no solo con semen congelado descongelado, sino también con semen fresco y refrigerado extendido cuando el semen se había depositado en el útero en lugar de en la vagina (Tabla 1).

Los resultados con semen fresco, que se muestran en la Tabla 1, son ligeramente demasiado altos porque el 11% de esas perras, por diversas razones, no solo fueron inseminadas artificialmente, sino también apareadas. La razón más frecuente de esto fue que los criadores intentaron aparearse con las perras demasiado temprano durante el estro y cuando los perros no se apareaban, sus dueños solicitaron una IA. La tasa de partos en el grupo también apareado fue de hasta 84,5%, con un tamaño medio de camada de 6,0 + 2,8 crías, en comparación con una tasa de partos de 48,9% y un tamaño medio de camada de 5,8 + 2,8 crías para aquellas perras que solo fueron inseminadas artificialmente. Parece, por lo tanto, que un número de AIs que se realizan con semen fresco en realidad se realizan en un momento no óptimo durante el estro, generalmente debido a la inexperiencia del criador, pero el resultado comparativamente pobre es probable también debido a que la IA se solicita debido a varios problemas en los perros. Los datos suecos, sin embargo, demuestran claramente que en el perro, la IA intrauterina mejora significativamente la tasa de partos y el tamaño de la camada. La tasa de partos por IA intrauterina aumentó de 36% para semen fresco a 50% para semen congelado descongelado, en comparación con IA vaginal. Y, con IA intrauterina, el tamaño medio de la camada aumentó en 0,3 crías por camada para semen congelado y en 0,6 y 0,7 por camada para semen fresco y refrigerado extendido. También es interesante en este contexto observar que el perro se considera una especie con deposición intrauterina de semen en el apareamiento natural, porque para cuando termina el lazo copulatorio, los espermatozoides han llegado a los oviductos . La fracción rica en espermatozoides se eyacula en la intromisión y durante la etapa temprana del lazo copulatorio, y es seguida por un gran volumen de líquido prostático que inmediatamente enjuaga los espermatozoides desde la estrecha vagina craneal a través del cuello uterino hasta el cuerpo uterino y los cuernos. La vagina parece ofrecer un ambiente desfavorable para los espermatozoides caninos, ya que una gran proporción pierde sus colas en cuestión de minutos después de la deposición en la vagina craneal . También se ha demostrado que se requieren alrededor de 10 veces más espermatozoides para obtener resultados similares por IA vaginal que por IA intrauterina con semen fresco, así como con semen congelado descongelado . Por lo tanto, hay muchos factores que contribuyen a los peores resultados obtenidos por la deposición intravaginal de semen en comparación con la deposición intrauterina.
Métodos para realizar IA Intrauterina en el perro.
La IA intrauterina en el perro se puede realizar transcervicalmente, ya sea a través del catéter escandinavo (o noruego), o mediante el uso de un endoscopio vaginal de fibra óptica rígida para visualizar el cuello uterino y un catéter urinario para perros para atravesarlo. La IA intrauterina también se puede lograr mediante métodos invasivos, como la laparoscopia o la cirugía abdominal completa. En algunos países, estos últimos métodos pueden ser ilegales o no considerarse éticamente aceptables.
Palpación del cuello uterino
Es absolutamente esencial que la persona que desea realizar IA canina aprenda a localizar el cuello uterino por palpación abdominal para poder depositar el semen en el lugar correcto y evitar lastimar a la perra. La perra debe tener el estómago vacío y la vejiga para facilitar el procedimiento. Para fines de entrenamiento, se recomienda utilizar los catéteres vaginales caninos de plástico de un solo uso (Minitub GmbH, Tiefenbach, Alemania) (Fig. 1).
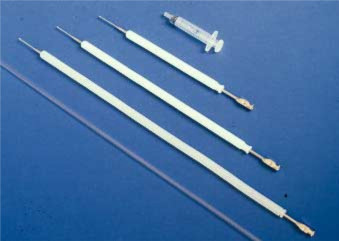
la Figura 1. Los tres tamaños del catéter de inseminación artificial escandinavo para perros y el catéter de inseminación artificial vaginal de plástico de un solo uso.
Debido a que la abertura ureteral de la perra se encuentra en el borde pélvico, es sorprendentemente fácil para el catéter AI, o un endoscopio rígido delgado, introducirse involuntariamente en la vejiga urinaria. Aparte de los peligros de perforar la vejiga con el catéter, es obvio que no habría embarazo después de una IA. Por lo tanto, la posición correcta del catéter debe comprobarse siempre por palpación antes de depositar una dosis de semen. Si el catéter se encuentra en la vejiga urinaria, se puede palpar la parte craneal de la vagina y el cuello uterino por encima del catéter. Las paredes de la vejiga urinaria por lo general son más delgadas que las de la vagina, y la punta del catéter se destaca más claramente que si estuviera en la vagina. Para palpar el cuello uterino, se introduce un catéter de IA en la vagina de la perra. La introducción del catéter se facilita si la vulva está elevada hasta que está justo debajo del ano (como cuando la perra representa al perro macho). Cuando se introduce la punta del catéter hasta el borde pélvico inmediatamente craneal, se debe palpar. Cranealmente, la vagina en la mayoría de las perras se inclina ligeramente hacia abajo. En algunas razas, sin embargo, especialmente los perros de la vista con un lomo muy arqueado, la vagina tiene una dirección más dorsal. El extremo craneal del catéter ahora debe bajarse más cerca de la pared abdominal para que sea más accesible a la palpación. Cuando se puede palpar la punta del catéter y comprobar así su posición correcta en la vagina, se introduce más cuidadosamente, bajo control palpatorio continuo, hasta que llega al área paracervical. Esta es la porción estrecha y craneal de la vagina creada por el pliegue dorsal medio post-cervical y se puede palpar como una estructura firme de 1 a 2 cm de largo. Termina en el cuello uterino, que en una perra en estro es una estructura dura de 0,5 a 1,5 cm, redondeada a ovoide, libremente movible. Por lo general, no es posible pasar la vaina protectora externa del catéter escandinavo, que tiene un diámetro de 10 mm, al área paracervical. También el catéter de plástico AI más delgado, que tiene un diámetro de 5 mm, puede ser demasiado ancho para introducirlo en el área paracervical en algunas perras, especialmente en las de razas más pequeñas o en aquellas que no han dado a luz a una camada de cachorros. Una vez que se ha identificado el cuello uterino, el cuerpo uterino y los cuernos uterinos se pueden palpar frente a esta estructura. Baje la punta del catéter y luego cierre la punta del pulgar contra la del dedo índice por encima del catéter, luego levante el extremo craneal del catéter de tal manera que el cuello uterino y los cuernos uterinos se jalen hacia arriba entre los dedos. Su tamaño y consistencia se hacen evidentes. (Este método de palpar el útero también es muy útil para la detección temprana del embarazo y para examinar perras con sospecha de piometra).
Inseminación intrauterina utilizando el Catéter Escandinavo
El catéter escandinavo consiste en un catéter de acero de 1 a 2 mm de ancho con un 0.punta de 75 mm a 1 mm de diámetro, y viene en tres longitudes diferentes: 20, 30 o 40 cm. Se utiliza junto con una funda de nylon protectora exterior de 10 mm de diámetro (Fig. 1 y Fig. 2). El catéter de tamaño mediano se adapta a la mayoría de las perras pequeñas y medianas. El equipo puede obtenerse en la Asociación Noruega de Criadores de Pieles, P. O. Box 136, Økern, N-0509 Oslo 5, Noruega.

la Figura 2. Un primer plano de los dos tamaños de puntas del catéter AI escandinavo para perros.
La IA intrauterina con el catéter escandinavo se realiza con la perra de pie en el suelo o en una mesa. La sedación es muy rara vez necesaria; por el contrario, la mayoría de las perras en celo aceptan libremente este tipo de manejo. En caso de que se requiera una sedación ligera, por ejemplo, en una perra muy grande, obesa o nerviosa, se puede usar 1-3 mg/kg de xilazina IM o IV. El catéter interior de acero, con la punta dentro y protegida por la funda de nylon, se introduce en la vagina. El extremo craneal de la vaina de nylon se palpa delante del borde pélvico como se describió anteriormente. Si la punta de la vaina del catéter se ha bajado más cerca de la pared abdominal, el cuello uterino generalmente se encuentra unos pocos cm por delante y por encima de él. El catéter de acero se introduce a través de la vaina hasta que su punta llega al fórnix ventral. El cuello uterino se fija entre el pulgar y el dedo índice y, al aplicar una tracción ligeramente hacia abajo en el cuerpo uterino, se inclina de modo que el ángulo del canal cervical se vuelve más horizontal (Fig. 3).
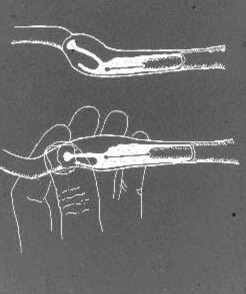
la Figura 3. Dibujo esquemático de la región paracervical canina y del canal cervical, con el catéter escandinavo en posición en la vagina craneal. Mediante manipulación en el cuello uterino y el cuerpo uterino, el ángulo del cuello uterino se cambia para que el canal cervical esté mejor alineado con la punta del catéter para facilitar el cateterismo.
La punta del catéter se retira cuidadosamente mientras se empuja repetidamente contra la superficie del cuello uterino en busca de la abertura del canal cervical. La sensación cuando se encuentra esta abertura se puede describir en la mayoría de los casos como la sensación de tocar cartílago, es decir, «crujiente». Una vez que se haya encontrado la abertura, fije el catéter y comience a trabajar el cuello uterino contra el catéter. El canal cervical mide de 5 a 10 mm de largo y no siempre es completamente recto. Por lo tanto, puede ser necesario aplicar una ligera presión, mientras se gira el catéter para facilitar su paso. En la mayoría de las perras, la punta del catéter se puede palpar fácilmente frente al cuello uterino en el cuerpo uterino. En algunas perras, sin embargo, la sensación no es tan distinta. La jeringa que contiene semen se conecta al catéter y el semen se infunde lentamente en el útero. A veces hay resistencia a la infusión dependiendo de si la abertura del catéter presiona la mucosa endometrial. Una ligera tracción hacia abajo del cuerpo uterino o el cuello uterino generalmente alivia la situación y permite la infusión de semen. Para verificar que el catéter realmente está en el útero de la perra, se puede infundir 1-2 ml de solución salina fisiológica. Si el catéter está en la posición correcta en el cuerpo uterino, el líquido puede ser fácilmente infusión. Si, por el contrario, el catéter se encuentra en la región paracervical, habrá un reflujo casi inmediato de solución salina entre el catéter y la funda de nylon. Se retira el catéter y los cuartos traseros de la perra se elevan y la perra se mantiene en esta posición durante 5-10 minutos después de la IA para minimizar el reflujo de semen y facilitar el transporte uterino de espermatozoides hacia los oviductos . La perra también debe emplumarse alrededor de la región perineal, ya que se cree que estimula las contracciones uterinas. Aprender esta técnica requiere algo de práctica, pero una vez que se aprende, es un método rápido, que generalmente se logra en minutos. Se recomienda que, inicialmente, se obtengan muestras de órganos con fines de entrenamiento y estudio anatómico. También es una ventaja si especialmente los primeros intentos se realizan en perras que han dado a luz una o más camadas, ya que generalmente son mucho más fáciles de cateterizar. Pueden producirse perforaciones si el catéter se introduce a ciegas o con fuerza. Sin embargo, siempre que el cateterismo se realice bajo un cuidadoso control palpatorio, la técnica es completamente segura para la perra. Algunas perras son más difíciles de cateterizar, particularmente las que pertenecen a algunas de las razas gigantes, así como los animales obesos o nerviosos. El uso del catéter escandinavo solo entre el 2 y el 3,5% de los intentos de cateterismo intrauterino no tuvieron éxito . Se ha informado de que las tasas de cría resultantes con semen congelado descongelado son de 84.El 5% y el 71% cuando son realizados por inseminadores calificados, un promedio del 65% con semen fresco y refrigerado y el 52% con semen congelado descongelado, en un estudio de campo más grande que involucró también a inseminadores con menos experiencia (Fig. 1). Esta técnica también se puede utilizar para la infusión intrauterina de medio de contraste para el examen histerográfico de la perra .
Inseminación intrauterina mediante Visualización Endoscópica del Cuello uterino
La inseminación intrauterina transcervical también se puede realizar con la ayuda de un endoscopio rígido de fibra óptica y un catéter urinario o angiográfico, en la perra de pie y sin sedación (Fig. 4 y Fig. 5).

La inseminación intrauterina mediante laparoscopia
La laparoscopia abdominal debe ofrecer una alternativa algo más aceptable a la cirugía completa para la IA en el perro. La técnica ha sido descrita por Wildt y Silva et al. . La IA notificó una tasa de embarazo de 60 a 73% mediante laparoscopia , pero el número de perras en esos estudios fue escaso.
Inseminación intrauterina mediante Cirugía
Se ha notificado cirugía para realizar inseminación intrauterina . Se han utilizado varios procedimientos quirúrgicos, con la perra bajo anestesia general y en reclinación dorsal. Se corta el abdomen ventral y, después de la preparación quirúrgica de rutina, se realiza una incisión de 4 a 6 cm a mitad de camino entre el pubis y el ombligo, a través de la línea alba. El útero se eleva a través de la incisión, y la aguja de la jeringa que contiene el semen se inserta en el lumen del cuerpo uterino en un ángulo de 45o con el bisel de la aguja hacia arriba. El semen se inyecta lentamente en el útero. Debe fluir fácilmente con una distensión obvia de los cuernos uterinos, o de lo contrario, la aguja debe reposicionarse. Se coloca una gasa humedecida con solución salina sobre el lugar de inyección después de retirar la aguja. Después de 1 minuto, se retira la gasa, se reemplaza el útero en el abdomen y se cierra la herida utilizando la metodología de rutina. Para evitar el reflujo de semen, la perra debe colocarse con la parte trasera elevada a medida que se recupera de la anestesia . Se ha reportado una tasa de embarazo de alrededor del 60% después de la IA quirúrgica en el perro , pero al igual que con la IA laparoscópica, los resultados se basan en estudios experimentales limitados y no hay datos de campo disponibles para la evaluación utilizando ninguno de los métodos. Es discutible si es éticamente aceptable recurrir a la cirugía para lograr embarazos. El método, aunque es defendido por algunos, es considerado por muchos como poco ético e inaceptablemente estresante para la perra. Los riesgos de infección, etc. asociado con la cirugía en general y el número limitado de IA quirúrgicas que se pueden realizar en una perra dada son dos desventajas obvias. El método también es costoso y requiere mucho tiempo.
1. Seager SWJ, Platz CC, Fletcher WS. Tasas de concepción y datos relacionados con el uso de semen de perro congelado. J Reprod Fertil 1975; 45: 189-192.
2. Linde-Forsberg C, Forsberg M. Fertilidad en perros en relación con la calidad del semen y el momento y lugar de inseminación. J Reprod Fertil 1989; 39 (Suppl): 299-310. – PubMed-
3. Linde-Forsberg C, Forsberg M. Resultados de 527 inseminaciones artificiales controladas en perros. J Reprod Fertil 1993; 47 (Suppl): 313-323. – PubMed –
4. Linde-Forsberg C, Ström Holst B, Govette G. Comparison of fertility data from vaginal vs intrauterine insemination of frozen-thawed dog semen: A retrospective study. Theriogenology 1999; 52: 11-23. – PubMed –
5. Linde-Forsberg C. Datos de fertilidad de 2041 inseminaciones artificiales controladas en perros. In: Proceeding of the 4th Int Symp Canine Feline Reprod, Oslo, 2000, 120 p. (abstr.)
6. Thomassen R, Farstad W, Krogenaes, A, Fougner, J. A. and Andersen Berg K. Inseminación artificial con semen congelado en el perro. Un estudio retrospectivo. J Reprod Fertil 2001, en prensa.
7. Tsutsui T, Kawakami E, Murao I, et al. Transporte de espermatozoides en el tracto reproductivo de la perra: Observaciones a través de fístulas uterinas. Jpn J Vet Sci 1989;51: 560-565. – PubMed –
8. Linde-Forsberg C. Inseminación artificial con semen fresco, refrigerado, prolongado y descongelado en el perro. Seminars in Vet Med Surg (Small Animal) 1995; 10: 48-58.
9. Tsutsui T, Tezuka T, Shimizu T, Murao I, Kawakami E, Ogasa A. Inseminación artificial con semen fresco en perras Beagle. Jpn J Vet Sci 1988;50: 193-198.
10. Inseminación de Andersen K. con semen de perro congelado basado en una nueva técnica de inseminación. Zuchthyg 1975; 10: 1-4.
11. Linde C. Transporte de líquido radiopaco al útero después de la deposición vaginal en la perra estral. Acta vet scand 1978; 19: 463-465.
12. Funkquist B, Lagerstedt A-S, Linde C, Obel N. Histerografía en la perra. Vet Radiol 1985; 26: 12-18.
13. Wilson M. Inseminación artificial intrauterina no quirúrgica en perras usando semen congelado. J Reprod Fertil 1993; 47 (Suppl): 307-311. – PubMed –
14. Battista M, Parks J, Concannon PW. Supervivencia de esperma canino después del deshielo después de la congelación en pajitas o gránulos usando TUBOS, lactosa, tris o extensores de PRUEBA. In: Proceedings of the 11th Int Congr Anim Reprod and AI, Dublin 1988; 3: 229-231.
15. Wildt DE. Laparoscopia. In: Burke TJ, ed. Reproducción de Animales Pequeños e Infertilidad. Philadelphia: Lea & Febiger, 1986; 121-140.
16. Silva LDM, Onclin K, Snaps F, Verstegen JP. Inseminación intrauterina laparoscópica en la perra. Theriogenology 1995; 43: 615-623.
17. Silva LDM, Verstegen JP. Comparaciones entre tres extensores diferentes para inseminación intrauterina canina con espermatozoides congelados descongelados. Theriogenology 1995; 44: 571-579.
18. Silva LDM, Onclin K, Lejeune B, Verstegen JP. Comparaciones de inseminación intravaginal e intrauterina de perras con semen fresco o congelado. Vet Rec 1996; 138: 154-157. – PubMed –
19. Smith FO, Graham EF: Criopreservación de semen canino: Técnica y rendimiento. In: Proceedings of the Xth Int Congr Anim Reprod and AI, Champaign-Urbana 1984; 2: 216.
20. Casa RODANTE Hutchison. Depósito intrauterino quirúrgico de semen Vaginal & In: Proceedings of the Canine Theriogenology Short Course 1993; 33-37.
21. Casa RODANTE Hutchison. Maximizar las tasas de concepción utilizando semen canino fresco refrigerado o congelado. In: Proceedings of the Canine Male Reprod Symp 1997; 61-70.