posts Tagged “MO elmélet; cikloaddition; Szerves Kémia; HOMO; LUMO; konjugált rendszer”
a konjugált rendszerreakciók egyik legnagyobb kihívást jelentő fogalma a molekuláris orbitális interakció vagy a MO elmélet. Ennek az elvnek az alapjait nehéz megérteni, de nagyon informatív lesz a helyes reakciófeltételek és a reakció kimenetele előrejelzésében, ha megérted őket, ami jelentős előnyt jelent a jövőbeli vetélkedőkön és vizsgákon. Mi a StudyOrgo – nál kidolgoztunk egy egyszerű magyarázatot a Mo elmélet alapjairól, hogy segítsünk a tanulmányi előkészületekben.
A MO-elmélet alapelvei
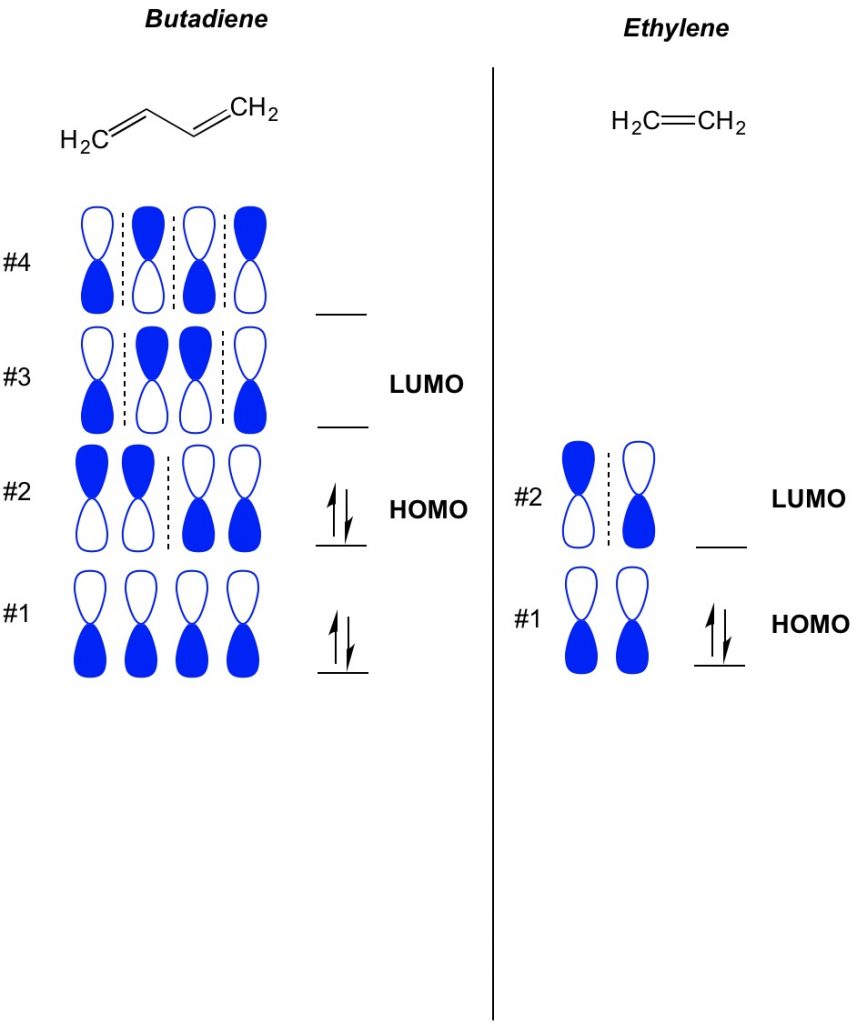
A MO-elmélet alapfogalma a PI-bond-rendszerekben létező pályák váltakozó mintáinak leírása. Leírjuk a tájékozódás minden fele a súlyzó orbitális köré egy atom, hogy merész vagy nyitott. Ne feledje, vannak kötődés és antibonding pályák. Lényegében az alacsonyabb számú csomópontokkal rendelkező pályák (a súlyzó orbitális orientációjában lévő kapcsolók, amelyeket a szaggatott vonallal mutatunk) inkább úgy viselkednek, mint a kötési pályák, míg a nagyobb számú csomópontú pályák úgy viselkednek, mint az anti-kötési pályák. Annak meghatározásához, hogy milyen pályák vannak elfoglalva a molekulán, egyszerűen számolja meg, hogy hány pi kötés van a konjugált rendszerben. Az alábbiakban egy példa a butadiene. 4 pi elektronokkal rendelkezik, így először a legalacsonyabb molekuláris pályákat töltjük be, mindegyik orbitálban kettő. Ezért a butadiénben a legmagasabb elfoglalt molekuláris orbitális vagy HOMO a #2. Ennek eredményeként a butadiénben a legalacsonyabb üres molekuláris obital vagy LUMO a #3. Ezt kiterjeszthetjük az etilénre, és láthatjuk, hogy 2 pi elektronokkal az 1. molekuláris orbitális a HOMO és a 2. molekuláris orbitális a LUMO.
Cikloadditions Mo elmélet
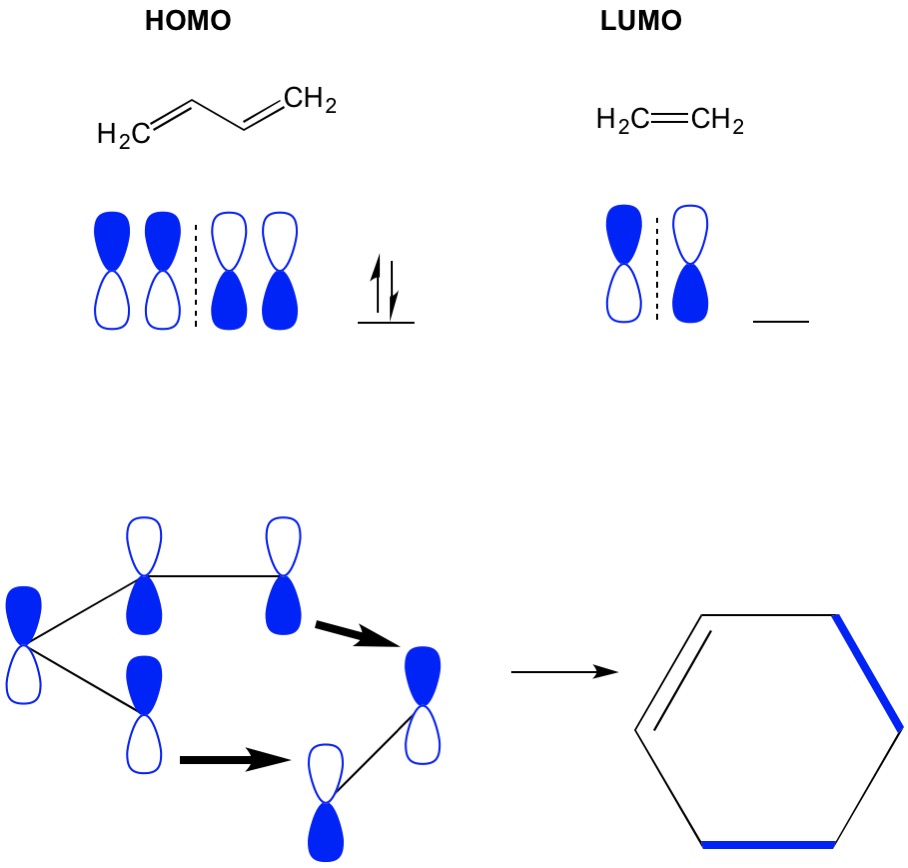
ne feledje, hogy a cikloaddíciós reakciók új C-C szigma kötések kialakulását írják le a PI elektronok konjugált rendszerben történő átrendeződése révén. Ezért a PI elektronok molekuláris pályáit kell használnunk a reakció vezetéséhez. Vegyük a butadién reakcióját etilénnel, a legegyszerűbb Diels éger reakcióval (4+2 cikloaddíció). Kezdjük a legtöbb konjugált molekulával, butadiénnel, és vizsgáljuk meg a HOMO-t. Ezután megnézzük a legkevésbé konjugált molekulát, az etilént, és megvizsgáljuk annak LUMO-ját. Miért? Szükségünk van az elektronokra egy HOMO-ból, hogy az egyik molekulából a másikba áramoljanak, ezért a LUMO orbitalt kell használnunk, amely nincs elfoglalva ehhez a folyamathoz. Látjuk, hogy a HOMO és a LUMO csomópontjai egymáshoz igazodnak; ez a súlyzók nyitott és zárt fele. Ez a termék, a ciklohexén előretöréséhez és kialakulásához vezet.
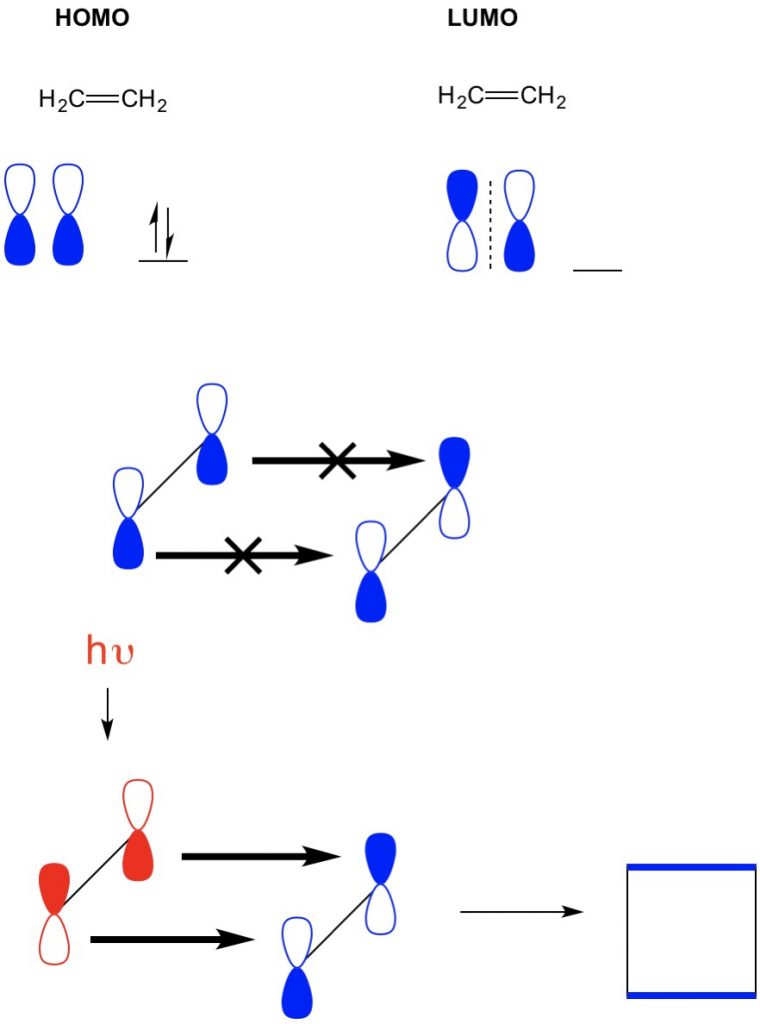
azonban egy másik példában, ahol van egy (2+2 cikloaddíció), azt látjuk, hogy az etilén HOMO és LUMO nem igazodik, így megtiltva a reakciót. Azonban képesek vagyunk gerjeszteni az elektronokat a HOMO-tól egy magasabb orbitális fény (hv) vagy hő segítségével, ezáltal megváltoztatva a HOMO-t. Ezt a koncepciót részletesen áttekintjük egy korábbi cikkben. Amikor ezt megtesszük, a gerjesztett etilén és a földi állapotú etilén lumo HOMO-ja összeáll, és a reakció ciklobutánt termel.
reméljük, hogy ez a leírás segített tisztázni a MO elmélet ezen fogalmait. Ez egy példa arra, hogy az Orgo1 és Orgo2 kurzusokon általában több mint 175 reakcióra készítettünk világos és egyszerű expatiációkat. Iratkozzon fel még ma a tanulmányi előkészítési igényeire!