Közös Ion Hatás
Tudomány > Kémia > Fizikai Kémia > Ionos Egyensúlyról > Közös Ion Hatás
ebben A cikkben, meg kell tanulni a közös ion hatás alkalmazásai.
az a jelenség, amelyben a gyenge elektrolit disszociációjának mértékét elnyomják egy közös iont tartalmazó kis mennyiségű erős elektrolit hozzáadásával, közös ionhatásnak nevezzük.
példa-1: (egy gyenge sav disszociációja)
a gyenge elektrolit ecetsav (CH3COOH)ionizációját elnyomják erős elektrolit–nátrium-acetát (CH3COONa)hozzáadásával, amely közös acetát-ion (CH3COO -)
magyarázat:
tegyük fel, hogy egy elektrolit ecetsavat (CH3COOH) vízzel kell kezelni. Disszociál és létezik egy egyensúlya következő:
CH3COOH(aq) ⇌CH3COO–(aq) + H+(aq)
a tömeghatalmi törvény alkalmazásával,
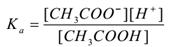
ahol ” ka ” a sav disszociációs állandója.
Ha egy kis mennyiségű erős elektrolitot, például nátrium–acetátot (CH3COONa) adunk a CH3COOH vizes oldatához, disszociálódik és egyensúly áll fenn, mivel
CH3COONa(aq) → CH3COO– (AQ) + Na+(AQ)
itt a CH3COO-ionok gyakoriak, így koncentrációjuk növekszik. A Le-Chatelier elve szerint az egyensúly balra tolódik. A Ka értékének állandó megőrzése érdekében a CH3COOH molekulák koncentrációja nő. Ily módon a CH3COOH ionizációját elnyomja a CH3COONa hozzáadásával. Így az oldat pH-ja nő.
2. példa: (gyenge bázis disszociációja):
a gyenge elektrolit ammónium-hidroxid (NH4OH)ionizációját erős elektrolit ammónium-klorid (NH4Cl) hozzáadásával elnyomjákkommon ammónium-ion (NH4+)
magyarázat:
tegyük fel, hogy egy elektrolit ammónium-hidroxidot (NH4OH)vízzel kezelnek. Disszociál, és létezik egy egyensúlya következő:
NH4OH(aq) NH NH4+(aq) + OH–(aq)
a tömeghatás törvényének alkalmazásával,
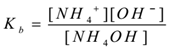
ahol ” kb ” a bázis disszociációs állandója.
Ha egy kis mennyiségű erős elektrolit, például ammónium–klorid (NH4Cl) hozzáadódik az NH4OH vizes oldatához, disszociálódik, és egyensúlyi helyzet áll fenn, mivel
NH4Cl(aq) → NH4+(AQ) + Cl – (AQ)
itt NH4+ ionok gyakoriak, így koncentrációjuk növekszik. A Le-Chatelier elve szerint az egyensúly balra tolódik. A Kb értékének állandó megőrzése érdekében az NH4OH molekulák koncentrációja nő. Ily módon az NH4OH ionizációját NH4Cl hozzáadásával elnyomják. Így csökken az oldat pH-ja.
közös Ionhatás alkalmazása:
közös só tisztítása:
elv:
a közös ion hozzáadása a só telített oldatához a só kicsapódását okozza. Amikor az ionos termék meghaladja az oldhatósági terméket, Csapadék történik.
folyamatés magyarázat:
a közönséges só telített oldata, amely mentes a szennyeződésektől, és a HCl gáz áthalad rajta. A tiszta NaCI telítettsolúciójában az egyensúly a következőképpen létezik:
NaCl(AQ) → Na+(AQ) + Cl–(AQ)
ha tiszta HCI gáz áthalad ezen a megoldáson, erős elektrolit, akkor szinte teljesen disszociál, és egyensúly létezik,
HCl(AQ) → H+(AQ) + CL–(AQ)
most CL– egy közös ion. A CI– ionok (közös ionok) koncentrációja nő. A Le-Chatelier elv szerint az egyensúly balra tolódik. A NaCI disszociációja elnyomódik, a tiszta NaCI pedig szilárd anyagként kicsapódik. Így a tiszta NaCI kicsapható a HCI gáz átadásával a tisztátalan NaCI telítetlen oldatában.
sózás a szappanból:
elv:
a közös ion hozzáadása a só telített oldatához a só kicsapódását okozza. Amikor az ionos termék meghaladja az oldhatósági terméket, Csapadék történik.
folyamatés magyarázat:
a szappan magasabb zsírsavak nátriumsója (RCOONa). Ezt az olajok NaOH-val történő hidrolízisével állítják elő. A telítettsoap oldatban létezik egyensúly,
ROONa(AQ) → RCOO–(aq) + Na+(AQ)
Ha egy kis mennyiségű NaCl–t adunk a telített szappanoldathoz, akkor
NaCl(AQ) → Na+(AQ) + Cl – (AQ)
Na+ ionok (közös ion) koncentrációja nő. A közös ionhatás miatt a szappan disszociációja csökken, a szappan kicsapódik, majd könnyen eltávolítható a szappanoldatból. Ezt a folyamatot a szilárd szappan szappan szappanoldatból történő előállításához só hozzáadásával, mint a NaCI, a szappanból történő sózásnak nevezik.