kémia tanuló
mi a koordináta kovalens kötés?
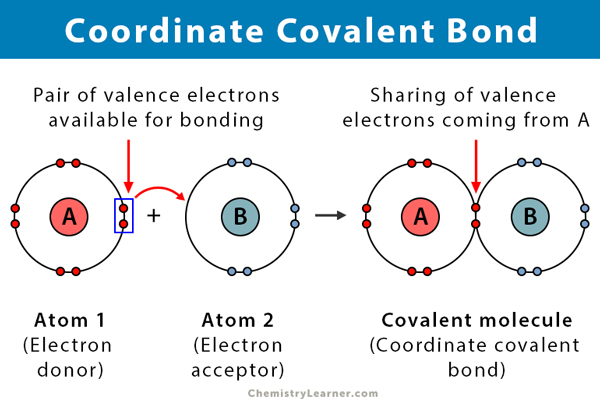
kovalens kötés keletkezik, amikor két atom megosztja az elektronokat. A koordináta kovalens kötés, más néven dative kovalens kötés, egyfajta kovalens kötés, amelyben a megosztott elektronpár az egyik atomból származik. Az atomokat azért tartják össze, mert mindkét mag vonzza az elektronpárt. Miután létrejött a kovalens kötés, lehetetlen megkülönböztetni az elektronok eredetét. Ez a fajta kötés általában megfigyelhető a fémionok ligandumokhoz való kötésében. Azonban a nem fémek is részt vehetnek ebben a kötésben. A Lewis-sav és a bázis közötti reakció egy koordináta kovalens kötés .
egy komplex ion két dologból, egy fémionból és egy ligandumnak nevezett vegyületből áll. A ligandumok semleges molekulák vagy ionok, amelyek magányos elektronpárokat tartalmaznak, amelyek kötődhetnek a fém ionhoz. Gyakori ligandumok az ammónia (NH3), a víz (H2O) és a halidionok (CL–, Br–). A ligandumokat Lewis-bázisoknak tekintik, mivel elektronpárjaikat megosztják a fémionnal. A fémionok mindig pozitívak, ezért nagyon vonzóak a magányos elektronpárok számára.
Tényeket Tulajdonságai Koordináta Kovalens kötés
A koordináta kovalens kötés sok a hasonlóság, hogy a kovalens kötés. Íme néhány tulajdonsága:
- zajlik között egy elektron donor, illetve az elektron akceptor, jellemzően fém, illetve egy ligand
- között Kerül sor eltérő atomok
- Alakult a megosztási az elektronok által adományozott egyik atomok
- a Merev, irányított
- Polar
- Atomok kövesse az oktett szabály
- Az atom ajándékozó az elektronok az úgynevezett donor, az atom pedig elfogadja az ún. elfogadó.
- a vegyületek vízben kevéssé oldódnak
példák a koordináta kovalens kötésre
Íme néhány példa azokra a molekulákra ,ahol a kovalens kötés létezik.
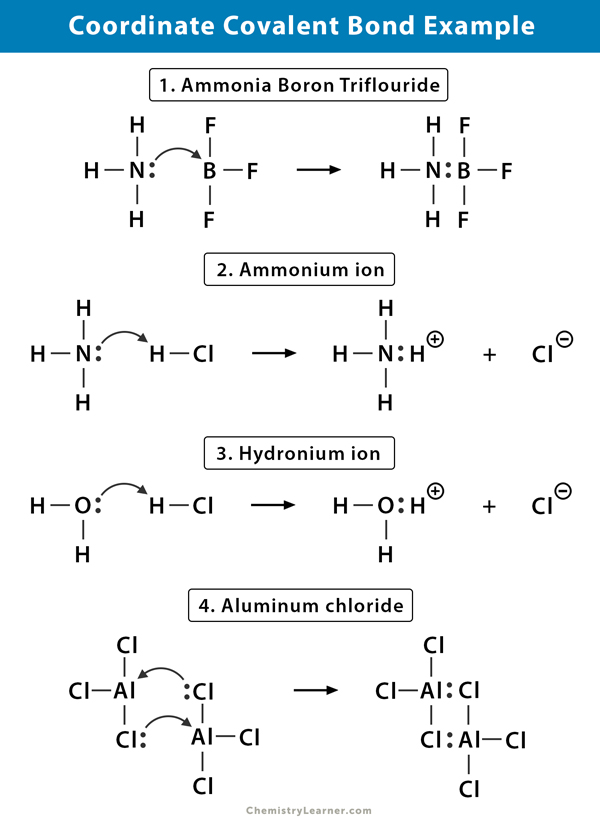
ammónium (NH4+) ion
az ammóniumion ammónia (NH3) gáz hidrogén-klorid (HCl) gáz reakciójából képződik. Az NH4+ – ban a negyedik hidrogént egy koordináta kovalens kötés köti össze, mivel csak a hidrogén magja kerül át a klórból a nitrogénbe. A hidrogén elektronja a klór mögött marad, hogy negatív klorid (Cl–) ion alakuljon ki.
az ammónia bór-trifluorid (NH3. BF3)
bór-trifluorid (BF3) olyan vegyület, amely nem rendelkezik nemesgázszerkezettel a bór (B) atom körül. A bórnak csak három pár elektronja van a valance héjában, és egy párra van szüksége az orbitális teljesítéséhez. Ezért a BF3 elektronhiányos. A magányos pár a nitrogén (N) az ammónia (NH3) molekula használt leküzdeni, hogy a hiány, valamint egy komplex, összetett formák keresztül egy koordináta kovalens kötés.
Hidrónium-ion (H3O+)
amikor a hidrogén-klorid (HCl) gáz vízben oldódik, hogy sósavat (HCl aq.), a hidroniumionban koordináta kovalens kötés alakul ki. A hidrogén (H) mag átkerül a víz (H2O) molekulába, amelynek egyetlen elektronpárja van, hogy hidroniumot képezzen. Tehát H nem járul hozzá semmilyen elektronhoz a kötéshez.
alumínium-klorid (Al2Cl6)
az alumínium-klorid (AlCl3) kötése lényegében kovalens. Minden Alumínium (Al) atomnak két elektronja van a valance héjában, a klór (Cl) pedig egy magányos pár. Az Al koordináta kovalens kötést képez a CL atommal egy szomszédos AlCl3 csoportban. Mivel a két Al Atom mindegyike ezt teszi, az alumínium-klorid kovalens dimer molekula, amelynek képlete Al2Cl6.
szén-monoxid (CO)
szén (C) négy elektron van a valenciahéjában, az oxigén (O) pedig hat. Mind a szén, mind az oxigén megosztja két elektronját. Míg az oktett szabály elégedett az oxigénnel, még mindig két elektron hiányzik a szénen. Tehát az oxigén megosztja két elektronját szénnel, hogy koordináta kovalens kötést képezzen, a két rendszeres (kettős) kovalens kötés mellett.