Gyenge a térd: Miller Fisher szindróma
Miller Fisher szindróma (MFS), egy ritka, önkorlátozó változata Guillain-Barré szindróma (GBS), egy anti-GQ1bIgG antitest szindróma, amely befolyásolja a perifériás és a központi idegrendszert.1 egy akut neuromuszkuláris polineuropátiás állapot, MFS okoz emelkedő bénulás egy klasszikus bemutató triad of ophthalmoplegia, ataxia és areflexia. A kutatók először 1932-ben írták le a klinikai triádot.1 két évtizeddel később Charles Miller Fisher kanadai stroke-szakember volt az első, aki 1956-ban jelentést tett közzé, amely leírta a klinikai eredményeket, és az állapotot a GBS korlátozott formájaként határozta meg.2
a tünetek több nap alatt jelentkeznek, gyakran télen és tavasszal, jellemzően vírusfertőzést követően, és a betegek gyakran diplopiát tapasztalnak az egyik első tünetként. Ha egy beteg bemutatja a tünetek, mint a szakaszos esotropia, csökkent a horizontális célok, illetve a határozott mydriatic tanulók, valamint a neurológiai kivizsgálás kóros, ideje, hogy az ÁKT -, kifejezetten ROHADÉKOK. A következő eset szemlélteti a vonatkozó jeleket és tüneteket, és tükrözi a tipikus eredményt.
kórtörténet
egy 27 éves kaukázusi férfi, akit a tavaszi hónapokban mutattak be a VA Eye Clinic-nek, akut kezdetű binokuláris diplopiát jelentett, amely egy nappal korábban kezdődött. A beteg azt állította, hogy állandó, de csak távolról nézve történt, vízszintesen elmozdított tárgyakkal. A diplopiával kapcsolatban nem volt szemfájdalom vagy homályos látás. A közelmúltban szédülésre és egyensúlyhiányra is panaszkodott. Jelentős paranasalis torlódásokkal járó sinus fertőzést jelentett, amely egy héttel a kettős látás előtt kezdődött. A korábbi szemészeti és orvosi előzmények nem voltak figyelemre méltóak; a beteg jelenleg nem szedett semmilyen gyógyszert, és nem volt gyógyszerallergiája.
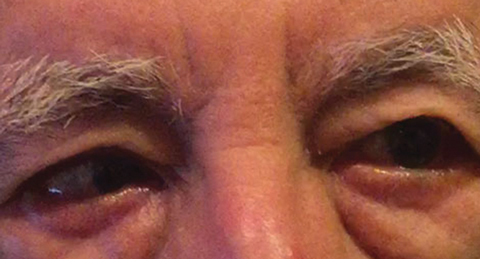
ábra. 1. A kiindulási vizsgálatot követő differenciáldiagnózis egy részleges jobb CN VI bénulást tartalmazott, amely vaszkuláris állapotot jelezhet, amint azt egy másik beteg esetében is láthatjuk. Kattintson a képre a nagyításhoz. Fotó: Michael DelGiodice, OD
diagnosztikai adatok
a kiindulási vizsgálat során a korrigálatlan látáskárosodás 20/20-2 OD és 20/25-2 OS volt. A pupillák 5 mm-esek voltak, ugyanolyan kerekek, és afferens pupilláris hiba nélkül reagáltak a fényre. Az extraokuláris motilitások teltek, simák és pontosak voltak mindkét szemben korlátozás nélkül. Cover teszt távolságban kiderült, egy szakaszos négy-hat prizma dioptria jobb ezotrópia elsődleges tekintete előforduló mintegy 50% – át az idő. Teljesítő fedél teszt közelében kiderült négy prizma diopter esophoria elsődleges tekintete nincs tropia.
bár ebben az esetben nem vállalják, a klinikusoknak ki kell terjedniük az elsődleges, a jobb és a bal szemre. Diplopiában szenvedő betegeknél a koponya ideg hat (CN VI) bénulása nem komitáns eltérésként jelenik meg, jobb vagy bal pillantásban rosszabb, attól függően, hogy melyik oldalon van a bénulás. A dekompenzáló fória viszont komikus eltérést mutat.
a fénytörési hiba -0,50 d gömb OD és -0,75 D gömb OS volt, a látás mindkét szemben 20/20-ra korrigálható. Az intraokuláris nyomás mindkét szemben normál határokon belül volt. Az elülső és a hátsó szegmens leletei a jobb és a bal szemen nem voltak megfigyelhetők. A látóidegek egészségesnek tűntek, mindkét szemben 0,15-ös csésze-lemez arány mellett.
Differenciáldiagnózis tartalmazza a részleges KN-VI. bénulás (1. Ábra), myasthenia gravis, a nyomó folyamat egy rohamosan romlik az állapota, távolság esophoria okoz időszakos igaz esotropia. A beteg tagadta a binokuláris diplopia korábbi kórtörténetét.
az agy és a pályák képalkotását a Szemklinika rendelte el, hogy kizárják az agy érintettségét, beleértve a kompressziós elváltozást is. Az agy és a pályák komputertomográfiás (CT) vizsgálatát a személyzet neuroradiológusa végezte el és értelmezte. Az időzítés és a rendelkezésre állás miatt a CT-t választották a mágneses rezonancia képalkotás (MRI) helyett; a vizsgálat és az eredmények a klinikán végzett CT-vel ugyanazon a napon, órák után érhetők el. Az eredmények nem voltak figyelemre méltóak, intrakraniális vérzés, kompressziós lézió vagy akut infarktus jelei nélkül.
a paranasalis sinusok CT-je középsúlyos vagy súlyos krónikus paranasalis sinus betegséget és a jobb maxilláris sinus teljes homályosodását mutatta ki. Nem volt hosszabbítás a pályára. A beteg háziorvosa tájékoztatták arról, hogy a beteg tünetei, szemvizsgálat megállapítások, illetve CT képalkotás eredmények elkezdett kezelés sinusitis maxillaris a szóbeli azitromicin öt napi adag csomag utasította a beteg, hogy kövesse nyomon a szem klinika.
a beteg öt nappal később tért vissza, miután befejezte az orális azitromicin tanfolyamot, és kijelentette, hogy nem tapasztalt javulást a távolság diplopia; emellett jelentős fotofóbia és periokuláris fájdalom jelentkezett mindkét szem körül. A beteg elmondta, hogy járászavara és járászavara is súlyosbodott. A vizsgálat során a legjobban korrigált látáskárosodás 20/20 maradt a jobb és a bal szemben. A pupillákat 8,5 mm-re kitágították, egyik szemben sem volt reaktivitás a fényre (2.ábra). Az extraokuláris motilitások oldalirányú korlátozást tártak fel fájdalommal a jobb szem mozgása során, a mediális korlátozás pedig fájdalommal a bal szem mozgása során, amely megfelel a jobb tekintetbénulásnak (3.ábra). A horizontális és a vertikális törekvések pontatlan és szaggatott mozdulatokkal szakkollégikusak voltak. Az Anterior és a posterior szegmens leletei továbbra sem ismertek.
Differenciál diagnózis után szemészeti vizsgálat tartalmazza bal internuclear ophthalmoplegia, igaz tekintet bénulás, majd jobb tekintet bénulás a bal internuclear ophthalmoplegia, ami megmagyarázza extraokuláris motilitás megállapítások. Egyéb különbségek közé tartozik a középagy sérülése vagy a myasthenia gravis. A pupillatágulás differenciáldiagnózisai közé tartozik a harmadik ideg (CN III) bénulás, trauma és farmakológiai dilatáció. A betegnek nem voltak más, harmadik idegbénulásra utaló nyomai, és nem tagadták meg a traumát vagy a farmakológiai hatóanyagoknak való kitettséget.
a beteget további vizsgálat céljából neurológiára utalták. A neurológiai vizsgálat szerint a beteg teljesen éber és orientált volt, arcérzete nem csökkent. A beteg enyhe ataxiát mutatott, nehezen járva párhuzamosan, guggoló helyzetből állva. Proximális gyengeség mind a felső, mind az alsó végtagokban, valamint abnormális reflexek voltak jelen. Minden érzékszervi mód sértetlen volt. Az agy és a pályák MRI és mágneses rezonancia angiográfiája (mra) nem volt figyelemre méltó. A cerebrospinális folyadékfehérje 75 mg/dL-nél emelkedett (referenciatartomány: 15 mg/dL-45 mg/dL), más rendellenességek nélkül. Az elektromiogram-vizsgálat nem volt figyelemre méltó, és nem mutatott eltérést az idegvezetésben a gerinctől a lábig és a kezekig.
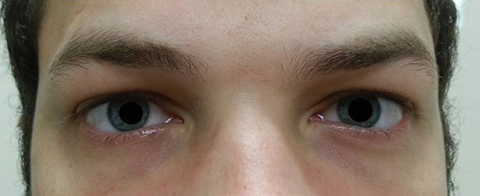
ábra. 2. A beteg pupillái 8,5 mm-re tágultak, a jobb vagy a bal szem nem reaktiválódott. Kattintson a képre a nagyításhoz.
diagnózis
a beteg diplopia, ataxia és areflexia akut tüneteit mutatta. Tekintettel a szakaszos jobb esotropia, károsodott vízszintes üldözés, fix mydriatic pupilla, enyhe ataxia és abnormális reflexek neurológiai vizsgálat és emelkedett cerebrospinális folyadék fehérje, a diagnózis MFS készült. A beteget kórházba vitték, hogy ellenőrizzék a további szövődményeket. A beteg szemfoltot kapott, hogy a diplopia érdekében szükség szerint lefedje a jobb szemet.
A Miller Fisher-szindrómára jelenleg nincs közzétett diagnosztikai kritérium. A diagnózis általában a klinikai triád bemutatásával, valamint képalkotó és cerebrospinális folyadékvizsgálatokkal történik. Az MRI-t általában nem veszik figyelembe az állapotban, bár egyes vizsgálatok központi elváltozásokat mutattak a középagy, a pons és az alsó medulla területén. Az elektrofiziológiai vizsgálatok csökkent vagy abnormális perifériás szenzoros vezetést mutatnak.17
a cerebrospinális folyadékfehérje gyakran emelkedik, más rendellenes eredmények nélkül. Egy mérföldkőnek számító vizsgálatban az MFS-ben szenvedő betegek 64,4% – a emelkedett gerincfolyadék-fehérjét mutatott.8 a pozitív anti – Gq1b IgG antitest teszt lehetővé teszi a végleges diagnózist. Egy vizsgálatban az anti-Gq1b IgG antitest a betegek legfeljebb 95% – ánál volt jelen, akiknél a kontrollok nem voltak jelen.3
A neurológus diagnosztizált beteg, a ROHADÉKOK alapján a klinikai triád a ophthalmoplegia, ataxia, valamint areflexia, egy jelentéktelen MRI-t, MRA, az agy, valamint az emelkedett liquor fehérje. Ezért ebben az esetben nem végeztek anti-GQ1b IgG antitestvizsgálatot.
az MFS számos klinikai jellemzője a Guillain-Barré-szindrómában és a Bickerstaff agytörzsi encephalitisében is megfigyelhető, így a diagnózis kihívást jelent. Olyan betegek, akiknél csak a végtaggyengeség, az érzékszervi károsodás, a koponya neuropátia és az areflexia van jelen, szemészeti tünetek nélkül. A Bickerstaff agyvelőgyulladásban szenvedő betegek jellemzően ophthalmoplegia, ataxia, hiperreflexia és zavart tudatállapotban vannak jelen. Mivel mindhárom állapotban számos tünet és tünet van jelen, az anti-GQ1b IgG antitest titer tesztelése segít a pontosabb diagnózis felállításában. Az Anti – Gq1b IgG antitest a Miller Fisher-szindrómás betegek nagy többségében pozitív, szemben a Bickerstaff agytörzsi agyvelőgyulladásban szenvedő betegek 66%-ával és a Guillain-Barré-szindrómás betegek 26% – ával.16
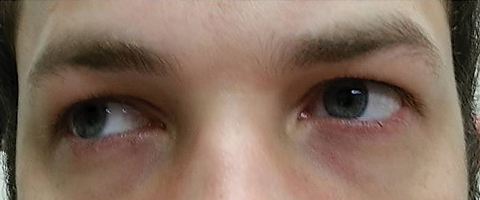
ábra. 3. Az extraokuláris motilitások korlátozást mutattak a dextroverzióban. Kattintson a képre a nagyításhoz.
kezelés és utánkövetés
a beteget a beadást követő napon értékelték, amikor kijelentette, hogy nem tapasztal vizuális változásokat vagy egyensúlyjavulást. A binokuláris diplopia továbbra is állandó volt, ezért a jobb szem foltos maradt. Még mindig jelen voltak a távoli tekintetekkel és gyors szemmozgásokkal járó szemfájdalom. A korlátozott ágy melletti vizsgálat során a legjobban korrigált látászavarok 20/20-ig maradtak a jobb és a bal szemen. 8-kor kitágultak a pupillák.0mm mindkét szemében minimális reaktivitással, ami kissé javult az előző naphoz képest. A színlátás normális volt a jobb és a bal szemében. Az extraokuláris motilitások tele voltak minden négyzetben, fájdalommal, amely még mindig jelen van a távoli vízszintes kilátásokon. A horizontális törekvések továbbra is saccadikusak voltak a szaggatott mozgásokkal és a végpont nystagmussal. A látóidegek egészségesnek tűntek, különböző margókkal, mindkét szemben 0,15 csésze-korong Arány.
két nappal azután, hogy a beteg kijelentette, hogy minden tünet javul, és hogy a szeme ” jobban érzi magát ma, mint egy ideje.”A szemfájdalom és a binokuláris diplopia egyaránt megoldódott. A látászavar 20/20 maradt a jobb és a bal szemében. A pupilla mérete 7,5 mm volt sötétben és 7,0 mm-es fényben, mindkét szemben javult a közvetlen és konszenzusos válasz. Az extraokuláris motilitások tele voltak minden négyzetben, szemfájdalom nélkül. A horizontális törekvések továbbra is saccadikusak voltak a szaggatott mozgásokkal és a végpont nystagmussal. A neurológiai vizsgálat abnormális reflexeket tárt fel, amelyek stabilak maradtak. Az MFS kezelési lehetőségei közé tartozik a plazmaferezis és az intravénás (IV) immunglobulin IgG, de ezeket a ophthalmoplegia és az ataxia javulása miatt visszatartották.
Négy nappal később, a beteget jelentett összes tünetek még javítása, némi nehézség árán fókuszálás követi, míg a számítógép használata. Az egyensúly 80% – ban megoldódott, és kevés volt a távolság diplopia. Acuities maradt 20/20 OU. A pupillák 5,5 mm-esek voltak sötétben és 4,0 mm-esek, 3 + közvetlen és konszenzusos válaszokkal. Az extraokuláris motilitások tele voltak minden négyzetben, szemfájdalom nélkül. A vízszintes törekvések javultak, saccadikus mozgások nélkül. A monokuláris elhelyezés normális volt, amit 8,5, illetve 9 prism dioptriát mértek.
egy héttel később a beteg arról számolt be, hogy látása normalizálódott, diplopia és enyhe fókuszálási és követési nehézségek nélkül. Az egyenleg 100% – ban megoldódott. A látászavar 20/20 maradt a jobb és a bal szemében. A pupillaméretek 5,5 mm sötétben, 4,0 mm fényben, 4 + közvetlen és konszenzusos válaszokkal. Az extraokuláris motilitások tele voltak minden négyzetben, szemfájdalom nélkül. A vízszintes törekvések javultak, nem figyeltek meg szaccadikus mozgásokat. A szem egészsége nem volt figyelemre méltó OU.
a kezelést a stabil areflexiával rendelkező ophthalmoplegia és ataxia felbontása miatt felfüggesztették. Az optalmoplegia és az ataxia teljes felépülése két hétig tartott. Menedzsment tartalmazza, figyelemmel a következő négy hét alatt; a beteg azt tanácsolta, hogy vissza hamarabb, ha a tünetei visszatértek.
klinikai jellemzők
az MFS-szel végzett jól leírt vizsgálatokban minden beteg az ophthalmoplegia, ataxia és areflexia klinikai triádját kapta.4,5 a tünetek általában több nap alatt jelentkeznek, és a betegek egy-négy héttel a klinikai tünetek megjelenése előtt vírusfertőzésben szenvednek.4,5 egy 50 betegen végzett vizsgálat szerint a fertőzés kialakulása és a neurológiai tünetek kialakulása közötti átlagos intervallum nyolc nap.4 az MFS egyéb jelei közé tartozik az elmosódott beszéd, a nyelési nehézség és az abnormális arckifejezés, amely nem képes mosolyogni vagy sípolni.
szemészeti jellemzők. Gyakorló kell figyelni mydriasis, fedél visszahúzás, hegyesszög bezárása, valamint diplopia másodlagos ideg palsies érintő KN-III., IV., VI.3,8,10,22,24 Diplopia a leggyakoribb szemészeti tünete jelentett sok ROHADÉKOK, tanulmányok.8,16,25,26,27 Diplopia szintén a kezdeti tünet, amelyet egy mérföldkőnek számító vizsgálatban 223 beteg 38,6% – ánál, egy második vizsgálatban pedig 466 beteg 65% – ánál jelentettek.8,27 a második vizsgálatban a betegek 100% – ánál külső ophthalmoplegia, míg a belső ophthalmoplegia a betegek 35% – ánál volt jelen.27 külső ophthalmoplegia a külső extraokuláris izmok károsodására utal. A belső ophthalmoplegia a pupilláris sphincter és a ciliáris izom károsodására utal. A teljes ophthalmoplegia mind a külső, mind a belső izmokat érinti.
egy retrospektív vizsgálatban, amelyben 19, MFS-ben szenvedő beteg vett részt, mindegyikben egy vagy több, az extraokuláris izmokat érintő idegbénulás volt.25 egyéb vizsgálat azt mutatja, hogy az MFS-ben szenvedő betegeknél több koponyaideg-palsia is előfordulhat, amelyek kétoldalúan nyilvánulhatnak meg.22,24,25 az anti – Gq1b IgG pozitív rendellenességek egyik gyakori megállapítása az elrablási hiány, amely egy egyoldalú vagy kétoldalú CN VI bénulásnak felel meg.26,28 a belső ophthalmoplegia a pupilla mydriasist okozza, ahol a pupilla szűkülése a fényre és / vagy a közeli stimulációra a minimálistól a távollétig terjedhet.8,26 egy jelentésben a mydriasis a betegek 42% – ánál volt jelen. A CN VII bevonása az MFS-ben szenvedő betegek körülbelül 45,7% – ánál fordult elő, ami arcgyengeséget, képtelenséget vagy sípolást okozott.8
Ataxia. Ennek a klinikai jellemzőnek az oka az MFS-ben nem teljesen ismert. Vita folyik arról, hogy az ataxiát a kisagyban vagy a periférián lévő diszfunkció okozza-e. Az első hipotézis, amelyet Dr. Fisher javasolt, feltételezte az Ia-afferens neuronok bevonását.2 ezt támogatta egy második tanulmány évtizeddel később, amely kimutatta rendellenességek Ia-afferens szálak MFS.11 abnormális perifériás ideg érintettséget is javasoltak az izomagyakból származó proprioceptív bemenet és az ízületi receptorokból származó kinesztetikus információ közötti eltéréssel.12
bizonyíték van arra is, hogy az ataxia a kisagyból származik. Túlnyomórészt anti-GQ1b IgG antitest a kisagy találták segítségével immunocytochemical festés, az emberi kisagy, valamint további megerősítette a western blot tanulmányok, amelyek azt mutatták, hogy magasabb anti-GQ1b IgG antitest a ROHADÉKOK, beteg, mint az irányítást, bár a mechanizmus kisagyi bevonása nem vizsgálták.13,14 2015-ben a kutatók egy MRI-n átesett MFS-beteg esetjelentését tették közzé. Csökkent az N-acetil -partát / kreatin arány, ami cerebelláris diszfunkcióra utal, amely a helyreállítást követően 2, 5 hónappal visszatért a normális szintre.23
Areflexia. Ez a klinikai jellemző, valamint a mély ín reflexek depressziója, a perifériás idegrendszer MFS-ben való részvételének jele. Az elektrofiziológiai vizsgálatok validálták a kóros perifériás idegvezetést GBS-ben és MFS-ben.3 egy vizsgálatban az AREFEXIA-val kezelt MFS-esetek 81,6% – a.8 egy másik mérföldkőnek számító vizsgálat azt mutatta, hogy minden betegnél tapasztalták az areflexiát, amely még hat hónappal a megjelenés után is jelen volt.4
mennyire gyakori az MFS?
A Miller Fisher-szindrómára vonatkozó epidemiológiai adatok korlátozottak. Az MFS előfordulása meglehetősen ritka, évente 0,09 / 100 000 embernél fordul elő.3 MFS gyakrabban fordul elő Guillain-Barré-szindrómában szenvedő betegeknél, 3% – ról 25% – ra.4,6,7 ez a társulás inkább a Távol-keleti származású betegeknél fordul elő, ami az MFS lehetséges genetikai összetevőjére utal. A megjelenés átlagos életkora 43 év, a 13-78, 5 MFS tartomány a férfiakat kétszer annyit érinti, mint a két-1, 03, 5 MFS arányú nőstényeket a téli és tavaszi évszakokban.5,6,8 A pontos oka a szezonális előszeretettel, nem határozták meg, de valószínűleg kapcsolódó post-fertőző jellegét az állapot, mint a bakteriális vagy vírusos fertőzések megállapították, hogy a trigger egy autoimmun reakció okozza a termelés az anti-GQ1b IgG antitest, a ROHADÉKOK.
patofiziológia
A Miller Fisher-szindróma patofiziológiája nem ismert jól, azonban számos hipotézis létezik immunológiai és szövettani vizsgálatokból. Köztudott, hogy az állapot az anti-GQ1b IgG antitest szindrómák spektrumán belül van, Guillain-Barré-szindrómával és Bickerstaff agytörzsi encephalitisével együtt.
a gangliozid GQ1b a központi és perifériás idegrendszerekben részt vevő komplex lipidek csoportja. A gq1b a koponyaidegek plazmamembránszerkezetének olyan eleme, amely az extraokuláris izmokat ellátja, és részt vesz a sejtek működésében a preszinaptikus neuromuszkuláris csomópontban.
egy megelőző kiváltó fertőzés autoimmun mechanizmusa az anti-GQ1b IgG antitestet termeli, amely károsítja a gangliozid GQ1b funkciót, demielinizációt okozva. A szövettani vizsgálatok demielinizációt és axonális duzzanatot mutattak a perifériás és oculomotoros agyidegekben.15 az anti-GQ1bIgG antitest egészséges betegeknél hiányzik, de az MFS-ben szenvedő betegek több mint 90% – ánál pozitív.16,25
bakteriális és vírusfertőzések autoimmun választ váltottak ki, ami az anti – gq 1b IgG antitest termelődését okozta. A mycoplasma pneumonia, a HIV, a Campylobacter jejuni, a hemophilus influenza, a Helicobacter pylori és az Epstein-Barr vírus a következő fertőző ágensek, amelyek MFS-hez társultak.4,16 egy jelentésben, amely 466 MFS-es beteget vizsgált, 90% – uk megelőző betegségben szenvedett, beleértve a felső légúti fertőzést, a hasmenést vagy mindkettőt.27
prognózis és kezelés
A Miller Fisher-szindróma önkorlátozó betegség, és összességében pozitív prognózissal rendelkezik. A tünetek általában néhány hét elteltével javulnak, a teljes gyógyulás általában két-három hónap alatt következik be. Egy vizsgálatban a gyógyulás a tünetek megjelenésétől számított 13 napos medián értéken kezdődött, és hat hónap alatt teljesen megszűnt az ophthalmoplegia és az ataxia.Az esetek kevesebb, mint 3% – ában 4,5 visszaesést észleltek.4,5
bár az MFS jellemzően önkorlátozó, szisztémás szövődmények társultak az állapothoz. A felső légúti fertőzéseket az MFS-ben szenvedő betegek 56-76% – ánál találták, ami mechanikus szellőzést igénylő légzési elégtelenséghez vezethet.4,18,19 egyéb ritka súlyos szövődmények: kardiomiopátia, tejsavas acidózis és kóma.3,20
az MFS kezelési lehetőségei közé tartozik a plazmaferezis, az IV immunglobulin IgG, valamint a kezelés nélküli monitorozás. A kutatók posztulátum, hogy a plazmaferezis, majd IV. IgG hatékony lehet, hogy a sebesség felbontás idő óta antitest Gq1b az IgG osztályú, valamint a half-life-IgG körülbelül 21 nap, amely hosszabb, mint az öt-hat nap felezési IgM, illetve IgA.19 azonban nem végeztek randomizált, kettős vak, placebo-kontrollos vizsgálatokat, amelyek ezeket a kezeléseket vizsgálták volna.
Egy retrospektív tanulmány nem bizonyította, plazmaferezis megváltozott az esély a teljes felépülésre, s itt az idő, hogy oldja ataxia, valamint ophthalmoplegia; további, az intervallum kezdete kezdeni a plazmaferezis kezelés nem befolyásolta idő, a felbontás vagy a súlyos tünetek kialakulását. Egy esettanulmány azonban azt jelzi, hogy a plazmaferezis akkor javallt, ha súlyos ataxia, motoros és légzési elégtelenség áll fenn.21
a betegeket szoros megfigyelés alatt kell tartani a súlyos szisztémás szövődmények, például a felső légúti elégtelenség kialakulásának kockázata miatt. A vizsgálatok nem mutatnak szignifikáns javulást a gyógyulási időben IV IgG vagy plazmaferezis kezelés MFS, így monitoring lehet egy orvos legjobb megoldás.
bár ritka, az állapot nem szükséges diagnosztizálatlan. A legfontosabb klinikai jellemzők felismerésével a szakemberek felfedhetik betegük tüneteinek okát, és bizalmat szerezhetnek a teljes gyógyulásban.
Dr. Wang és Cantrell az Orlando VA Orvosi Központ optometristái. Dr. Cali a Lee Megyei VA Klinika munkatársa. A szerzők szeretnék megköszönni Joseph Miller, OD, Paul Gruosso, OD, és Vanessa Santos, OD, segítséget ebben a kéziratban.
1. Collier J. perifériás ideggyulladás: a Morisa előadások. Edinburgh Med J. 1932: 39: 601-18.
2. Fisher M. az akut idiopátiás polyneuritis (ophthalmoplegia, ataxia és areflexia szindróma) szokatlan változata. N Eng J Med. 1956:255:57-65.
3. Lo YL, et al. A Miller Fisher-szindróma klinikai és immunológiai spektruma. Izom Ideg. 2007:36(5):615-27.
4. Mori M, Kuwabara S, Fukutake T, et al. A Miller Fisher-szindróma klinikai jellemzői és prognózisa. Neurológia. 2001:56(8): 1105-6.
5. Mori M, Kuwabara S, Fukutake T, et al. Plasmapharesis és Miller Fisher-szindróma: 50 egymást követő eset elemzése. J Neurol Neurosurg Psych. 2002:72:680.
6. Yuan CL, Wang YJ, Tsai CP. Miller Fisher-szindróma: kórházi retrospektív vizsgálat. Euro J Neurol. 2000:44(2):79-85.
7. Cheng BC, Chang WN, Chang CS et al. Guillain-Barré-szindróma Tajvan déli részén: klinikai jellemzők, prognosztikai tényezők és terápiás eredmények. Euro J Neurol. 2003:10 (6):655-62.
8. Berlit P, Rakicky J. A Miller Fisher-szindróma. Az irodalom áttekintése. J klinikai neuro-szemészet. 1992:12:57-63.
9. Lyu RK, Tang LM, Cheng SY, et al. Guillain-Barré szindróma Tajvanon: 167 beteg klinikai vizsgálata. J Neurol Neurosurg Psych. 1997:63:494-500.
10. Tatsomoto M, Odaka M, Hirata K, Yuki N. izolált abducens bénulás, mint a Guillain-Barré szindróma regionális változata. J Neurol Sci. 2006:243:35-8.
11. Weiss JA, fehér JC. Az 1a afferens vezetés korrelációja a Fisher-szindróma ataxiájával. Izom Ideg. 1986:9:327-32.
12. Das P, Biswash S, et al. A guillain-barré-szindróma Miller Fisher változata: esetjelentés és klinikai felülvizsgálat. Bangabandhu Sheikh Mujib Medical Univer J. 2012: 5 (1): 69-71
13. Kornberg AJ, Pestronk A, Blume GM, et al. A cerebelláris molekuláris réteg szelektív festése Miller Fisher szérum IgG-jével és a kapcsolódó szindrómákkal. Neurológia. 1996:47:1317-20.
14. Inoue N, Koh C, Iwahashi T. szérum anticerebelláris antitestek kimutatása Miller Fisher-szindrómás betegeknél. Euro J Neurol. 1999:42:230-4.
15. Barontini F, Di Lollo S, Maurri S, Lambruschini P. a kóros folyamat lokalizálása Miller Fisher-szindrómában. Olaszország J Neurol Sci. 1992:13:221-5.
16. Koga M, Yuki N, Takahashi M, et al. A Guillain-Barré-és Fisher-szindrómában az IgA anti-gangliozid antitestek és az azt megelőző Campylobacter jejuni fertőzés szoros összefüggése. J Neuroimmunol. 2003:141:112-7.
17. Guiloff RJ. Perifériás idegvezetés Miller Fisher-szindrómában. J Neurol Neurosurg Pszichiat. 1977:40:801-7.
18. Chikakiya H, Kunishige M, Yoshino H, et al. Késleltetett motoros és szenzoros neuropathia agytörzsi encephalitisben szenvedő betegeknél. J Neurol Sci. 2005:234:105-8.
19. Arakata Y, Josimuro M, Kobayashi S, et al. Intravénás immunglobulin alkalmazása Miller Fisher-szindrómában. Brain Develop J. 1993: 15:231-3.
20. Matsumoto H, Kobayashi O, Tamura K, et al. Miller Fisher szindróma átmeneti kómával: összehasonlítás bickerstaff agytörzsi encephalitisével. Brain Develop J. 2002: 24: 98-101.
21. Yeh JH, Chen WH, Chen JR, et al. Miller Fisher szindróma központi részvétellel: sikeres kezelés plazmaferezissel. Thérap Aferézis Dialízis J. 1999:3: 69-71.
22. Papanikolaou T, Kath G, Boothman B, et al. Esetjelentés: akut kétoldali ophthalmoparesis a pupilary areflexical mydriasis Miller-Fisher-szindrómában, intravénás immunglobulinnal kezelve. J Ophthalmol. 2010; Cikkszám: 291840.
23. Sandler RD, Hoggard N, Hadjivassiliou M. Miller-Fisher szindróma: az ataxia központi vagy perifériás? Cerebellum Ataxias. 2015:2:3.
24. Ejma M, Waliszewska-Prosół M, Hofman A, et al. Progresszív szubakut Miller-fisher szindróma sikeresen kezelt plazmaferezis. Lengyel J Neurol Idegsebész. 2015;49(2):137-8.
25. San-Juan OD, Martínez-Herrera JF, Moreno García J, et al. Miller Fisher szindróma: 10 éves tapasztalat egy harmadik szintű központban. Euro Neurol. 2009; 62:149-54
26. Snyder LA, Rismondo V, Molnár sz. A Guillain-Barré-szindróma Fisher változata (Fisher-szindróma). J Neuroophthalmol. 2009 december;29(4): 312-24.
27. Ito M, Kuwabara S, Odaka M, et al. A Bickerstaff agyvelőgyulladása és a fisher-szindróma folyamatos spektrumot alkot: 581 eset klinikai elemzése. J Neurol. 2008;255:674-82.
28. Yuki N. az IgG anti-GQ1b antitesthez kapcsolódó extraokuláris izmok akut parézise. Ann Neurol 1996;39: 668-72.