az aminok és pKaH Bázicitása
az aminok Bázicitását számszerűsítve, “a konjugált sav pKa-ja”, más néven “pKaH”
hogyan méri az amin alaposságát? Ebben az esetben: mi az erősebb bázis: piridin vagy piperidin?
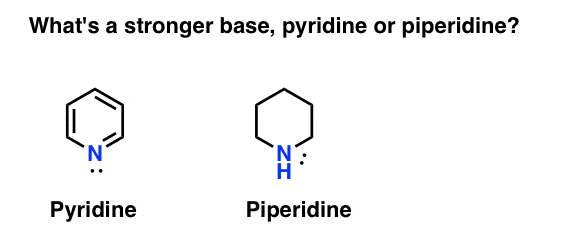
Ha azt mondta piperidin, gratulálok-ez valóban erősebb bázis.
de miért? És mennyivel erősebb? Hogyan lehet megpróbálni válaszolni ezekre a kérdésekre? Végül is könnyen összehasonlíthatjuk a savak erejét a pKa-k vizsgálatával. nem kellene ugyanezt tennünk a bázisokkal?
Igen, bizonyos értelemben. Itt van két kulcsfontosságú pont a mai napra:
- az amin alaposságának számszerűsítésének legjobb módja a konjugált sav pKa-jának vizsgálata.
- minél magasabb a konjugált sav pKa-ja, annál erősebb az alap.
ebben a bejegyzésben néhány konkrét példát mutatunk be arról, hogyan lehet a PKA értékeket használni az aminok alaposságának összehasonlításához.
egy későbbi bejegyzésben ezután feltárunk néhány kulcsfontosságú tendenciát, amelyek az aminok alapossága mögött állnak.
Tartalomjegyzék
- gyors áttekintés: Savak, bázisok, konjugált savak és konjugált bázisok
- a PKA használata a savasság mérésére
- a pKa használata az amin alaposságának számszerűsítésére
- a “konjugált sav pKa” rövidíthető “pKaH”
- a pKaH használatával az amin relatív alapjainak meghatározásához
- néhány szó az aminok PKA-értékeire vonatkozó óvatosság
- milyen kulcsfontosságú tényezők szabályozzák az aminok alaposságát?
- Megjegyzések
1. Gyors Áttekintés: Savak, bázisok, konjugált savak és konjugált bázisok
először is, gyorsan áttekintjük a bázikusság alapjait.
minden sav-bázis reakcióban négy szereplő van.
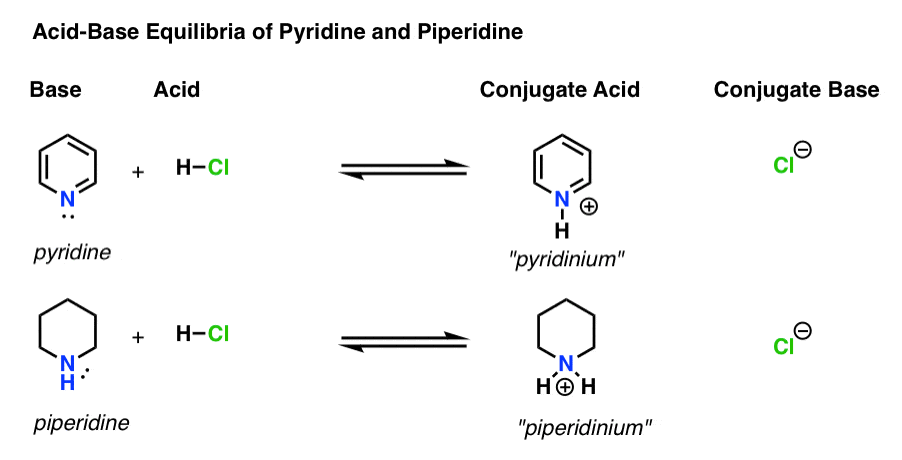
- a bázis az a faj, amely egy magányos párot adományoz a H+ – nak (más néven “proton” vagy “hidrogénmag”). Ez az, ahol az új bond H formák (pl. piridin, alább)
- A konjugált sav a fajok eredmények után a bázis alkot egy bond H (pl. “piridinium” , amely egy új, N–H kötés)
- A sav a faj, amely elveszíti H+ . Ez az, ahol a kötés h megtöri (pl. H-Cl)
- a konjugált bázis az a faj, amely azután marad meg, hogy a sav h+-t adományoz a bázisnak (pl. Cl -)
itt a piridin és a piperidin. Ha követi a kötéseket, amelyek kialakulnak és megtörnek, akkor minden színészt azonosíthat.
2. A savasság mérésére szolgáló PKA használata
minden sav-bázis reakció egy előre-hátra reakció egyensúlyaként írható le. Láttuk, hogy a savasság állandó, Ka, egy olyan intézkedés, hogy milyen könnyen egy faj disszociál, hogy H + és a konjugált bázis.
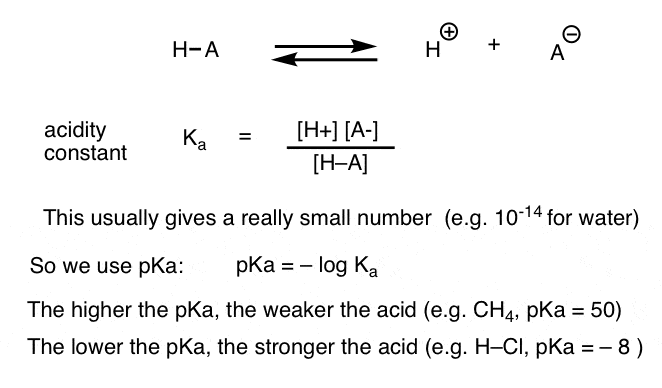
a kényelem, használjuk a negatív log Ka, az úgynevezett PKA, amely hasonló az ismerős pH-skála, de túlnyúlhat 14 Mert ez nem szigorúan korlátozódik a vizes oldószer. a PKA–értékek a nagyon erős savak (pl. hidroiódsav, h-I) esetében -10-től 50-ig terjednek bizonyos szénhidrogének (pl. etán) esetében.
hogyan alkalmazhatjuk ezeket a fogalmakat a bázikusság mérésére? Nem tudnánk megváltoztatni a dolgokat, és definiálni egy kifejezést, Kb, ami az egyensúly, hogy egy faj mennyire könnyen kombinálható a H+ – val , definiálni a PKB-t negatív naplóként, és összehasonlítani a bázisokat a pKb értékeik alapján?
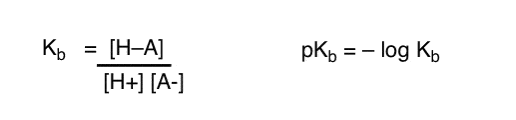
Igen… megtehetjük. Azt hiszem. Ha muszáj. De általában a szerves vegyészek véleménye erről a témáról “csavaros pKb”.
végül is a PKA értékeket több ezer szerves molekulára mérték. Valaki tényleg azt akarja, hogy emlékezzen egy hatalmas pKb értékekre is? Pokol nem!
ehelyett könnyen használhatjuk a PKA értékeket a bázikusság közvetett méréseként. Itt van, hogyan.
3. A PKA értékek számszerűsítésére alapossága Amines
felidézni ezt a két halhatatlan sor próza, érdemes szavalni magadnak éjjel:
- minél erősebb a sav, annál gyengébb a konjugált bázis.
- minél gyengébb a sav, annál erősebb a konjugált bázis.
a piridin konjugált savjának (“piridinium”) pKa-ját mérték. Körülbelül 5,2 .
a piperidin konjugált savjának pKa-értéke is van. Körülbelül 11 .
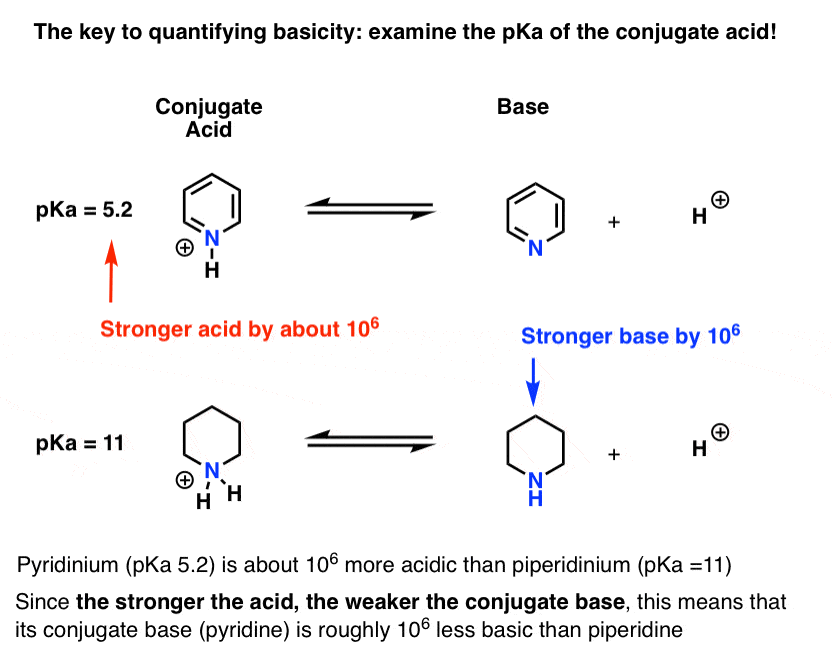
ezekből PKA értékek, azt lehet mondani, hogy a konjugált sav piridin erősebb, mint a konjugált sav piperidin körülbelül 6 pKa egység. Mivel minden PKA Egység 10-es tényezőt jelent, ez körülbelül 1 millió tényező.
mivel “minél erősebb a sav, annál gyengébb a konjugált bázis”, a piridin ezért gyengébb bázis, mint a piperidin 1 millió tényezővel.
4. “A konjugált sav pKa “rövidítése” pKaH ”
a kifejezés, “a konjugált sav pKa” egy kicsit egy falat, amelyet rendszeresen használni kell. Mivel természetesen lusta, szeretnénk egy kicsit kondenzálni ezt a közös használat érdekében.
mivel egy bázis konjugált savja (“B”) “BH”, rövidíthetjük “egy bázis konjugált savjának pKa-ját” pKaH-ként.
Ez azt jelenti, hogy a piridin pKaH-ja 5,2, a piperidin pKaH-ja pedig 11.
ezután áshatunk a szakirodalomba, hogy más alapokat találjunk, amelyekhez összehasonlíthatjuk.
például, hogy pontosan milyen alapvető az ammónia (NH3) ? Az ammónia konjugált savja, az NH4 (+) 9,2 . Ekvivalensen azt mondhatjuk, hogy az ammónia pkahja 9,2. Ez a piridin és a piperidin közé helyezi a bázikussági skálán.
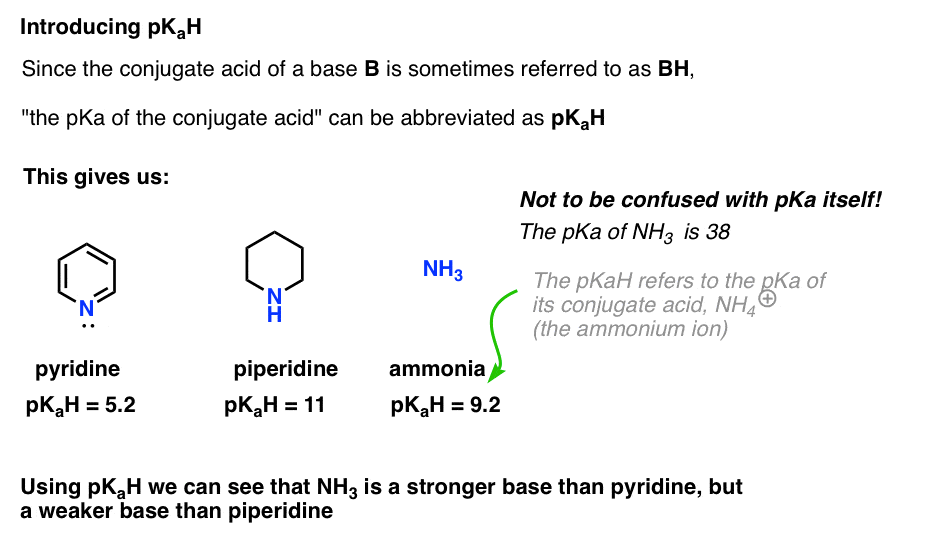
vegye figyelembe, hogy nagyon fontos, hogy ne keverjük össze a pKaH-t a pKa-val. Az ammónia pkahja 9,2, amely konjugált savának savasságát méri, NH4 (+).
maga az ammónia pKa 38, amely az NH3 disszociációjához szükséges egyensúlyi állandót méri, hogy konjugált bázisát, az NH2(-) és a H+ – ot adja.
Ez azt jelenti, hogy a 38 Az amidion NH2 (–) pkahja, amellyel korábban találkozhatott, mint az erős bázis (NaNH2), amelyet a deprotonát terminális alkinekhez használtak (pKa =25). A pKaH használatával megállapíthatjuk, hogy az NH2 (–) körülbelül (38 – 9) = 29 nagyságrenddel alaposabb, mint az NH3 !
5. Nagyon hasznos trükk a Pkah használata az Amines
relatív alapjainak meghatározásához a pkah használatával a bázisok relatív erősségeinek meghatározásához.
íme néhány reprezentatív példa a nitrogéntartalmú molekulákra. Az alábbiakban a konjugált savak pKa-ja található.
mi itt a legerősebb bázis? Mi a leggyengébb?
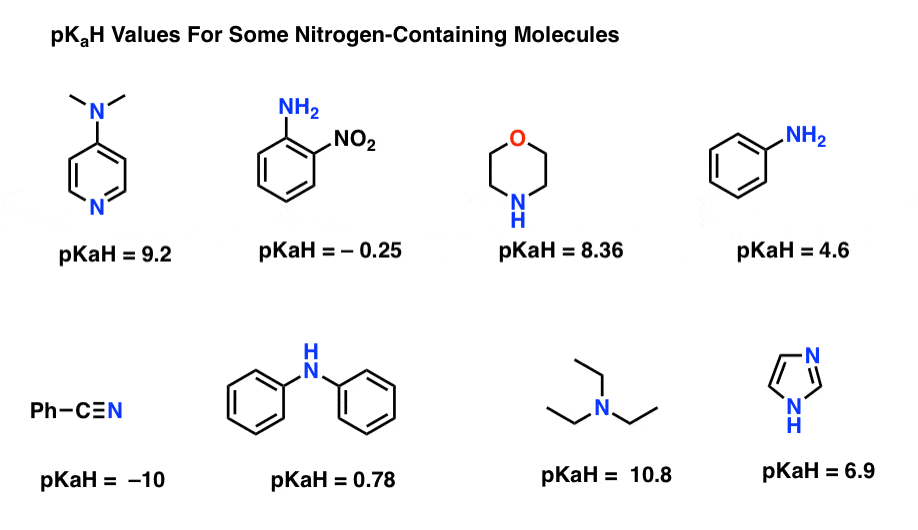
a legalacsonyabb pKaH érték itt -10 a nitril (bal alsó). Ez azt jelenti, hogy a nitril a legkevésbé alapvető ezen molekulák közül.
a legmagasabb pKaH érték itt 10, 8 a trietilamin esetében. Ez teszi trietilamin a legerősebb bázist az összes felsorolt.
néhány óvatossági szó az Amines PKA értékeiről
két dolgot kell figyelni, különösen, ha más online forrásokat olvasunk ebben a témában.
először , néha az aminok pKaH értékeit PKA értékekként jelentik, magyarázat nélkül. A legjobb PKA asztalok ezt nem teszik meg, de nehéz a búzát a pelyvából rendezni, amikor éppen elindul.
ha rendellenesen alacsony pKa értéket lát egy amin esetében, akkor valószínűleg a konjugált sav pKaH-jára utal.
például itt van egy PKA táblázat, ahol a metilamin (CH3NH2) pKa-ja 10, 63.
Ez alacsony. Remélhetőleg ezen a ponton, egy ilyen érték 10 egy amin pKa-jának furcsanak kell lennie, különösen mivel a szorosan kapcsolódó NH3 pKa-ja 38.
a 10,63-as érték valójában a metil-amin konjugált savának pKa-jára utal, nem pedig a metilaminra. Ez egy pKaH érték.
hasonlóképpen, ugyanez a táblázat a trimetil-amin 9, 8-as pKa-val rendelkezik . Ismét ez valójában a pKaH. Nem találok tényleges PKA értéket a trimetilamin esetében, de azt hiszem, hogy >40, mivel a trimetilamin konjugált alapja a karbanion (CH3)2N–CH2 (–))).
a második, kevésbé gyakori zavarforrás az, hogy néha az amin pKaH-ját pKb-ként jelentik, például ebben a táblázatban, amely az NH3 pKb-jét 9.2-ként jelenti . Ez pontatlan.
ismét a pKb értékek nem igazán jönnek létre az egyetemi szerves kémiában, bár azt mondják, hogy néha megjelennek a DAT/MCAT-on.
7. Milyen Kulcsfontosságú Tényezők Szabályozzák Az Aminok Alaposságát?
most, hogy legalább megtanultuk, hogyan kell számszerűsíteni és értelmezni az aminok és konjugált savaik pKa-értékét, elkezdhetjük feltenni a kulcskérdést: miért? Milyen kulcsfontosságú tényezők szabályozzák az aminok alaposságát? Melyek a fontos trendek?
például miért gyengébb a piridin bázis, mint a piperidin? Miért vannak a nitrilek még gyengébb bázisok? Miért hajlamosak az elektronkivonó csoportok az aminokat gyengébb bázisokká tenni?
a jó hír az, hogy ha már megérti a savasságot szabályozó tényezőket, akkor egyszerűen ugyanazokat az elveket kell alkalmaznia – de fordítva!
ezt a következő bejegyzésben fedjük le. Öt tényező befolyásolja az amin alaposságát
Megjegyzések
1. lábjegyzet. Sok sav van, amelyek nem bázisok (például NH4, amely hiányzik egy magányos pár) és sok bázisok, amelyek nem savak, mint például a Cl (-), amely képtelen elfogadni egy magányos pár. Ezért, mondván: “minél erősebb a sav, annál gyengébb az alap”, rossz.
2. lábjegyzet. Ez a víz oldószerként történő alkalmazásával kapott mérés. Előfordulhat, hogy egy másik értéket, 3.4-et lát, amelyet akkor kapunk, ha dimetil-szulfoxidot (DMSO) használunk oldószerként. Lásd: Bordwell PKA Tables (DMSO)