Alacsony-Feszültség Glaukóma: Oximoron Szemészet
Ciro Costagliola, MD1; Luca Agnifili, MD, PhD2; Leonardo Mastropasqua, MD2; Alfonso di Costanzo, MD1 (Nézet szerző kapcsolatok)
azt Javasolta, hivatkozás, ez a cikk: Costagliola C, Agnifili L, Mastropasqua L, di Costanzo A. Alacsony-Feszültség Glaukóma: Oximoron a Szemészet. Előző Krónikus Dis 2019;16: 180534. DOI: http://dx.doi.org/10.5888/pcd16.180534external ikon.
a glaukóma kifejezés a látóideg progresszív károsodása és a látótér elvesztése (1) által jellemzett szemészeti állapotok csoportjára utal. A glaukómás optikai neuropathia a retina ganglionsejtek progresszív elvesztésének köszönhető; az emelkedett intraokuláris nyomás (IOP) az egyik fő kockázati tényező. Az IOP közvetlenül, mechanikai hatással vagy közvetve, a vérellátás befolyásolásával járhat el (2). A glaukómás optikai neuropathia progresszióját befolyásoló tényezők közé tartozik az idősebb életkor, a betegség előrehaladott stádiuma, a magasabb IOP és a lemezvérzések (3). Az elsődleges nyílt zugú glaukómában (POAG) szenvedő betegeknél a trabekuláris meshwork-en keresztül a vizes kiáramlással szembeni fokozott ellenállás a megnövekedett IOP fő bűnösje. Az IOP megfelelő kontrollja ellenére azonban a glaucomatous optic neuropathia gyakran tovább fejlődhet. Így felismerik az IOP-hoz nem kapcsolódó tényezőket, amelyek közül a legfontosabb a látóideg vérellátásának csökkenése (4).
Az IOP-val nem összefüggő egyéb tényezők közé tartozik a glutamát toxicitás, az oxidatív stressz, az autoimmunitás és az érrendszeri diszreguláció (3). Az alacsony feszültségű glaukóma (LTG) a glaukóma olyan formája, amely szorosan utánozza a POAG-ot, de az IOP-szintek a normál tartományon belül vannak, és a valószínű patogenezis érrendszeri.
az ellentmondásos kérdések 1) az LTG egy betegség a POAG spektrumán (az IOP eloszlásának bal oldalán, a legalacsonyabb szinten)?, 2) a látóideg megjelenése másodlagos a látóideg hypoperfusion miatt érrendszeri betegségek? vagy 3) az LTG-t fel kell venni a veleszületett és szerzett optikai neuropátiák azon spektrumába, amely képes glaukómás optikai neuropathiát szimulálni?
Top
az alacsony feszültségű glaukóma betegség az elsődleges nyílt zugú glaukóma spektrumán?
Amikor 1857-ben Albrecht von Graefe leírt formában a glaukóma megnyilvánuló kár, hogy a látóideg fejét egy nyitott elülső kamra szög, a SZEMBELNYOMÁS belül a referencia tartomány, digitális tapintása tonometria tartották a gold standard. Ha impressziós tonométert használt volna az IOP mérésére, akkor a tonometria fő hiányossága az lett volna, hogy a szemmel való érintkezés során annyi folyadékot váltott ki, hogy a mért értékek nagyon változóak és pontatlanok lennének. Ezzel szemben, ha behúzott tonometriát használt volna, akkor nem vette volna figyelembe a vékony központi szaruhártya (1) jelenlétéből eredő téves besorolást. Az LTG számos diagnózisa vékony szaruhártyájú szemekre vonatkozott, és az IOP hamis alacsony értékein alapultak, ami kétségeket vet fel az LTG (5) diagnózisával kapcsolatban. Továbbá, az emelkedett IOP hiányát a több alkalommal vagy napközben végzett méréseken kell kimutatni, mivel az IOP egészséges egyénekben napi és éjszakai ingadozást mutat, míg POAG-ban vagy LTG-ben szenvedő betegeknél (6). Az IOP variációiban az LTG-betegek 3 populációja különböztethető meg: IOP-ingadozás nélküli betegek, napi IOP-akrofázos betegek (a ciklus gerince vagy csúcsa), valamint éjszakai IOP-akrofázos betegek (7). A 2 utolsó kategóriába tartozó betegeket az LTG-betegek helyett valódi POAG-betegeknek kell tekinteni, akiknél a glaucomatous optic neuropathia a normál IOP ellenére jelentkezik. Valószínű, hogy napi vagy éjszakai akrofázban szenvedő betegeket vontak be a mechanikai elméleten alapuló vizsgálatokba; az IOP csökkentése csak ezeknél a betegeknél lassíthatja a látótér elvesztésének progresszióját (8). Az adatokat az Alacsony Nyomású Zöldhályog Tanulmány kiemelt a szerepe IOP az LTG patogenezisében; a progresszió a látótér veszteség csökkent 9.1% a timolol 0,5% – os, valamint a 39.1% – os brimonidine 0.2% 2 év után a kezelés (8). Ebben a tanulmányban azonban az IOP értékeket kizárólag napközben rögzítették. Ezért nem ismert, hogy a rosszabb látómezővel rendelkező betegek IOP éjszakai akrofázzal rendelkeztek-e. Az aszimmetrikus LTG-vel kapcsolatos egyéb vizsgálatok azt mutatták, hogy a magasabb IOP-val rendelkező szem nagyobb glaukómás károsodást mutat, mint az alsó IOP-val rendelkező szem, amely fenntartja az IOP szerepét a patogenezisben (9). Mindazonáltal ezekben a klinikai vizsgálatokban az IOP-t csak a munkaidőben mérték; így az éjszakai IOP viselkedését nem rögzítették. Egy nemrégiben készült tanulmány, amelyben a nychthemeral IOP görbéket telemetrikus érzékelővel értékelték, éjszakai akrofázt mutatott IOP tüskékkel az LTG-ben szenvedő betegeknél, bár ezek a tüskék szignifikánsan alacsonyabbak voltak, mint a POAG-ban szenvedő betegek körében talált tüskék (7). Ez a vizsgálat arról számolt be, hogy az IOP a normál feszültségű glaukómában szenvedő betegek 40-80%-ánál tetőzött éjszaka, és ezekben a betegekben a minta hasonló volt a POAG-ban szenvedő betegek mintájához. A 24 órás görbékben az LTG-ben és a POAG-ban szenvedő betegeknél az IOP-ban sokkal kifejezettebb mintázatok voltak este és éjszaka, mint reggel, több csúcs és nagyobb IOP-ingadozás volt az éjszaka folyamán, mint az esti órákban (7). Más tényezők is alátámaszthatják az LTG-ben az elsődleges IOP-hoz kapcsolódó mechanikai stressz hipotézisét, például a POAG-ban (10) bekövetkező változásokhoz hasonló vizes humoros kiáramlási útvonalakban bekövetkező változások jelenlétét.
azoknál a betegeknél, akiknél az LTG a POAG spektrumában betegségnek tekinthető, szemész szakorvos (ábra) segítségével a hiperbár glaukómában szenvedő betegekhez hasonló diagnosztikai és terápiás stratégiákat kell végrehajtani.
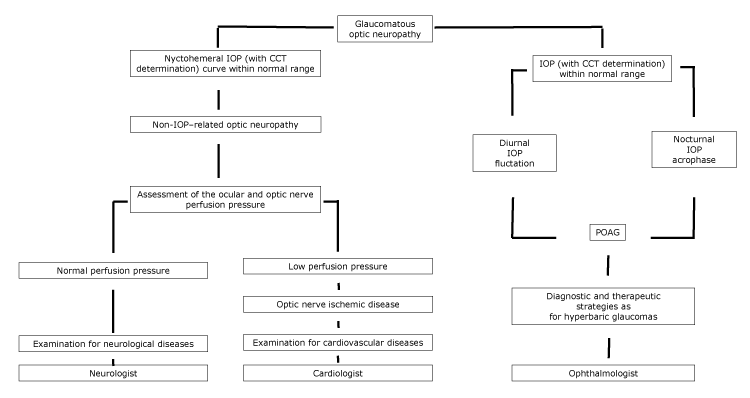
ábra.
javasolt folyamatábra optikai neuropathia, szakorvosi áttétel szerint a nychthemeral IOP jellemzői. Rövidítések: CCT, központi szaruhártya vastagsága; IOP, intraokuláris nyomás; POAG, elsődleges nyitott zugú glaukóma.
Top
A látóideg megjelenése másodlagos a látóideg Hypoperfusion miatt érrendszeri betegségek?
LTG-ben és normál nychthemeralis IOP-görbékben szenvedő betegeknél a mechanikai tényezők nem felelősek az optikai neuropátiáért; nyomásfüggetlen tényezők is szerepet játszhatnak, az érrendszeri változások potenciálisan a legfontosabbak (5). Glaukómás-szerű optikai neuropathia figyelhető meg olyan betegeknél, akiknek kórtörténetében kardiovaszkuláris esemény vagy krónikus ateroszklerózis vagy obstruktív artériás betegség szerepel (11). LTG-ben (5) szenvedő betegeknél csökkent véráramlást figyeltek meg a retrobulbar artériákban és az agyi keringésben, alacsony diasztolés vérnyomást és kisebb központi retina érátmérőt. Ezeknél a betegeknél a betegség patogenezise a csökkent szem perfúziós nyomásnak köszönhető, amely elsősorban az elsődleges érrendszeri diszregulációhoz vagy az endotheliális vagy autonóm idegrendszer generalizált diszfunkciójához kapcsolódik (5,11). Nem világos azonban, hogy ezek a tényezők voltak-e az optikai neuropathia oka vagy eredménye. Klinikai szempontból az LTG a korongvérzések magasabb előfordulását mutatja, és gyakrabban kapcsolódik érrendszeri betegségekhez, például migrénhez, obstruktív alvási apnoéhoz vagy Raynaud-szindrómához, mint az IOP-hoz (5). Végül a perimetriás betegségben szenvedő LTG-betegek körülbelül fele a normál IOP-értékek ellenére (12) károsodás progresszióját mutatja. Mindezek a megállapítások arra utalnak, hogy az érrendszeri diszreguláció fontos szerepet játszik.
cardiovascularis betegségben szenvedő betegek esetében előfordulhat, hogy az optikai korong köpölyözés nem halad előre, ha az optikai neuropathia kiváltó oka kontrollált. Ezenkívül az LTG-betegek cirkumpapilláris atrófiát, valamint agyi kortikális mikroinfarktust mutathatnak, amelyek az ischaemia jelei (5). Azoknál a betegeknél, akiknél az érrendszeri betegségek látóideg-hipoperfúziót okoznak, kardiovaszkuláris betegségekre vonatkozó teljes diagnosztikai vizsgálatot kell végezni kardiológus (ábra) segítségével.
Top
az LTG-t fel kell venni a veleszületett és szerzett optikai neuropátiák azon spektrumába, amely képes glaukómás optikai neuropathiát szimulálni?
Ha az optikai korong köpölyözés gyakoribb okait kizárták, fontolóra kell venni a neurodegeneratív optikai neuropathia lehetőségét. Ezek az esetek a leginkább frusztrálóak, mivel az optikai lemez károsodása még az IOP csökkentése után is előrehalad. Ebben az esetcsoportban számos veleszületett és szerzett optikai neuropátia található, és a glaukómás és nonglaucomatous köpölyözés közötti különbségtétel még a tapasztalt megfigyelők számára is kihívást jelenthet (13). Az optikai korongok veleszületett formái közül a megalopapilla, az autoszomális domináns optikai atrófia és a Leber örökletes optikai neuropathia glaukómás optikai neuropathiát szimuláló optikai korongot hozhat létre.
a szerzett neuropátiák lehetnek másodlagos gyulladásos, nyomó, toxikus és traumás okok miatt. Az optikai ideggyulladás növelheti a csésze-lemez arány növekedését, amely bár egyoldalú, összetéveszthető a glaukómás optikai neuropátiával. Összenyomó elváltozások-beleértve a foster, hypophysis adenoma, craniopharyngioma, illetve a belső carotis aneurysma vezethet aszimmetrikus optikai lemez köpölyözés, illetve tévesen tulajdonított LTG. A metanol és az etambutol mérgezés a glaukómás optikai neuropathiához hasonló kétoldali optikai lemezt eredményezhet, ami az axonális veszteség következménye. Így, ha aszimmetrikus megnagyobbodott csészét észlelünk, további neuro-szemészeti vizsgálatra van szükség (13).
végül, az optikai lemez köpölyözéséhez vezető körülmények között az öregedésnek fő szerepe van. Harju et al megállapította, hogy a mértéke optikai lemez köpölyözés nőtt az egészséges idősebb vizsgálatban résztvevők, mert a fiziológiai rost veszteség. A vizsgálat során a lakosság megfelelő képviselte egy sor egészséges szemek nélkül glaukóma; egész a 11 éves utánkövetés nem vizsgálatban résztvevők fejlett vizuális mező megváltozik, de nem jelentős emelkedése IOP rögzítették (14). Ebben az utóbbi esetben a neurológiai betegségek teljes diagnosztikai vizsgálatát neurológus (ábra) segítségével kell elvégezni.
a diagnosztikai technikák javulása megkönnyíti a látóideg köpölyözés osztályozását, a látóideg jellemzőinek leírása a retinális idegrostréteg képalkotásával és a látóideg topográfiájával kombinálva lehetővé teszi a glaukómás és a nonglaucomatous optikai lemez köpölyözés közötti differenciálódást. Ezenkívül a kórtörténet gondos elemzése, valamint a látóideg morfológiai és funkcionális értékelése segít a rendellenességek azonosításában.
az LTG kifejezés lehet oximoron, a múlt nosztalgikus emléke, amikor egy meghatározott diagnózis nem volt lehetséges. A kifejezés használata olyan, mint a “láz” szó használata, ha nincs magas hőmérséklet vagy festina Lente (“több sietség, kevesebb sebesség”). Az LTG kifejezés félrevezető vagy pontatlan lehet, mivel az IOP mechanikai problémájára utal, míg az optikai korong köpölyözés és a normál intraokuláris nyomású szem látótérvesztése más tényezők által okozott. Ezért a normál IOP-val ellátott optikai lemez jelenlétében a szemészeknek az intraokuláris nyomás mellett meg kell vizsgálniuk a látóideg károsodásának egyéb valószínű okait is.
Top
Ez a tanulmány nem kapott külön támogatást egyetlen állami, kereskedelmi vagy nonprofit szektorbeli finanszírozási ügynökségtől sem.
Top
szerzői információk
megfelelő Szerző: Luca Agnifili, MD, PhD, Szemészeti Klinika, Via Dei Vestini, 66100, Chieti (CH), Olaszország. Telefon: + 39-0871-358489. E-mail: [email protected].
szerzői kapcsolatok: 1department of Medicine and Health Sciences, University of Molise, Campobasso, Olaszország. 2department of Medicine and Aging Science, Ophthalmology Clinic, University G. d’Annunzio of Chieti-Pescara, Chieti, Italy.
Top
- Coleman AL, Miglior S. Risk factors for glaucoma onset and progression. Surv Ophthalmol 2008;53(6, Suppl):S3–10. CrossRefexternal icon PubMedexternal icon
- Costagliola C, dell’Omo R, Romano MR, Rinaldi M, Zeppa L, Parmeggiani F. Pharmacotherapy of intraocular pressure: part I. Parasympathomimetic, sympathomimetic and sympatholytics. Expert Opin Pharmacother 2009;10(16):2663–77. CrossRefexternal icon PubMedexternal icon
- Weinreb RN, Aung T, Medeiros FA. The pathophysiology and treatment of glaucoma: a review. JAMA 2014;311(18):1901–11. CrossRefexternal icon PubMedexternal icon
- Cherecheanu AP, Garhofer G, Schmidl D, Werkmeister R, Schmetterer L. Ocular perfusion pressure and ocular blood flow in glaucoma. Curr Opin Pharmacol 2013;13(1):36–42. CrossRefexternal icon PubMedexternal icon
- Mastropasqua R, Fasanella V, Agnifili L, Fresina M, Di Staso S, Di Gregorio A, et al. Advance in the pathogenesis and treatment of normal-tension glaucoma. Prog Brain Res 2015;221:213–32. CrossRefexternal icon PubMedexternal icon
- Moon Y, Lee JY, Jeong DW, Kim S, Han S, Kook MS. Relationship between nocturnal intraocular pressure elevation and diurnal intraocular pressure level in normal-tension glaucoma patients. Invest Ophthalmol Vis Sci 2015;56(9):5271–9. CrossRefexternal icon PubMedexternal icon
- Agnifili L, Mastropasqua R, Frezzotti P, Fasanella V, Motolese I, Pedrotti E, et al. Circadian intraocular pressure patterns in healthy subjects, primary open angle and normal tension glaucoma patients with a contact lens sensor. Acta Ophthalmol 2015;93(1):e14–21. CrossRefexternal icon PubMedexternal icon
- De Moraes CG, Liebmann JM, Greenfield DS, Gardiner SK, Ritch R, Krupin T; alacsony nyomású glaukóma kezelési csoport. Az alacsony nyomású glaukóma kezelési vizsgálatban a látótér progressziójának kockázati tényezői. Am J Szemészeti 2012;154(4): 702-11. CrossRefexternal icon PubMedexternal icon
- Cartwright MJ, Anderson Dr. az aszimmetrikus károsodás korrelációja aszimmetrikus intraokuláris nyomással normál feszültségű glaukómában (alacsony feszültségű glaukóma). Arch Oftalmol 1988;106 (7): 898-900. CrossRefexternal icon PubMedexternal icon
- Agnifili L, Carpineto P, Fasanella V, Mastropasqua R, Zappacosta A, Di Staso S, et al. Conjunctival findings in hyperbaric and low-tension glaucoma: an in vivo confocal microscopy study. Acta Ophthalmol 2012;90(2):e132–7. CrossRefexternal icon PubMedexternal icon
- Hayreh SS, Jonas JB. Appearance of the optic disk and retinal nerve fiber layer in atherosclerosis and arterial hypertension: an experimental study in rhesus monkeys. Am J Ophthalmol 2000;130(1):91–6. CrossRefexternal icon PubMedexternal icon
- Collaborative Normal-Tension Glaucoma Study Group. Comparison of glaucomatous progression between untreated patients with normal-tension glaucoma and patients with therapeutically reduced intraocular pressures. Am J Ophthalmol 1998;126(4):487–97. CrossRefexternal icon PubMedexternal icon
- Fraser CL, White AJ, Plant GT, Martin KR. Optic nerve cupping and the neuro-ophthalmologist. J Neuroophthalmol 2013;33(4):377–89. PubMedexternal icon
- Harju M, Kurvinen L, Saari J, Vesti E. Change in optic nerve head topography in healthy volunteers: an 11-year follow-up. Br J Ophthalmol 2011;95(6):818–21. CrossRefexternal icon PubMedexternal icon
Top