Glaucoma de Baja Tensión: Un Oxímoron en Oftalmología
Ciro Costagliola, MD1; Luca Agnifili, MD, PhD2; Leonardo Mastropasqua, MD2; Alfonso di Costanzo, MD1 (Ver afiliaciones de autores)
Cita sugerida para este artículo: Costagliola C, Agnifili L, Mastropasqua L, di Costanzo A. Glaucoma de baja tensión: Un Oxímoron en Oftalmología. Anterior Chronic Dis 2019; 16: 180534. DOI:http://dx.doi.org/10.5888/pcd16.180534external icono.
El término glaucoma se refiere a un grupo de afecciones oculares caracterizadas por daño progresivo del nervio óptico y pérdida del campo visual (1). La neuropatía óptica glaucomatosa se debe a la pérdida progresiva de células ganglionares de la retina; la presión intraocular elevada (PIO) es un factor de riesgo importante. La PIO puede actuar directamente, por un efecto mecánico, o indirectamente, influyendo en el suministro de sangre (2). Los factores que influyen en la progresión de la neuropatía óptica glaucomatosa incluyen la edad avanzada, el estadio avanzado de la enfermedad, una PIO más alta y hemorragias discales (3). En pacientes con glaucoma de ángulo abierto primario (GOP), el aumento de la resistencia a la salida acuosa a través de la malla trabecular es el principal culpable de la PIO elevada. Sin embargo, a pesar del control adecuado de la PIO, la neuropatía óptica glaucomatosa puede continuar progresando con frecuencia. Así, se reconocen factores no relacionados con la PIO, siendo el más importante la disminución del suministro de sangre al nervio óptico (4).
Otros factores no relacionados con la PIO incluyen toxicidad por glutamato, estrés oxidativo, autoinmunidad y desregulación vascular (3). El glaucoma de baja tensión (LTG) se define como una forma de glaucoma que imita de cerca la GOP, pero los niveles de PIO están dentro del rango normal y la patogénesis probable es vascular.
Las preguntas controvertidas son 1) ¿es la LTG una enfermedad en el espectro de la GOP (en el lado izquierdo de la distribución de la PIO, en los niveles más bajos)?, 2) ¿la apariencia del disco óptico es secundaria a la hipoperfusión del nervio óptico debido a enfermedades vasculares?, o 3) ¿se debe incluir la LTG en un espectro de neuropatías ópticas congénitas y adquiridas que puedan simular neuropatía óptica glaucomatosa?
Top
¿El Glaucoma de Baja Tensión es una Enfermedad en el Espectro del Glaucoma Primario de Ángulo Abierto?
Cuando en 1857 Albrecht von Graefe describió una forma de glaucoma que manifestaba daño en la cabeza del nervio óptico y un ángulo de cámara anterior abierto, con la PIO dentro del rango de referencia, la tonometría digital de palpación se consideró el estándar de oro. Si hubiera utilizado un tonómetro de impresión para medir la PIO, la principal deficiencia de la tonometría habría sido que desplazó tanto líquido al contacto con el ojo que las lecturas medidas serían altamente variables e inexactas. Por el contrario, si hubiera utilizado tonometría de indentación, no habría considerado la clasificación errónea resultante de la presencia de una córnea central delgada (1). Muchos diagnósticos de LTG fueron para ojos con córneas delgadas y se basaron en valores bajos falsos de PIO, un hallazgo que arroja algunas dudas sobre el diagnóstico de LTG (5). Además, la ausencia de PIO elevada se debe encontrar en mediciones realizadas más de una vez o durante el día, ya que la PIO muestra fluctuaciones diurnas y nocturnas en sujetos sanos, y aún más en pacientes con GOP o LTG (6). Para las variaciones de la PIO, se pueden distinguir 3 poblaciones de pacientes con GL: pacientes sin fluctuaciones de la PIO, pacientes con acrofasa diurna de la PIO (cresta o pico de un ciclo) y pacientes con acrofasa nocturna de la PIO (7). Los pacientes de las 2 últimas categorías se deben considerar pacientes con GOP verdadera en lugar de pacientes con GL, en los que se produce neuropatía óptica glaucomatosa a pesar de la PIO normal. Es probable que los pacientes con una acrofase diurna o nocturna se hayan inscrito en estudios basados en la teoría mecánica; la reducción de la PIO podría ralentizar la progresión de la pérdida del campo visual solo en estos pacientes (8). Los datos del Estudio de Tratamiento del Glaucoma de Baja Presión destacaron el papel de la PIO en la patogénesis de la GL; la progresión de la pérdida del campo visual se redujo en un 9,1% con timolol 0,5% y en un 39,1% con brimonidina 0,2% después de 2 años de tratamiento (8). Sin embargo, en este estudio, los valores de PIO se registraron exclusivamente durante el día. Por lo tanto, se desconoce si los pacientes con un campo visual peor tenían acrofasa nocturna de la PIO. Otros estudios sobre LTG asimétrica informaron que el ojo con PIO más alto muestra mayor daño glaucomatoso que el ojo con PIO más bajo, lo que sostiene el papel de la PIO en la patogénesis (9). Sin embargo, en todos estos ensayos clínicos, la PIO se midió solo durante las horas de oficina; por lo tanto, no se registró el comportamiento de la PIO nocturna. Un estudio reciente en el que se evaluaron las curvas de la PIO en la NIC con un sensor telemétrico mostró una acrofase nocturna con picos de PIO en pacientes con LTG, aunque estos picos se encontraban en niveles significativamente más bajos que los picos encontrados en pacientes con GOP (7). Este estudio informó que la PIO alcanzó su punto máximo por la noche en el 40% al 80% de los pacientes con glaucoma de tensión normal, y el patrón en estos pacientes fue similar al patrón en pacientes con GOP. En las curvas de 24 horas, los pacientes con LTG y POAG tenían patrones de PIO más pronunciados por la tarde y por la noche que por la mañana, con más picos y mayor fluctuación de la PIO durante la noche que durante la noche (7). Otros factores pueden corroborar la hipótesis de un estrés mecánico primario relacionado con la PIO en LTG, como la presencia de cambios en las vías de salida del humor acuoso similares a las que ocurren en POAG (10).
En pacientes en los que la LTG puede considerarse una enfermedad en el espectro de la GOP, se deben implementar estrategias diagnósticas y terapéuticas similares a las de los pacientes con glaucoma hiperbárico, con la ayuda de un oftalmólogo (Figura).
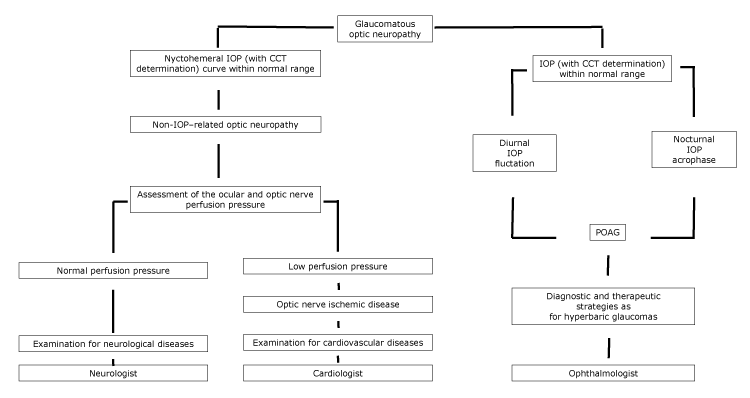
Figura.Diagrama de flujo propuesto de neuropatía óptica, con derivación de un especialista, de acuerdo con las características de la PIO de la nic. Abreviaturas: CCT: grosor de la córnea central; PIO: presión intraocular; GOP: glaucoma primario de ángulo abierto.
Top
¿La Apariencia del Disco Óptico Es Secundaria a la Hipoperfusión del Nervio Óptico Debido a Enfermedades Vasculares?
En pacientes con LTG y curvas de la PIO nic-femeral normales, los factores mecánicos no pueden ser responsables de la neuropatía óptica; pueden estar involucrados factores independientes de la presión, siendo las alteraciones vasculares potencialmente las más importantes (5). Se puede observar una neuropatía óptica tipo glaucomatosa en pacientes con antecedentes de un evento cardiovascular o con aterosclerosis crónica o enfermedades arteriales obstructivas (11). También se ha observado una reducción de la velocidad del flujo sanguíneo en las arterias retrobulbar y en la circulación cerebral, una presión arterial diastólica baja y un diámetro de vaso retiniano central más pequeño en pacientes con LTG (5). En estos pacientes, la patogénesis de la enfermedad se debe a un deterioro de la presión de perfusión ocular, vinculado principalmente a una desregulación vascular primaria o a una disfunción generalizada del sistema nervioso endotelial o autónomo (5,11). Sin embargo, no está claro si estos factores fueron la causa o el resultado de la neuropatía óptica. Desde un punto de vista clínico, la LTG muestra una mayor incidencia de hemorragias discales y se asocia con mayor frecuencia con enfermedades vasculares como migraña, apnea obstructiva del sueño o síndrome de Raynaud que con la PIO (5). Por último, aproximadamente la mitad de los pacientes con GL con enfermedad preperimétrica muestran progresión del daño a pesar de los valores normales de PIO (12). Todos estos hallazgos sugieren el importante papel de la desregulación vascular.
En pacientes con enfermedades cardiovasculares, la ventosa del disco óptico puede tender a no progresar si se ha controlado la causa subyacente de la neuropatía óptica. Además, los pacientes con GL pueden presentar atrofia circunpapilar, así como microinfartos corticales cerebrales, que son signos de isquemia (5). En los pacientes en los que las enfermedades vasculares inducen una hipoperfusión del nervio óptico, se debe realizar un examen diagnóstico completo de enfermedades cardiovasculares, con la ayuda de un cardiólogo (Figura).
Top
¿Se Debe Incluir LTG en un Espectro de Neuropatías Ópticas Congénitas y Adquiridas Que Puedan Simular una Neuropatía Óptica Glaucomatosa?
Cuando se han excluido las causas más frecuentes de ahuecamiento del disco óptico, se debe considerar la posibilidad de una neuropatía óptica neurodegenerativa. Estos casos son los más frustrantes, porque el daño del disco óptico progresa incluso después de que la PIO se ha reducido. Muchas neuropatías ópticas congénitas y adquiridas se incluyen en este grupo de casos, y la diferenciación entre ventosas glaucomatosas y no lamatosas puede ser un desafío incluso para observadores experimentados (13). Entre las formas congénitas de ahuecamiento del disco óptico, la megalopapilla, la atrofia óptica autosómica dominante y la neuropatía óptica hereditaria de Leber podrían producir una excavación del disco óptico que simulara la neuropatía óptica glaucomatosa.
Las neuropatías adquiridas pueden ser secundarias a causas inflamatorias, compresivas, tóxicas y traumáticas. La neuritis óptica puede producir un aumento de la relación copa-disco que, aunque unilateral, puede confundirse con neuropatía óptica glaucomatosa. Las lesiones compresivas, como el meningioma, el adenoma hipofisario, el craneofaringioma y el aneurisma de la arteria carótida interna, pueden llevar a la ahuecación asimétrica del disco óptico y se atribuyen erróneamente a la LTG. La intoxicación con metanol y etambutol podría producir una ventosa de disco óptico bilateral similar a la neuropatía óptica glaucomatosa, secundaria a la pérdida axonal. Por lo tanto, cuando se observa un vaso asimétrico agrandado, es necesaria una investigación neuro-oftalmológica adicional (13).
Por último, entre las condiciones que conducen a la ventosa del disco óptico, el envejecimiento tiene un papel principal. Harju et al encontraron que el grado de ahuecamiento del disco óptico aumentó en participantes sanos mayores del estudio debido a la pérdida fisiológica de fibra. Su población de estudio era apropiada y representaba un conjunto de ojos sanos sin glaucoma; a lo largo de 11 años de seguimiento, ningún participante del estudio desarrolló cambios en el campo visual y no se registró un aumento significativo de la PIO (14). En este último caso, se debe realizar un examen diagnóstico completo de enfermedades neurológicas, con la ayuda de un neurólogo (Figura).
Las mejoras en las técnicas de diagnóstico hacen que sea más fácil que antes clasificar la ventosa de disco óptico; una descripción de las características del disco óptico combinada con la imagen de la capa de fibra nerviosa de la retina y la topografía del disco óptico permite la diferenciación entre la ventosa de disco óptico glaucomatosa y no lamatosa. Además, un análisis cuidadoso de la historia clínica del paciente, junto con la evaluación morfológica y funcional del nervio óptico, ayuda a identificar los trastornos.
El término LTG podría ser un oxímoron, un recuerdo nostálgico del pasado cuando no era posible un diagnóstico definido. Usar el término es como usar la palabra «fiebre» cuando no hay temperatura alta o decir festina lente («más prisa, menos velocidad»). El término LTG puede ser engañoso o inexacto, porque se refiere a un problema mecánico de la PIO, mientras que la ventosa del disco óptico y la pérdida del campo visual en los ojos con presión intraocular normal son causadas por otros factores. Por lo tanto, en presencia de ventosas de disco óptico con PIO normal, los oftalmólogos deben investigar otras causas plausibles de daño al nervio óptico además de la presión intraocular.
Top
Reconocimientos
Este estudio no recibió ninguna subvención específica de ninguna agencia de financiación de los sectores público, comercial o sin fines de lucro.
Top
Información del autor
Autor para correspondencia: Luca Agnifili, MD, PhD, Clínica Oftalmológica, Via dei Vestini, 66100, Chieti (CH), Italia. Teléfono: +39-0871-358489. Correo electrónico: [email protected].
Afiliaciones de autores: 1 Departamento de Medicina y Ciencias de la Salud, Universidad de Molise, Campobasso, Italia. 2 Departamento de Medicina y Ciencia del Envejecimiento, Clínica de Oftalmología, Universidad G. d’Annunzio of Chieti-Pescara, Chieti, Italy.
Top
- Coleman AL, Miglior S. Risk factors for glaucoma onset and progression. Surv Ophthalmol 2008;53(6, Suppl):S3–10. CrossRefexternal icon PubMedexternal icon
- Costagliola C, dell’Omo R, Romano MR, Rinaldi M, Zeppa L, Parmeggiani F. Pharmacotherapy of intraocular pressure: part I. Parasympathomimetic, sympathomimetic and sympatholytics. Expert Opin Pharmacother 2009;10(16):2663–77. CrossRefexternal icon PubMedexternal icon
- Weinreb RN, Aung T, Medeiros FA. The pathophysiology and treatment of glaucoma: a review. JAMA 2014;311(18):1901–11. CrossRefexternal icon PubMedexternal icon
- Cherecheanu AP, Garhofer G, Schmidl D, Werkmeister R, Schmetterer L. Ocular perfusion pressure and ocular blood flow in glaucoma. Curr Opin Pharmacol 2013;13(1):36–42. CrossRefexternal icon PubMedexternal icon
- Mastropasqua R, Fasanella V, Agnifili L, Fresina M, Di Staso S, Di Gregorio A, et al. Advance in the pathogenesis and treatment of normal-tension glaucoma. Prog Brain Res 2015;221:213–32. CrossRefexternal icon PubMedexternal icon
- Moon Y, Lee JY, Jeong DW, Kim S, Han S, Kook MS. Relationship between nocturnal intraocular pressure elevation and diurnal intraocular pressure level in normal-tension glaucoma patients. Invest Ophthalmol Vis Sci 2015;56(9):5271–9. CrossRefexternal icon PubMedexternal icon
- Agnifili L, Mastropasqua R, Frezzotti P, Fasanella V, Motolese I, Pedrotti E, et al. Circadian intraocular pressure patterns in healthy subjects, primary open angle and normal tension glaucoma patients with a contact lens sensor. Acta Ophthalmol 2015;93(1):e14-21. Icon cruzado PUBMICON externo
- De Moraes CG, Liebmann JM, Greenfield DS, Gardiner SK, Ritch R, Krupin T; Grupo de Estudio para el Tratamiento del Glaucoma de baja presión. Factores de riesgo para la progresión del campo visual en el estudio de tratamiento del glaucoma de baja presión. Am J Ophthalmol 2012; 154 (4): 702-11. Icon cruzado Pubmicon externo
- Cartwright MJ, Anderson DR. Correlación del daño asimétrico con la presión intraocular asimétrica en el glaucoma de tensión normal (glaucoma de baja tensión). Arch Ophthalmol 1988;106 (7): 898-900. CrossRefexternal icon PubMedexternal icon
- Agnifili L, Carpineto P, Fasanella V, Mastropasqua R, Zappacosta A, Di Staso S, et al. Conjunctival findings in hyperbaric and low-tension glaucoma: an in vivo confocal microscopy study. Acta Ophthalmol 2012;90(2):e132–7. CrossRefexternal icon PubMedexternal icon
- Hayreh SS, Jonas JB. Appearance of the optic disk and retinal nerve fiber layer in atherosclerosis and arterial hypertension: an experimental study in rhesus monkeys. Am J Ophthalmol 2000;130(1):91–6. CrossRefexternal icon PubMedexternal icon
- Collaborative Normal-Tension Glaucoma Study Group. Comparison of glaucomatous progression between untreated patients with normal-tension glaucoma and patients with therapeutically reduced intraocular pressures. Am J Ophthalmol 1998;126(4):487–97. CrossRefexternal icon PubMedexternal icon
- Fraser CL, White AJ, Plant GT, Martin KR. Optic nerve cupping and the neuro-ophthalmologist. J Neuroophthalmol 2013;33(4):377–89. PubMedexternal icon
- Harju M, Kurvinen L, Saari J, Vesti E. Change in optic nerve head topography in healthy volunteers: an 11-year follow-up. Br J Ophthalmol 2011;95(6):818–21. CrossRefexternal icon PubMedexternal icon
Top