Qu’Est-ce Qu’Un Groupe Carboxyle
Groupe carboxyle: Un groupe carboxyle est un groupe fonctionnel très commun vu en chimie. Un groupe carboxyle est défini comme ayant un groupe carbonyle et un groupe hydroxyle tous deux liés à un atome de carbone. Pour rafraîchir votre mémoire, un groupe carbonyle est un carbone double lié à l’oxygène et un groupe hydroxyle est un groupe OH. En guise de note de côté, ne vous laissez pas berner par le terme groupe carboxy. C’est juste une autre façon de dire le groupe carboxyle.
Un excellent moyen de vous assurer que vous savez que vous avez affaire à du carboxyle est d’être à l’affût de deux choses: un OH et un carbone double-lié à l’oxygène. Mieux encore, si vous regardez le mot carboxyle, nous pouvons le décomposer en deux parties: « carb » et « oxyl ». »Quand vous voyez « carb », pensez à l’atome de carbone. Quand vous voyez ‘-oxyle’, pensez au groupe hydroxyle. La formule moléculaire d’un carboxyle est COOH.
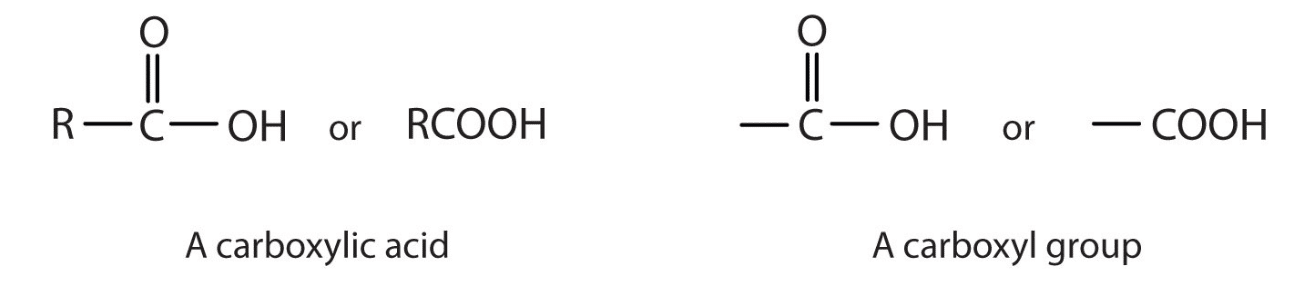
Carboxyle définition: Le carboxyle est un groupe fonctionnel organique constitué d’un atome de carbone double-lié à un atome d’oxygène et lié individuellement à un groupe hydroxyle. Une autre façon de le voir est un groupe carbonyle (C = O)
qui a un groupe hydroxyle (O-H) attaché à l’atome de carbone.
Le carboxyle est couramment écrit -C (=O)OH ou -COOH.
Les groupes carboxyles s’ionisent en libérant l’atome d’hydrogène du groupe -OH. Le H+, qui est un proton libre, est libéré. Ainsi, le carboxyle fait de bons acides. Lorsque l’hydrogène quitte, l’atome d’oxygène a une charge négative, qu’il partage avec le deuxième atome d’oxygène du groupe, permettant au carboxyle de rester stable même lorsqu’il est oxydé.
Également connu sous le nom de carboxyle est parfois appelé groupe fonctionnel carboxy, carboxyle ou radical carboxyle.
Quel est le groupe carboxyle en chimie organique?
Un groupe carboxyle est constitué d’un carbone double-lié à l’oxygène et également lié au groupe a-OH. Les composés contenant du carboxyle sont appelés acides carboxyliques ou acides organiques. Le carboxyle peut agir comme un acide lorsqu’il donne un proton (H +) à une solution et s’ionise.
Les glucides ont-ils des groupes carboxyles?
Qu’est-ce que les glucides ont à voir avec les groupes carboxyles? Les glucides ont un grand nombre de groupes hydroxyle (alcool): le glucose, par exemple, en a cinq. All Dans l’ensemble, à condition que l’hydrate de carbone ait un groupe alcool au premier degré quelque part sur la molécule, il peut être oxydé pour former un carboxyle.
Un groupe carboxyle est-il un acide ou une base ?
Groupe fonctionnel carboxyle
C’est l’une des classes très importantes de composés organiques. La formule générale de la classe est R-C (O) OH. Dans cette formule, R est le groupe alkyle ou aryle. Les acides carboxyliques sont largement présents dans la nature. Cependant, la majorité des membres de ce groupe sont fabriqués de manière synthétique. La double liaison présente dans la structure des acides carboxyliques joue un rôle très important dans les propriétés des différents composés des acides carboxyliques. Reportez-vous au schéma ci-dessous.
Lorsqu’un composé carboné est attaché au groupe fonctionnel –COOH, le composé se réfère alors aux acides carboxyliques. Cependant, la formation d’un carboxyle est possible par la fixation d’un groupe hydroxyle sur un carbonyle, d’où le nom » carboxyle. »Les acides carboxyliques peuvent être aliphatiques ou aromatiques sur la base du groupe présent. Si un groupe alkyle est présent (RCOOH) et si un groupe aryle est présent (ArCOOH).
Les membres supérieurs des acides carboxyliques aliphatiques, en C12-C18, sont appelés acides gras. Ils se trouvent dans la nature sous forme de graisses naturelles ou d’esters de glycérol. De plus, ce groupe est la matière première de nombreux composés organiques essentiels comme les esters, les chlorures d’acides, les anhydrides, les amides, etc.
Il existe de nombreux composés naturels contenant de l’acide carboxylique. Par exemple, l’acide formique est présent dans les piqûres d’insectes, l’acide butyrique est présent dans le beurre, l’acide carbonique est présent dans le système bicarbonate du sang et des tissus, l’acide laurique est présent dans l’huile de noix de coco, l’acide palmitique est présent dans l’huile de palme, l’acide arachidique est présent dans l’huile d’arachide et l’acide stéarique est présent dans le chocolat, les cires, les savons et les huiles. Dans ce sujet, nous discuterons de la façon dont les propriétés et la structure du carboxyle affectent les propriétés des composés du groupe acide carboxylique.
Définition du groupe carboxyle
Lorsque vous passez du temps avec du carboxyle en tant que composé organique, vous bénéficiez de l’avantage de rejoindre le club de l’acidité. Le carboxyle rendra les composés organiques acides en raison de leur propre propriété ionisante. Creusons un peu plus en profondeur sur ce sujet de la propriété ionisante du carboxyle.
Le carboxyle s’ionisera en lâchant l’atome d’hydrogène sur l’hydroxyle. Ce processus d’ionisation se produit souvent. Lorsque l’atome d’hydrogène est flottant librement, on l’appelle maintenant un proton libre. C’est la libération de cet atome d’hydrogène qui rend un carboxyle acide.
Mais qu’est-ce que cela signifie pour l’atome d’oxygène? Eh bien, au lieu de rester seul et triste que l’hydrogène soit parti, l’atome d’oxygène se chargera négativement. Comme un retour à la perte de son hydrogène pal, l’atome d’oxygène ira jusqu’à partager cette charge négative avec le deuxième atome d’oxygène présent. En partageant une charge négative entre les deux atomes d’oxygène, le carboxyle est capable de rester stable lorsqu’il est ionisé.
Structure carboxylattait, alors pourquoi le carboxyle est-il si disposé à laisser partir l’hydrogène? La réponse revient à la stabilité. Lorsque l’hydrogène est présent, le carboxyle est lié par une liaison simple à l’hydroxyle et une double liaison à l’atome d’oxygène. Ces deux liaisons différentes rendent le carboxyle mal à l’aise car plus d’énergie est nécessaire pour maintenir sa configuration. Lorsque l’hydrogène quitte, la double liaison est rompue, et maintenant le carboxyle est libre non seulement d’abaisser son état énergétique, mais également d’augmenter sa stabilité. Par conséquent, il est parfaitement logique que le carboxyle laisse aller l’hydrogène et se transforme en acide.
Les Trois Parties D’Un Acide Aminé Sont Le Groupe Amino
Les groupes carboxyles sont des acides faibles, se dissociant partiellement pour libérer des ions hydrogène.
Le groupe carboxyle (symbolisé par COOH) a à la fois un groupe carbonyle et un groupe hydroxyle attachés au même atome de carbone, ce qui donne de nouvelles propriétés.

Les groupes carboxyle s’ionisent fréquemment, libérant le H du groupe hydroxyle sous forme de proton libre (H +), le reste du O portant une charge négative. Cette charge « bascule » entre les deux atomes d’oxygène, ce qui rend cet état ionisé relativement stable. (Les groupes hydroxyles s’ionisent parfois momentanément, mais les formes ioniques résultantes ne sont pas stables et les ions se rejoignent immédiatement.)
Les molécules contenant des groupes carboxyles sont appelées acides carboxyliques et se dissocient partiellement en H+ et COO-.
Les groupes carboxyles sont communs dans de nombreuses molécules biologiques, y compris les acides aminés et les acides gras.

La figure de gauche illustre l’acide acétique, un acide simple à 2 carbones présent dans le vinaigre. Regardez le groupe carboxyle s’ioniser et le groupe ionisé résultant est stabilisé par le négatif
Le groupe carboxyle
Le groupe Carboxyle est un composé organique fonctionnel. Dans cette structure d’un groupe carboxyle, un atome de carbone est attaché à un atome d’oxygène à l’aide d’une double liaison. Il a également une seule liaison avec un groupe hydroxyle. Les acides carboxyliques sont des composés contenant une structure carboxylique. Il y a beaucoup de membres dans cette classe d’acides organiques tels que l’acide acétique et l’acide aminé.
Le groupe carboxyle est généralement présent sur les côtés des molécules. Le groupe carboxyle s’ionise et libère l’atome H présent dans la partie groupe hydroxyle sous forme d’ion H+ libre ou de proton. Cependant, le reste de la partie, c’est O, transmet une charge négative. La charge se déplace entre les deux molécules d’oxygène vers l’avant et vers l’arrière, rendant ainsi l’état d’ionisation relativement stable.
Lire aussi: Conjugaison du Verbe espagnol Seguir