Pression du gaz
Une propriété importante de tout gazest sa pression. Nous avons une certaine expérience de la gaspression que nous n’avons pas avec des propriétés telles que la viscosité et la compressibilité. Chaque jour, nous entendons le météorologue de la télévision donnervaleur de la pression barométrique de lamosphère (29,8 pouces de mercure, par exemple). Et la plupart d’entre nous ont fait exploser un ballon ou ont utiliséune pompe pour gonfler un pneu de vélo ou un ballon de basket.
Parce que comprendre ce qu’est la pression et son fonctionnement est fondamental pour la compréhension de l’aérodynamique, nous incluons plusieurs diapositives sur la pression du gaz dans le Guide du débutant. Un simulateur d’atmosphère interactif vous permet d’étudier les changements de pression d’air statique avec l’altitude. Le programme Foilsim vous montre comment la pression varie autour d’une aile de levage, et le programme Enginesim montre comment la pression change à travers un moteur à turbine.Un autre simulateur vous aide à étudier les changements de pression à traversles ondes de choc qui se produisent à grande vitesse.Il y a deux façons d’envisager la pression: (1) l’action à petite échelle de molécules d’air individuelles ou (2) l’action à grande échelle d’un grand nombre de molécules.
Définition moléculaire de la pression
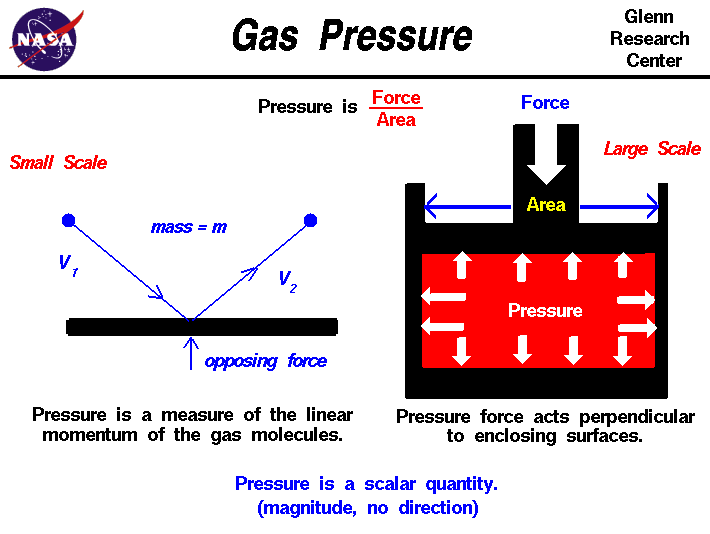
D’après la théorie cinétique des gaz, un gaz est composé d’un grand nombre de molécules qui sont très petites par rapport à la distance entre les molécules. Les molécules d’agas sont en constante évolution et entrent fréquemment en collision les unes avec les autres et avec les parois de tout récipient. Les molécules possèdent les propriétés physiques de la masse, de l’élan et de l’énergie.L’impulsion d’une seule molécule est le produit de sa masse et de sa vitesse, tandis que l’énergie cinétique est la moitié de la masse fois le carré de la molécule. velocity.As les molécules de gaz entrent en collision avec les parois deun récipient, comme indiqué sur la gauche de la figure, les molécules transmettent un momentum aux parois, produisant une force perpendiculaire à la paroi.La somme des forces de toutes les molécules frappant la paroi divisée par l’aire de la paroi est définie comme étant la pression. La pression d’un gaz estpuis une mesure du moment linéaire moyen des molécules en mouvement d’un gaz.La pression agit perpendiculairement (normale) à la paroi; la composante tangentielle (cisaillement) de la force est liée à la viscosité du gaz.
Quantité scalaire
Regardons un gaz statique; un gaz qui ne semble pas bouger ou s’écouler.Alors que le gaz dans son ensemble ne semble pas bouger, les molécules individuelles du gaz, que nous ne pouvons pas voir, sont en constante évolution. Parce que nous avons affaire à un nombre presque infini de molécules et parce que le mouvement des molécules individuelles est aléatoire dans toutes les directions, nous ne détectons aucun mouvement. Si nous enfermons le gaz dans un conteneur, nous détectons une pression dans le gaz provenant des molécules entrant en collision avec les parois de notre conteneur. Nous pouvons placer les parois de notre conteneur n’importe où à l’intérieur du gaz, et la force par zone (la pression) est la même.Nous pouvons réduire la taille de notre « conteneur » jusqu’à un point infiniment petit, et la pression a une seule valeur à ce point. Par conséquent, la pression est ascalarquantité, pas la quantité avectrice. Il a une magnitude mais aucune direction associée àil. La pression agit dans toutes les directions en un point à l’intérieur d’un gaz. À la surface d’un gaz, la force de pression agit perpendiculairement à la surface.
Si le gaz dans son ensemble se déplace, la pression mesurée est différente dans la direction du mouvement. Le mouvement ordonné du gasproduit une composante ordonnée de l’élan dans la direction du mouvement.Nous associons un composant de pression supplémentaire, appelé pression dynamique, à cet élan fluide.La pression mesurée dans le sens du mouvement est appelée pression totale et est égale à la somme des pressions statiques et dynamiques décrites par l’équation de Bernoulli.
Définition à l’échelle macro de la pression
En passant à l’échelle plus grande, la pression est variable d’un gaz, comme la température et la densité.Le changement de pression au cours de tout processus est régi par les lois de la thermodynamique.Vous pouvez explorer les effets de la pression sur d’autres gaz variables dans le laboratoire de gaz animé.Bien que la pression elle-même soit un scalaire, on peut définir une force de pression égale à la pression (force / surface) fois la surface dans une direction perpendiculaire à la surface.La force de pression est une quantité vectorielle.
Les forces de pression ont des qualités uniques par rapport à la gravité ou à la mécanique forces.In la figure ci-dessus à droite, nous avons un gaz rougequi est confiné dans une boîte. Une force mécanique est appliquée sur le dessus de la boîte. La force de pression à l’intérieur de la boîte s’oppose à la force appliquée selon la troisième loi du mouvement de Newton.La pression scalaire est égale à la force externe divisée par l’aire du dessus de la boîte. À l’intérieur du gaz, la pression agit dans toutes les directions. Doncla pression pousse sur le fond de la boîte et sur les côtés. Ceci est différent de la mécanique des solides simples. Si le gaz était un solide, il n’y aurait aucune force appliquée sur les côtés de la boîte; la force appliquée serait simplement transmise au fond. Mais dans un gaz, parce que les molécules sont libres de se mouvoiret entrent en collision les unes avec les autres, une force appliquée dans la direction verticale provoque des forces dans la direction horizontale.
Activités:![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() div>
div>![]() Visites guidées
Visites guidées
-
 Modèle d’Atmosphère standard:
Modèle d’Atmosphère standard: 
-
 Statique des gaz:
Statique des gaz: 
-
 Pitot-Tube statique:
Pitot-Tube statique: 
Navigation..
![]()
![]()
![]()
![]()
Beginner’s Guide Home Page