Posts taggés « Théorie MO; cycloaddition; chimie organique; HOMO; LUMO; système conjugué »
L’un des concepts les plus difficiles dans les réactions du système conjugué est les interactions orbitales moléculaires, ou théorie MO. Les bases de ce principe peuvent être difficiles à saisir, mais seront très instructives pour prédire les conditions de réaction correctes et le résultat de la réaction si vous les comprenez, ce qui vous donnera un avantage majeur sur les futurs quiz et examens. Chez StudyOrgo, nous avons conçu une explication simple des bases de la théorie MO pour vous aider dans vos préparatifs d’étude.
Principes de la théorie MO
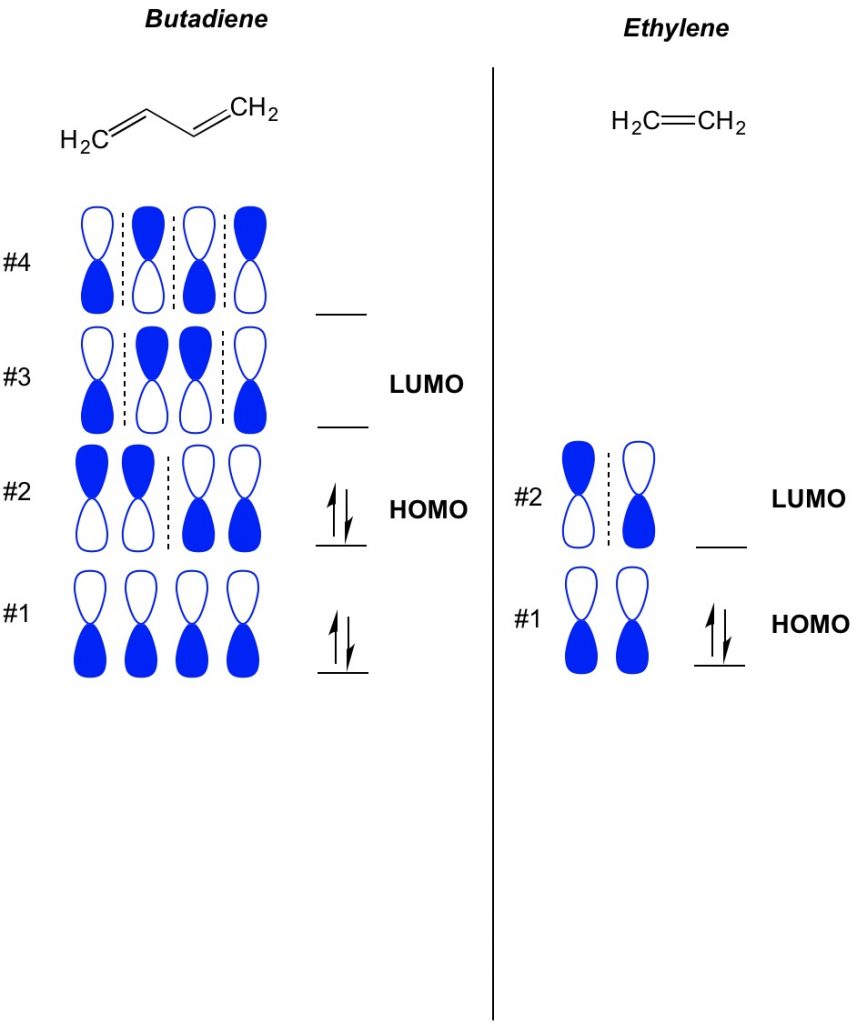
Le concept de base de la théorie MO est de décrire les modèles alternés d’orbitales qui existent dans les systèmes de liaisons pi. Nous décrivons l’orientation de chaque moitié de l’orbitale de l’haltère centrée autour d’un atome comme étant audacieuse ou ouverte. Rappelez-vous, il y a des orbitales de liaison et d’anti-liaison. Essentiellement, les orbitales avec un nombre plus faible de nœuds (commutateurs dans l’orientation de l’orbitale de l’haltère que nous montrons avec la ligne pointillée) se comportent plus comme des orbitales de liaison tandis que les orbitales avec un nombre plus élevé de nœuds se comportent comme des orbitales anti-liaison. Pour déterminer quelles orbitales sont occupées sur votre molécule, comptez simplement le nombre de liaisons pi que vous avez dans votre système conjugué. Voici un exemple de butadiène. Il a 4 électrons pi, donc nous remplissons d’abord les orbitales moléculaires les plus basses, deux dans chaque orbitale. Par conséquent, l’orbitale moléculaire occupée la plus élevée, ou HOMO, dans le butadiène est #2. En conséquence, l’obital moléculaire inoccupé le plus bas, ou LUMO, dans le butadiène est #3. Nous pouvons étendre cela à l’éthylène et voir qu’avec 2 électrons pi, l’orbitale moléculaire #1 est l’HOMO et l’orbitale moléculaire #2 est le LUMO.
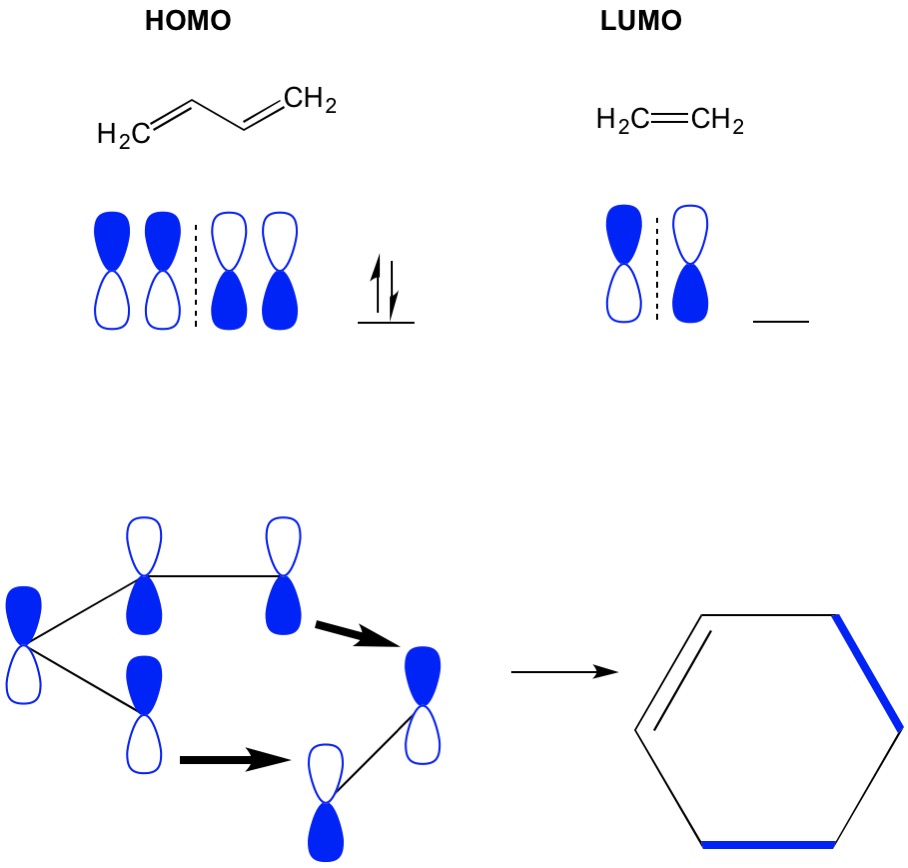
Cycloadditions Théorie MO
Rappelez-vous que les réactions de cycloaddition décrivent la formation de nouvelles liaisons sigma C-C par réarrangement des électrons pi dans un système conjugué. Par conséquent, nous devons utiliser les orbitales moléculaires des électrons pi pour piloter la réaction. Prenons la réaction du butadiène avec l’éthylène, la réaction de Diels Alder la plus simpliste (cycloaddition 4 + 2). Nous commençons par la molécule la plus conjuguée, le butadiène et examinons son HOMO. Ensuite, nous examinons la molécule la moins conjuguée, l’éthylène et examinons son LUMO. Pourquoi? Nous avons besoin des électrons d’un HOMO pour passer d’une molécule à une autre, nous devons donc utiliser l’orbitale LUMO qui n’est pas occupée pour ce processus. Nous voyons que les nœuds de l’HOMO et du LUMO s’alignent; c’est-à-dire les moitiés ouvertes et fermées des haltères s’alignent. Cela conduit à une réaction directe et à la formation du produit, le cyclohexène.
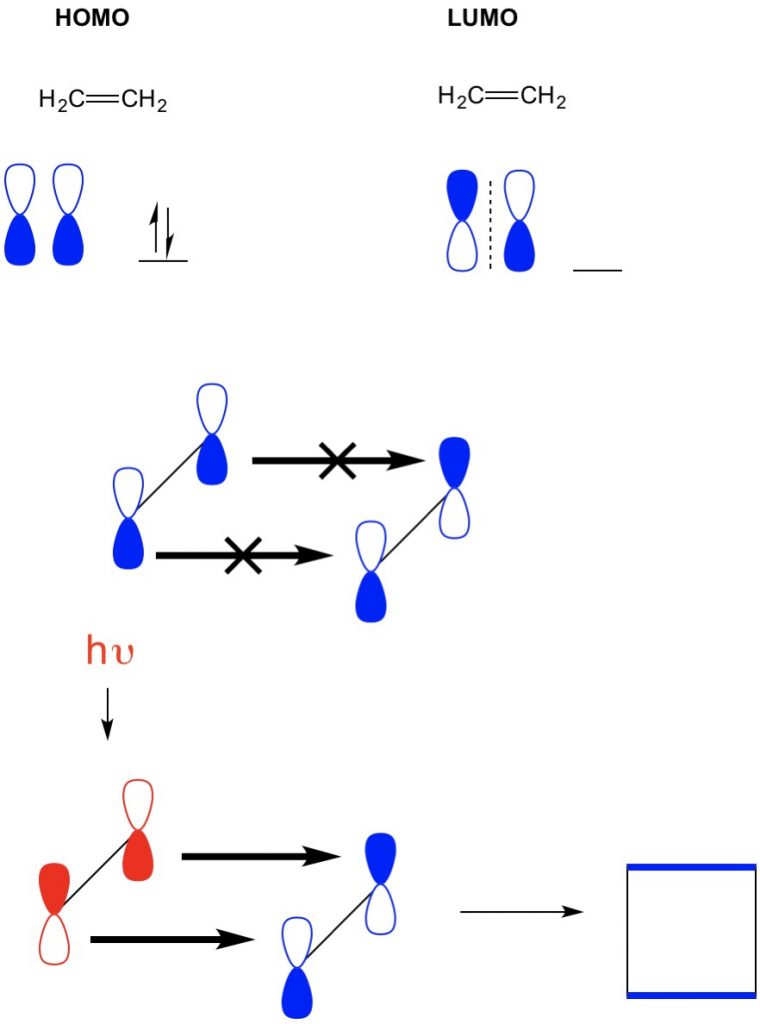
Cependant, dans un autre exemple où nous avons une (cycloaddition 2 +2), nous voyons que l’HOMO et le LUMO de l’éthylène ne s’alignent pas interdisant ainsi la réaction. Cependant, nous avons la capacité d’exciter les électrons de l’HOMO vers une orbitale plus élevée en utilisant la lumière (hv) ou la chaleur, modifiant ainsi l’HOMO. Nous passons en revue ce concept en détail dans un article précédent. Lorsque nous faisons cela, l’HOMO de l’éthylène excité et le LUMO de l’éthylène à l’état fondamental s’alignent et la réaction produit du cyclobutane.
Nous espérons que cette description a aidé à clarifier ces concepts de la théorie MO. Ceci est un exemple des expatiations claires et simples que nous avons préparées pour plus de 175 réactions couramment observées dans les cours Orgo1 et Orgo2. Inscrivez-vous dès aujourd’hui pour vos besoins de préparation à l’étude!