Jetez un coup d’œil aux articles récents
Résumé
Contexte: Une endométriose pulmonaire est l’une des formes relativement rares de l’endométriose extragénitale et, conformément à ses symptômes clinico-pathologiques, est considérée dans les termes du « syndrome d’endométriose thoracique”, c’est-à-dire lorsque l’endomètre fonctionnel se trouve dans la plèvre, le diaphragme, les viae respiratoriae ou le parenchyme pulmonaire lui-même.
Objectifs: 42 cas de cette maladie ont été observés. L’âge des patients variait de 16 à 61 ans, soit une moyenne de 40,5 ± 0,4 ans.
Résultats: Dans la majorité des cas, l’endométriose a affecté le diaphragme et s’est accompagnée d’un pneumothorax avec les symptômes correspondants complexes, tandis que les foyers pulmonaires se sont produits plus rares, étant asymptomatiques ou simulant une pathologie chirurgicale et autre. La chirurgie et l’étude histologique ont été cruciales pour vérifier le diagnostic. Les récepteurs de la progestérone et des œstrogènes et la production de Ki-67 ont été détectés immuno-histochimiquement dans le tissu endométrioïde des foyers pulmonaires.
Conclusion: L’utilisation des méthodes histologiques et immuno-histochimiques complètes était nécessaire pour rendre le diagnostic final de l’endométriose pulmonaire plus fiable. Il a une grande signification pratique étant l’une des conditions préalables les plus importantes pour la prescription d’un traitement adéquat.
Mots clés
syndrome d’endométriose thoracique, endométriose extragénitale, endométriose pulmonaire, lésion du diaphragme, pneumothorax, vérification histologique du diagnostic
Introduction
L’endométriose est une croissance du tissu similaire à l’endomètre à l’extérieur de la cavité utérine qui s’accompagne d’une réaction inflammatoire chronique, conduisant dans la plupart des cas au développement d’un syndrome douloureux et/ ou d’une infertilité. Actuellement, c’est l’une des maladies gynécologiques les plus courantes. Cette pathologie survient chez 2 à 10% des femmes en âge de procréer et près de 50% des femmes infertiles.
L’une des formes relativement rares de l’endométriose est caractérisée par le développement du tissu endométrial en dehors du système reproducteur. Les foyers extragénitaux peuvent exister indépendamment à la fois en tant que formations séparées et en tant que composants des lésions concomitantes. Les cas d’endométriose extragénitale représentent 6 à 8% du nombre total d’endométrioses observées. Parmi les organes sans rapport avec le système reproducteur, il y a les intestins, les voies urinaires et les poumons qui sont les plus fréquemment touchés.
Hart fut le premier à diagnostiquer l’endométriose pulmonaire (EP) à titre posthume en 1912. Il a observé chez une femme, âgée de 72 ans, de nombreux nœuds sous-pleuraux variant de la taille d’un pois à celle d’une noix. L’examen histologique a montré une adénomyose d’origine utérine; une tumeur dans l’utérus de la patiente ayant été retirée 22 ans auparavant.
Au cours de la dernière décennie, le nombre de publications sur l’endométriose a nettement augmenté. Le concept de ”syndrome d’endométriose thoracique » (TES) a été développé et utilisé dans les cas où l’endomètre fonctionnel se trouve dans la plèvre, le diaphragme, le viae respiratoriae ou le parenchyme pulmonaire lui-même.
Channabasavaiah et Joseph ont présenté les résultats d’une analyse de 110 cas cliniques d’endométriose intrathoracique vérifiée histologiquement qui ont été publiés entre 2001 et 2007. Legras et coll. ont étudié rétrospectivement 229 cas de pneumothorax chez des femmes décrites dans la littérature spécialisée écrite en anglais de 2000 à 2011 et indiquent que le TES diagnostiqué dans 54 cas (24%).
La question de savoir comment un endomètre fonctionnel pénètre dans la poitrine reste encore ouverte. Sampson a été le premier à suggérer que l’endomètre est transféré de la cavité utérine à la cavité abdominale à travers les trompes de Fallope par le biais de la soi-disant « menstruation rétrograde », c’est-à-dire l’écoulement d’une certaine quantité de sang dans la cavité pelvienne pendant la menstruation. Ce type de reflux se produit chez un grand nombre de femmes en bonne santé. Sampson a également émis l’hypothèse d’une existence de l’endométriose métastatique ou embolique, ce qui permet de spéculer sur les voies hématogènes de la propagation de l’endométriose. Hobbs et Bortnick ont confirmé cette hypothèse en introduisant expérimentalement la suspension de l’endomètre dans les veines de l’oreille des lapins, ce qui a entraîné le développement de l’EP dans 79% des cas.
Le TES se manifeste le plus souvent par un pneumothorax récurrent, une hémoptysie, une toux ou des douleurs thoraciques, et plus rarement par l’hémothorax associé aux menstruations. Le PE est l’une des formes les plus rares du TES. Les manifestations cliniques les plus importantes de la première sont la toux, l’hémoptysie et une sensation de lourdeur dans la poitrine (symptôme de « manteau de fourrure lourd ») qui se produisent pendant les règles, mais pas nécessairement à chaque cycle menstruel.
Selon la littérature, un pneumothorax associé au TES est trouvé chez environ 10 à 24% des femmes présentant un pneumothorax spontané.
L’examen thoracique aux rayons X (principalement HRCT) révèle quatre variantes de la pathologie: opacités linéaires ou réticulaires, petits nodules, espaces aériens kystiques, septa alvéolaires épaissis. Ces résultats radiologiques, en particulier ceux associés à une hémoptysie et à une douleur thoracique, sont souvent considérés comme une preuve d’un caractère tuberculeux ou néoplasique de la lésion pulmonaire.
Une lésion du diaphragme est généralement détectée par accident lors d’une intervention chirurgicale due à un pneumothorax. Avant la chirurgie, cette pathologie est très rarement détectée en raison d’une étendue limitée des lésions et d’une faible résolution des méthodes radiologiques.
Presque sans exception, la maladie affecte un centre tendineux du dôme du diaphragme droit et peut apparaître de deux types. Le premier se présente sous la forme d’implants endométrieux bleus ou violets sous la plèvre pariétale jusqu’à 5 mm. Les seconds sont des défauts ronds ou en forme de fente dans le diaphragme.
L’absence de symptômes spécifiques, de marqueurs de laboratoire et de schémas radiologiques caractéristiques rend le diagnostic préopératoire de PE difficile. Il n’est souvent finalement diagnostiqué qu’après confirmation par les méthodes histologiques, parmi lesquelles l’immuno-histochimie, y compris l’expression des récepteurs des œstrogènes et de la progestérone.
Par conséquent, l’intervention chirurgicale est souvent nécessaire à des fins diagnostiques et thérapeutiques. Bien que l’opération vérifie généralement le diagnostic et supprime toute lésion de l’endomètre hétérotopique, ce type de traitement reste incomplet sans hormonothérapie suppressive. Il vise un blocage de l’ovulation, une suppression de la sécrétion d’œstrogènes et une suppression de la croissance épithéliale dans le foyer endométrieux.
Un nombre relativement faible de cas de TES décrits dans la littérature spécialisée mondiale et l’absence de son tableau clinique pathognomonique nous ont amenés à résumer notre propre expérience dans le diagnostic et le traitement de cette maladie.
Méthodes
Nous avons analysé 42 cas de TES observés dans nos hôpitaux entre 2004 et 2016. L’âge des patients variait de 16 à 61 ans, soit une moyenne de 40,5 ±0,4 ans.
35 patients ont été hospitalisés en raison d’un pneumothorax spontané, 3 avec des masses tumorales arrondies, 1 avec un kyste et 3 avec une infiltration dans le tissu pulmonaire. De manière significative, chez 41 patients, le processus pathologique était localisé dans le poumon droit.
Résultats
Les principales plaintes de tous les patients hospitalisés sont répertoriées dans le tableau 1.
Tableau 1. Complaints of patients with the thoracic endometriosis syndrome
|
Complaints |
Patients (n=42) |
|
|
abs. number |
per cent |
|
|
Chest pain |
85,7 |
|
|
Dyspnea |
73,8 |
|
|
Dry cough |
50,0 |
|
|
Infertility |
14,3 |
|
|
Hémoptysie |
9,5 |
|
Dans la plupart des cas, il y avait une douleur thoracique (85,7%); l’hémoptysie était moins fréquente (9,5 %). La dyspnée n’a été notée que chez 31 patients atteints de pneumothorax; 6 femmes souffraient d’infertilité. Dans l’anamnèse, 5 patients présentaient un myome utérin et un kyste de l’endomètre de l’ovaire chez 2 patients.
Le HRCT de la poitrine a détecté des ombres arrondies dans les poumons (3 cas), des infiltrats avec des cavités à parois minces (6 cas), un kyste pulmonaire (1 cas), des bulles de différents diamètres (6 cas) et une masse dans la région paravertébrale considérée comme un neurinome (1 cas) (Figure 1). Dans le même temps, aucune modification du tissu pulmonaire n’a été détectée dans 26 des 42 cas (61,9% des patients).
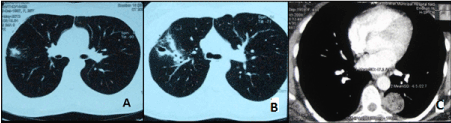
Figure. 1. Scanners thoraciques HRCT de patients atteints d’endométriose pulmonaire A – infiltration de tissus pulmonaires; B – petites cavités; C – nodules périphériques.
Malheureusement, un examen préopérationnel ne nous permet en aucun cas de suggérer le TES, car l’expression CA-125 n’indique pas non plus la possibilité de le faire. Dans le même temps, une analyse rétrospective des données postopératoires a suggéré qu’une condition préalable essentielle à ce diagnostic existait bel et bien.
Les diagnostics préopératoires étaient les suivants: pneumothorax spontané primaire dans 35 cas, tuberculose pulmonaire infiltrante dans 3 cas, hémosidérose pulmonaire, neurinome du médiastin, tumeur pulmonaire et kyste pulmonaire – chacun étant dans un cas.
L’intervention chirurgicale a été réalisée chez 37 des 42 patients. Sur les 35 femmes atteintes de pneumothorax, 30 (85,7 %) ont été opérées. Une résection pulmonaire atypique a été réalisée dans 27 cas (90% des patients), une pleurectomie costale dans 28 cas (93,3%) et la résection du centre tendineux du diaphragme dans 25 cas (83,3%).
Sur 7 patients sans pneumothorax, 6 ont été soumis à la résection pulmonaire atypique et 1 à la lobectomie.
Dans tous les cas, un examen histologique du matériel chirurgical a été effectué. Des coupes de paraffine ont été colorées avec de l’hématoxyline et de l’éosine, du bleu alcian et de la picrofuchsine par van Gieson. L’immuno-histochimie a été réalisée à l’aide d’anticorps dirigés contre les récepteurs de la progestérone et des œstrogènes ainsi que d’anticorps monoclonaux de souris dirigés contre le Ki-67 et le bcl 2 (Dako, Danemark).
En corrélant les données cliniques et histologiques, le TES a été diagnostiqué dans tous les cas et peut être subdivisé en catégories suivantes: perforation du dôme droit du diaphragme avec des implants endométriaux histologiquement identifiés (6 patients); hétérotopies endométriales intrapulmonaires sous forme de ganglions, d’infiltrats et de kystes (11 patients); lésions multifocales du poumon et du diaphragme (1 patient). Une perforation du dôme droit du diaphragme sans endomètre identifié histologiquement (”diaphragme poreux ») a été observée dans 24 cas.
L’évaluation macroscopique des poumons retirés a détecté des kystes avec du matériel brun foncé (6 cas). Les parois des kystes étaient épaisses, leur surface interne lisse (5 cas) ou avec des excroissances papillaires (1 cas). 5 observations restantes ont révélé de petits foyers d’hémorragie dans les zones sous-pleurales.
L’examen microscopique a détecté de nombreux amas de glandes endométriales avec un stroma cytogène. La structure de ces glandes correspondait à diverses phases du cycle menstruel 9 (à savoir. un stade de prolifération ou de sécrétion) présenté en différentes quantités. Le type d’épithélium endométrial des glandes était généralement pseudostratifié, aplati ou colonnaire; les noyaux cellulaires étaient situés aux différents niveaux; le cytoplasme contenait des gouttes secrètes; ici et là, des signes de desquamation de l’épithélium étaient notés. Dans la lumina alvéolaire et dans l’interstitium pulmonaire, des dépôts d’hémosidérine ont souvent été trouvés. Le stroma glandulaire était représenté par des cellules allongées avec des noyaux en forme de fuseau, à certains endroits avec des caractéristiques de décidualisation (Figure 2). Dans 5 cas, une transformation kystique des glandes a été observée avec des hémorragies autour d’elles. Quelques dépôts d’hémosidérine et une transformation fibroblastique d’un stroma cytogène étaient évidents dans la plupart des cas.
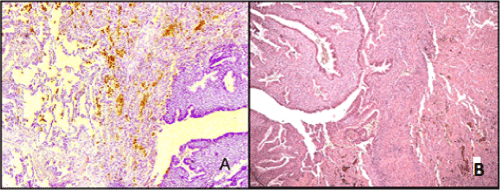
Figure. 2. Endométriose pulmonaire. A – îlots de prolifération des glandes endométriales. Dans la lumina alvéolaire, il y a des dépôts d’hémosidérine. Coloration à l’hématoxyline et à l’éosine (X 100); B – épithélium proliférant des glandes avec des gouttes secrètes dans le cytoplasme. Stroma avec caractéristiques de décidualisation. Coloration à l’hématoxyline et à l’éosine (X 160).
Dans tous les cas, l’étude immuno-histochimique a été réalisée. Il a révélé l’expression des récepteurs de la progestérone et des œstrogènes dans l’épithélium de la glande et les cellules du stroma cytogène (Figure 3a, B) ainsi que l’expression de l’oncoprotéine bcl-2 dans l’épithélium de la glande et une activité proliférative modérée (Ki-67) dans le stroma cytogène (Figure 3c).
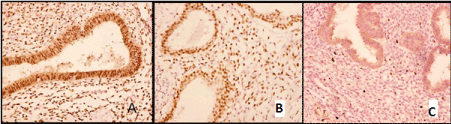
Figure. 3. Endométriose pulmonaire: A – expression des récepteurs de la progestérone dans les cellules épithéliales glandulaires (X200); B – identique aux récepteurs des œstrogènes (X200); Expression de C–Ki-67 dans le stroma cytogène (X100).
Voici deux exemples tirés de nos observations.
Exemple 1. Patient F., 52 ans. Le diagnostic clinique était une tumeur du lobe inférieur du poumon droit. Six ans auparavant, l’extirpation de l’utérus sans appendices était réalisée à cause du myome utérin avec adénomyose; le patient souffrait d’infertilité. 6 ans après la chirurgie, il y avait des plaintes concernant des douleurs périodiques dans la poitrine, de la toux et une hémoptysie. La radiographie du thorax a révélé une ombre ronde de 4 cm de diamètre dans le lobe inférieur du poumon droit. HRCT a montré une formation arrondie, de 4х3х2,5 cm, structurée de manière hétérogène avec des contours bien définis. L’examen n’a pas permis de vérifier le diagnostic précis, de sorte que la lobectomie inférieure droite a été réalisée. Macroscopiquement, une formation de type « nid d’abeille » avec des contours bien définis et de petites cavités jusqu’à 0,7 cm remplies d’un liquide brun épais a été détectée. Il y avait un tissu fibreux homogène dense entre les cavités. L’examen histologique a révélé des glandes endométrioïdes transformées kystiques avec un épithélium proliférant sur leurs parois ainsi qu’une formation de papilles et un stroma cytogène fibreux, ainsi qu’une hyperplasie léiomyomateuse autour des structures glandulaires (Figure 4).
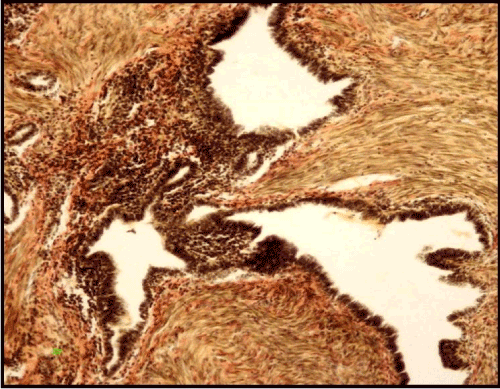
Figure. 4. Endométriose pulmonaire avec structures papillaires et hyperplasie léiomyomateuse. Coloration Van Gieson (X 160).
Exemple 2 : Patient A., 42 ans. Le diagnostic clinique était le pneumothorax spontané du côté droit. Le premier jour du cycle menstruel, une douleur dans la moitié droite de la poitrine est apparue. Il était accompagné d’une toux sèche et d’une légère dyspnée. La radiographie thoracique a révélé un pneumothorax du côté droit avec une atélectasie de 50% et un déplacement du médiastin vers la gauche. Lors de l’admission à l’hôpital, une thoracoscopie diagnostique du côté droit a été réalisée avec un drainage de la cavité pleurale. Le centre tendineux du diaphragme présentait des perforations et des implants endométriaux (Figure 5). Le HRCT de la poitrine n’a révélé aucun changement dans le tissu pulmonaire. La vidéothoracoscopie du côté droit, la résection du centre du tendon du diaphragme et la pleurectomie costale sous-totale ont été réalisées. Macroscopiquement, quelques perforations au centre du tendon et des nodules brunâtres aux contours bien définis jusqu’à 0,5 cm ont été détectés. Ils étaient situés sur la surface du diaphragme pleural sans y pénétrer. L’examen histologique a montré des lésions kystiques de l’endomètre sur le fond fibreux.
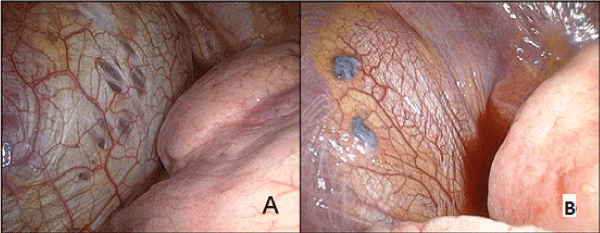
Figure. 5. Lésions du diaphragme révélées en opération. A – perforations au centre du tendon du diaphragme; B – implants endométrioïdes.
Dans ce cas, ainsi que dans tous les autres, l’apparition et la disparition des symptômes cliniques et radiologiques ont coïncidé avec le début et la fin du cycle menstruel. Néanmoins, ce fait a échappé aux physiciens.
Discussion
Comme preuve claire des mots autrefois prononcés par le célèbre oncomorphologue russe Golovin, l’endométriose extragénitale confirme que chaque tissu est une unité stable historiquement formée possédant certaines propriétés et puissances morphogénétiques, qui ne disparaissent pas complètement même en cas d’interrelations anormales entre un organisme et une tumeur. Cette approche est extrêmement importante pour comprendre l’EP comme un processus pathologique toto coelo.
Dans la plupart de nos observations, l’endométriose a affecté le diaphragme et s’est accompagnée du pneumothorax avec un complexe symptomatique correspondant, tandis que l’hétérotopie pulmonaire s’est avérée plus rare étant asymptomatique ou simulant certaines pathologies chirurgicales et autres.
Il convient de mentionner que la lésion de la moitié gauche de la poitrine n’a été diagnostiquée que dans un cas (à savoir. implants dans le dôme gauche du diaphragme et le poumon gauche), ce qui confirme le fait que TES est la pathologie du côté droit. Nous suggérons que la raison de cette sélectivité est le fait que le dôme droit du diaphragme avec le foie, bien que non lié de manière rigide, fonctionne pendant la respiration comme un piston fournissant un « effet d’aspiration ». Soi-disant, c’est aussi la raison pour laquelle c’est exactement l’espace sous le dôme du diaphragme droit où une certaine quantité de sang menstruel peut s’écouler du bassin. La résorption sanguine est réalisée avec la participation active de l’appareil lymphatique du péritoine. Les fragments de l’endomètre atteignent l’espace sous-pleural à travers les vaisseaux lymphatiques perforant le diaphragme et y restent fixés dans la plupart des cas. La nécrose et la lyse subséquentes de l’endomètre peuvent entraîner des défauts de perforation. Hypothétiquement, il est possible que dans de rares cas, de petits fragments d’endomètre atteignent la veine cave supérieure à travers les vaisseaux lymphatiques médiastinaux, puis pénètrent dans le parenchyme pulmonaire formant des ganglions, ou kystes.
L’hypodiagnostic clinique et morphologique du TES est conditionné non seulement par sa rareté, mais aussi par l’absence d’analyse complexe et complète et de corrélation des données anamnestiques, cliniques et histologiques.
Compte tenu de l’incidence croissante de l’endométriose, pulmonaire parmi d’autres, il semble essentiel d’inclure cette maladie dans la gamme des diagnostics différentiels, en particulier lorsque des femmes en âge de procréer présentent une pathologie pulmonaire du côté droit peu claire et des antécédents gynécologiques compromis. Dans de tels cas, il est conseillé de recruter des gynécologues afin d’exclure l’adénomyose et l’endométriose pelvienne. Dans le cas des maladies pulmonaires récurrentes obscures, il est impératif de réaliser l’IRM des organes du petit bassin.
Nos données permettent de déterminer certaines caractéristiques importantes et fiables du TES comme suit: la localisation principalement du côté droit de la maladie, l’âge relativement jeune des patientes, la récurrence cyclique de l’hémoptysie et l’inconfort ou la douleur thoracique, le pneumothorax récurrent du côté droit, la corrélation de l’apparition et / ou de la régression des symptômes radiologiques avec le début et / ou la fin du cycle menstruel, l’un ou l’autre des problèmes gynécologiques (à savoir. infertilité, douleurs pelviennes, algoménorrhée) et chirurgies des organes pelviens dans l’anamnèse.
La chirurgie diagnostique nécessite une utilisation intensive de l’ensemble du matériel opératoire avec découpe d’échantillons pour l’examen histologique de toutes les zones pulmonaires touchées, car les caractéristiques microscopiques de l’endométriose dans différentes parties du poumon, même voisines, peuvent varier considérablement. Du point de vue diagnostique, la caractéristique morphologique essentielle de l’EP est une combinaison des signes de stabilité, de progression ou de régression dans le même ou dans les échantillons adjacents du tissu pulmonaire. Pour rendre le diagnostic final du TES plus fiable, l’utilisation des méthodes histologiques et immuno-histochimiques complètes est nécessaire. Le diagnostic précis de l’endométriose est d’une grande importance pratique car il est une condition préalable à la sélection du traitement adéquat.
- Tsvelev YV, Abashin VG, et al. (2007) Endométriose: vues modernes sur l’étiologie, la terminologie et la classification. Académie de médecine Militaire Vestnik Rus 4:42-47.
- Olive DL, Schwartz LB (1993) Endométriose. N Engl J Med 328:1759-1769.
- Ozhiganova DANS (2009) Endométriose et maladie endométrioïde (normes de travail de l’examen post-mortem). SPb. .
- Harada M, Osuga Y, Izumi G, Takamura M, Takemura Y, et al. (2011) Dienogest, une nouvelle stratégie conservatrice pour l’endométriose extragénitale: une étude pilote. Gynécol Endocrinol 27:717-720.
- Bergqvist A (1993) Différents types d’endométriose extragénitale: une revue. Gynécol Endocrinol 7:207-221.
- Joseph J, Sahn SA (1996) Syndrome d’endométriose thoracique: nouvelles observations issues d’une analyse de 110 cas. Am J Med 100, 164-170.
- Alifano M, Trisolini R, Cancellieri A, Regnard JF (2006) Endométriose thoracique: connaissances actuelles. Ann Thorac Surg 81:761-769.
- Flieder DB, Moran CA, Travis WD, Koss MN, Mark EJ (1998) Endométriose pleuro-pulmonaire et déciduose ectopique pulmonaire: une étude clinicopathologique et immuno-histochimique de 10 cas en mettant l’accent sur les pièges diagnostiques. Hum Pathol 29: 1495-1503.
- Channabasavaiah AD et Joseph JV (2010) Endométriose thoracique: revisiter l’association entre la présentation clinique et la pathologie thoracique sur la base de résultats thoracoscopiques chez 11 patients. Médone. Baltimore 89:183-188.
- Legras A, Mansuet-Lupo A, Rousset-Jablonski C, Bobbio A, Magdeleinat P, et al. (2014) Pneumothorax chez les femmes en âge de procréer: une classification mise à jour basée sur les résultats cliniques et pathologiques. Chest 145:354-360.11.
- Hobbs JE et Bortnick AR. (1940) Endométriose du poumon; une étude expérimentale et clinique. Am J Obstet Gynecol 40:832-843.
- Pichurov AA, OrzheshkovskiÄ OV, Dvorakovskaia IV, Romanova LA, Ivanichtchak BE, et al. (2014) . Vestn Khir Im I I Grek 173:26-29.
- Sampson JA (1927) Endométriose péritonéale due à la dissémination menstruelle du tissu endométrial dans la cavité péritonéale. Je suis Obstétricien. Gynécol 14:422-469.
- Adamyan LV, Koulakov VI et Andreeva EN (2006). Endométriose. M., Médizine. .
- Agarwal N. et Subramanien AA (2010) Endométriose. Morphologie, présentations cliniques et pathologie moléculaire. J Médecins de laboratoire 10:1-9.
- IablonskiÄ PK, Pichurov AA, OrzheshkovskiÄ OV, Petrun’kin AM, Goncharuk IV (2014). Vestn Khir Im I I Grek 173:89-95.
- Terada Y, Chen F, Shoji T, Itoh H, Wada H, et al. (1999) Un cas d’endométriose endobronchique traitée par sous-segmentectomie. Chest 115:1475-1478.18. Koizumi T, Inagaki H, et al. (1999) Utilisation réussie de l’agoniste de l’hormone libérant les gonadotrophines chez un patient atteint d’endométriose pulmonaire. Respiration 66:544-546.
- Golovin DI (1975) Atlas des tumeurs humaines. Leningrad, Médizine. .
- Abu-Hijleh MF, Habbal OA, Moqattash ST (1995) Le rôle du diaphragme dans l’absorption lymphatique de la cavité péritonéale. J Anat 186:453-467.