Insémination Intra-Utérine chez le Chien

Dans: Recent Advances in Small Animal Reproduction, P. W. Concannon, G. England et J. Verstegen (Eds.) Éditeur : Service International d’Information Vétérinaire (www.ivis.org ), Ithaca, New York, États-Unis.
Insémination Intra-utérine chez le Chien En utilisant le Cathéter Trans-Cervical Scandinave et une Comparaison avec d’autres Méthodes (2-Feb-2001)
C. Linde-Forsberg
Faculté de Médecine vétérinaire, Département d’Obstétrique et de Gynécologie, Université suédoise des Sciences agricoles, Uppsala, Suède
Introduction
L’intérêt pour la conservation du sperme canin et l’insémination artificielle (IA) ne cesse de croître dans le monde entier, mais relativement peu d’études sont publiées chaque année dans ce domaine, et il est particulièrement difficile de trouver des données sur les inséminations artificielles utilisant du sperme frais, ou du sperme conservé selon diverses méthodes de refroidissement, de congélation et de décongélation , et aussi comparer les résultats lorsqu’ils sont différents des techniques pour effectuer les inséminations sont utilisées. L’une des raisons de la rareté des données est qu’il est coûteux de faire des études expérimentales chez le chien et que peu de centres de recherche peuvent conserver des colonies de chiens suffisamment grandes pour ce type d’études. Une autre raison est que la plupart des grandes entreprises de traitement et de distribution de sperme canin pour les éleveurs de chiens travaillent sur une base purement commerciale, et bien que certaines d’entre elles semblent tenir des registres de leurs résultats, ni ces résultats, ni la composition des extenseurs ou les méthodes de conservation du sperme ne sont divulgués. Les connaissances ainsi acquises resteront donc entre les différentes entreprises, et ne seront pas bénéfiques pour le monde scientifique, et donc ni pour les éleveurs de chiens en général. Les seules études sur l’insémination artificielle canine faisant état des résultats de fertilité d’un grand nombre d’inséminations sont celles de Seager et al., sur 156 AIs de sperme congelé-décongelé utilisant des dépôts vaginaux, Linde-Forsberg & Forsberg sur 470 et 527 AIs respectivement, utilisant à la fois du sperme frais, réfrigéré étendu et congelé-décongelé et des AI vaginaux ainsi que intra-utérins, Linde-Forsberg et al., sur 327 EAE de sperme congelé-décongelé, comparant l’IA vaginale et intra-utérine, Linde-Forsberg faisant état de 2041 EAE avec du sperme frais et réfrigéré étendu et congelé-décongelé et utilisant à la fois l’IA vaginale et intra-utérine, et Thomassen et al., sur 312 AIs congelés-décongelés principalement intra-utérins. Un certain nombre de facteurs sont importants pour déterminer le taux de réussite de l’insémination artificielle chez le chien, tels que le moment et le nombre de fois pendant le cycle œstral de la chienne, la qualité et la manipulation du sperme et la technique d’insémination. Plus d’informations sur ces facettes peuvent être trouvées dans les références citées. Cet article traitera uniquement des techniques d’insémination et des effets du site de dépôt de sperme. Les études cliniques récentes ont mis en évidence l’importance de l’insémination intra-utérine par opposition à l’insémination artificielle intravaginale chez le chien et sont les premières à démontrer des résultats nettement meilleurs lorsque le sperme était déposé dans l’utérus plutôt que dans le vagin. Dans l’étude de Linde-Forsberg et al., le taux de mise bas en utilisant le dépôt intra-utérin de sperme congelé était de 84,4% par rapport à 58.9% en utilisant le dépôt vaginal, et la taille moyenne de la portée était de 5,4 + 3,0 comparativement à 4,0
+ 2,7 chiots /portée (P<0,001). Les données de fertilité de 2041 inséminations artificielles sont des chiens, pratiqués chez des chiennes suédoises entre 1990 et 1998 et signalés au Club canin dans les 2 semaines, (i.e. avant qu’un test de grossesse n’ait pu être effectué pour éviter de fausser les résultats), a montré que des taux de mise bas et des tailles de portée significativement plus élevés étaient obtenus non seulement avec du sperme congelé-décongelé, mais aussi avec du sperme frais, ainsi que réfrigéré, étendu lorsque le sperme avait été déposé dans l’utérus plutôt que dans le vagin (tableau 1).

Les résultats en utilisant du sperme frais, présentés dans le tableau 1, sont légèrement trop élevés car 11% de ces chiennes ont été, pour diverses raisons, non seulement inséminées artificiellement mais également accouplées. La raison la plus fréquente en était que les éleveurs essayaient d’accoupler les chiennes trop tôt pendant l’œstrus et que lorsque les chiens ne s’accouplaient pas, leurs propriétaires demandaient une IA. Le taux de mise bas dans le groupe également accouplé était aussi élevé que 84,5%, avec une taille moyenne de portée de 6,0 + 2,8 petits, comparativement à un taux de mise bas de 48,9% et une taille moyenne de portée de 5,8 + 2,8 petits pour les chiennes qui n’ont été inséminées artificiellement. Il semble donc qu’un certain nombre d’EA effectuées avec du sperme frais soient effectuées à un moment non optimal pendant l’oestrus, généralement en raison de l’inexpérience de l’éleveur, mais le résultat relativement médiocre est probablement également dû au fait que l’IA est demandée en raison de divers problèmes chez les chiens. Les données suédoises, cependant, démontrent clairement que chez le chien, l’IA intra-utérine améliore considérablement le taux de mise bas et la taille de la portée. Le taux de mise bas par l’IA intra-utérine a augmenté, passant de 36% pour le sperme frais à 50% pour le sperme congelé-décongelé, par rapport à l’IA vaginale. Et, avec l’IA intra-utérine, la taille moyenne de la portée a augmenté de 0,3 chiots par portée pour le sperme congelé et de 0,6 et 0,7 par portée pour le sperme étendu frais et réfrigéré. Il est également intéressant dans ce contexte de noter que le chien est considéré comme une espèce avec dépôt intra-utérin de sperme lors de l’accouplement naturel, car au moment où le lien copulatoire est terminé, les spermatozoïdes ont atteint les oviductes. La fraction riche en spermatozoïdes est éjaculée à l’intromission et au début du lien copulatoire, et est suivie d’un grand volume de liquide prostatique qui chasse immédiatement les spermatozoïdes du vagin crânien étroit à travers le col de l’utérus dans le corps utérin et les cornes. Le vagin semble offrir un environnement défavorable aux spermatozoïdes canins, car une grande proportion lâche leurs queues quelques minutes après le dépôt dans le vagin crânien. Il a également été démontré qu’environ 10 fois plus de spermatozoïdes sont nécessaires pour obtenir des résultats similaires par IA vaginale que par IA intra-utérine avec du sperme frais, ainsi qu’avec du sperme congelé-décongelé. Il existe donc de nombreux facteurs qui contribuent aux moins bons résultats obtenus par dépôt de sperme intravaginal par rapport aux dépôts intra-utérins.
Méthodes pour effectuer l’IA Intra-Utérine chez le Chien.
L’IA intra-utérine chez le chien peut être réalisée par voie transcervicale soit au moyen du cathéter scandinave (ou norvégien), soit en utilisant un endoscope vaginal rigide en fibres optiques pour visualiser le col de l’utérus et un cathéter urinaire pour le transvaser. L’IA intra-utérine peut également être réalisée par des méthodes invasives telles que la laparoscopie ou une chirurgie abdominale complète. Dans certains pays, ces dernières méthodes peuvent être illégales ou ne pas être considérées comme acceptables sur le plan éthique.
Palpation du Col de l’utérus
Il est absolument essentiel pour la personne qui souhaite effectuer une IA canine d’apprendre à localiser le col de l’utérus par palpation abdominale afin de pouvoir déposer le sperme au bon endroit et éviter de blesser la chienne. La chienne doit avoir l’estomac et la vessie vides pour faciliter la procédure. Pour la formation, il est recommandé d’utiliser les cathéters vaginaux canins en plastique à usage unique (Minitüb GmbH, Tiefenbach, Allemagne) (Fig. 1).
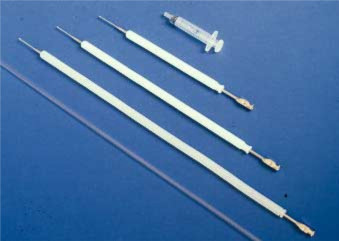
Figure 1. Les trois tailles du cathéter d’insémination artificielle scandinave pour chiens et du cathéter d’insémination artificielle vaginale en plastique à usage unique.
Comme l’ouverture urétrale de la chienne est située au bord pelvien, il est étonnamment facile pour le cathéter AI, ou un endoscope rigide mince, d’être introduit involontairement dans la vessie. Outre les risques de perforation de la vessie avec le cathéter, il est évident qu’aucune grossesse ne suivrait après une IA. Ainsi, la position correcte du cathéter doit toujours être vérifiée par palpation avant de déposer une dose de sperme. Si le cathéter se trouve dans la vessie, la partie crânienne du vagin et le col de l’utérus peuvent être palpés au-dessus du cathéter. Les parois de la vessie sont généralement plus minces que celles du vagin et la pointe du cathéter se détache plus distinctement que si elle se trouvait dans le vagin. Pour palper le col de l’utérus, un cathéter AI est introduit dans le vagin de la chienne. L’introduction du cathéter est facilitée si la vulve est élevée jusqu’à ce qu’elle soit juste en dessous de l’anus (comme lorsque la chienne représente le chien mâle). Lorsque la pointe du cathéter est introduite jusqu’au bord immédiatement crânien du bord pelvien, elle doit être palpée. Crâniquement, le vagin de la plupart des chiennes descend légèrement vers le bas. Chez certaines races, cependant, en particulier les chiens de vue avec une longe très arquée, le vagin a une direction plus dorsale. L’extrémité crânienne du cathéter doit maintenant être abaissée plus près de la paroi abdominale pour devenir plus accessible à la palpation. Lorsque la pointe du cathéter peut être palpée et que sa position correcte dans le vagin est ainsi vérifiée, elle est soigneusement introduite plus loin, sous contrôle palpatoire continu, jusqu’à atteindre la zone paracervicale. Il s’agit de la partie crânienne étroite du vagin créée par le pli post-cervical médian dorsal et peut être palpé sous la forme d’une structure ferme de 1 à 2 cm de long. Il se termine au col de l’utérus, qui chez une chienne en oestrus est une structure dure de 0,5 à 1,5 cm, arrondie à ovoïde, librement mobile. Il n’est généralement pas possible de faire passer la gaine de protection extérieure du cathéter scandinave, qui a un diamètre de 10 mm, dans la zone paracervicale. De plus, le cathéter AI en plastique plus mince, d’un diamètre de 5 mm, peut être trop large pour être introduit dans la zone paracervicale chez certaines chiennes, en particulier celles des races plus petites, ou celles qui n’ont pas donné naissance à une portée de chiots. Une fois le col de l’utérus identifié, le corps utérin et les cornes utérines peuvent être palpés devant cette structure. Abaissez la pointe du cathéter, puis fermez la pointe du pouce contre celle de l’index au-dessus du cathéter, puis soulevez l’extrémité crânienne du cathéter de manière à ce que le col de l’utérus et les cornes utérines soient tirés vers le haut entre les doigts. Leur taille et leur consistance deviennent alors évidentes. (Cette méthode de palpation de l’utérus est également très utile pour la détection précoce de la grossesse et pour examiner les chiennes avec un pyomètre suspecté).
Insémination intra-utérine à l’aide du cathéter scandinave
Le cathéter scandinave se compose d’un cathéter en acier de 1 à 2 mm de large avec un 0.embout de 75 mm à 1 mm de diamètre, disponible en trois longueurs différentes : 20, 30 ou 40 cm. Il est utilisé avec une gaine de protection extérieure en nylon de 10 mm de diamètre (Fig. 1 et Fig. 2). Le cathéter de taille moyenne convient à la plupart des chiennes de petite et moyenne taille. L’équipement peut être obtenu auprès de l’Association norvégienne des éleveurs de fourrure, Boîte postale 136, Økern, N-0509 Oslo 5, Norvège.

Figure 2. Un gros plan des deux tailles de pointes du cathéter AI scandinave pour chiens.
L’IA intra-utérine avec le cathéter scandinave est réalisée avec la chienne debout sur le sol ou sur une table. La sédation est très rarement nécessaire; au contraire, la plupart des chiennes en oestrus acceptent librement ce type de manipulation. Dans le cas où une sédation légère devrait être nécessaire, par exemple chez une chienne de très grande taille, obèse ou nerveuse, 1 à 3 mg / kg de xylazine IM ou IV peut être utilisé. Le cathéter interne en acier, avec la pointe à l’intérieur et protégé par la gaine en nylon, est introduit dans le vagin. L’extrémité crânienne de la gaine en nylon est palpée devant le bord pelvien comme décrit précédemment. Si l’extrémité de la gaine du cathéter a été abaissée plus près de la paroi abdominale, le col de l’utérus se trouve généralement quelques cm devant et au-dessus. Le cathéter en acier est ensuite introduit à travers la gaine jusqu’à ce que son extrémité atteigne le fornix ventral. Le col de l’utérus est fixé entre le pouce et l’index et, en appliquant une traction légèrement vers le bas au niveau du corps utérin, il est incliné de sorte que l’angle du canal cervical devienne plus horizontal (Fig. 3).
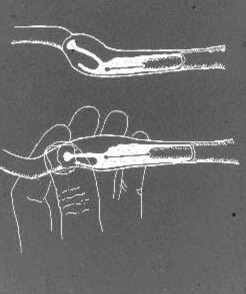
Figure 3. Un dessin schématique de la région paracervicale canine et du canal cervical, avec le cathéter scandinave en position dans le vagin crânien. Par manipulation au niveau du col de l’utérus et du corps utérin, l’angle du col de l’utérus est modifié pour que le canal cervical soit mieux aligné avec la pointe du cathéter afin de faciliter le cathétérisme.
La pointe du cathéter est ensuite soigneusement retirée en la poussant à plusieurs reprises contre la surface du col de l’utérus à la recherche de l’ouverture du canal cervical. La sensation lors de la découverte de cette ouverture peut dans la plupart des cas être décrite comme la sensation de toucher le cartilage, c’est-à-dire « croustillant”. Une fois l’ouverture trouvée, fixez le cathéter et commencez à travailler le col contre le cathéter. Le canal cervical mesure de 5 à 10 mm de long et n’est pas toujours complètement droit. Ainsi, une légère pression peut devoir être appliquée, tout en faisant tourner le cathéter pour le faciliter. Chez la plupart des chiennes, la pointe du cathéter peut facilement être ressentie devant le col de l’utérus dans le corps utérin. Chez certaines chiennes, cependant, la sensation n’est pas aussi distincte. La seringue contenant du sperme est connectée au cathéter et le sperme perfusé lentement dans l’utérus. Parfois, il existe une résistance à la perfusion selon que l’ouverture du cathéter appuie ou non sur la muqueuse de l’endomètre. Une légère traction vers le bas du corps utérin ou du col de l’utérus soulage généralement la situation et permet l’infusion de sperme. Pour vérifier que le cathéter est vraiment dans l’utérus de la chienne, 1 à 2 ml de solution saline physiologique peuvent être perfusés. Si le cathéter est dans la bonne position dans le corps utérin, le liquide peut facilement être perfusé. Si, par contre, le cathéter se trouve dans la région paracervicale, il y aura un reflux presque immédiat de solution saline entre le cathéter et la gaine en nylon. Le cathéter est retiré et les quartiers arrière de la chienne sont surélevés et la chienne est maintenue dans cette position pendant 5 à 10 minutes après l’AI afin de minimiser le reflux du sperme et de faciliter le transport utérin des spermatozoïdes vers les oviductes. La chienne doit également être emplumée autour de la région périnéale car on pense que cela stimule les contractions utérines. Pour apprendre cette technique nécessite un peu de pratique, mais une fois apprise, c’est une méthode rapide, généralement accomplie en quelques minutes. Il est recommandé, dans un premier temps, d’obtenir des échantillons d’organes à des fins d’entraînement et d’étude anatomique. C’est également un avantage si surtout les premières tentatives sont faites chez les chiennes qui ont donné naissance à une ou plusieurs portées, car elles sont généralement beaucoup plus faciles à cathétériser. Des perforations peuvent survenir si le cathéter est introduit aveuglément ou avec force. À condition que le cathétérisme soit effectué sous contrôle palpatoire attentif, cependant, la technique est totalement sans danger pour la chienne. Certaines chiennes sont plus difficiles à cathétériser, en particulier celles appartenant à certaines races géantes, ainsi que des animaux obèses ou nerveux. En utilisant le cathéter scandinave seulement entre 2 et 3,5% des tentatives de cathétérisme intra-utérin ont échoué. Le taux de mise bas résultant de l’utilisation de sperme congelé-décongelé a été rapporté à 84.5%, et 71% lorsqu’elles sont réalisées par des inséminateurs qualifiés, une moyenne de 65% avec du sperme frais et réfrigéré et 52% avec du sperme congelé-décongelé, dans une étude de terrain plus vaste impliquant également des inséminateurs moins expérimentés (Fig. 1). Cette technique peut également être utilisée pour l’infusion intra-utérine de produit de contraste pour l’examen hystérographique de la chienne.
L’insémination intra-utérine par visualisation endoscopique du Col de l’utérus
L’insémination intra-utérine transcervicale peut également être réalisée à l’aide d’un endoscope fibroptique rigide et d’un cathéter urinaire ou angiographique, sur la chienne debout, et sans sédation (Fig. 4 et Fig. 5).

L’insémination intra-utérine par laparoscopie
La laparoscopie abdominale devrait offrir une alternative un peu plus acceptable à la chirurgie complète pour l’IA chez le chien. La technique a été décrite par Wildt et Silva et al. . Un taux de grossesse de 60 à 73% a été rapporté par l’IA en laparoscopie, mais le nombre de chiennes dans ces études était peu élevé.
Une insémination intra-utérine par chirurgie
Une chirurgie pour effectuer une insémination intra-utérine a été rapportée. Diverses interventions chirurgicales ont été utilisées, avec la chienne sous anesthésie générale et en position couchée dorsale. L’abdomen ventral est coupé et, après une préparation chirurgicale de routine, une incision de 4 à 6 cm est pratiquée à mi-chemin entre le pubis et l’ombilic, à travers la linea alba. L’utérus est élevé à travers l’incision et l’aiguille de la seringue contenant le sperme est insérée dans la lumière du corps utérin à un angle de 45o avec le biseau de l’aiguille vers le haut. Le sperme est lentement injecté dans l’utérus. Il doit s’écouler facilement avec une distension évidente des cornes utérines, ou bien l’aiguille doit être repositionnée. Une gaze saline humidifiée est maintenue sur le site d’injection après le retrait de l’aiguille. Après 1 min, la gaze est retirée, l’utérus est remplacé dans l’abdomen et la plaie fermée en utilisant la méthodologie de routine. Pour éviter le reflux de sperme, la chienne doit être positionnée avec l’arrière surélevé lorsqu’elle se remet de l’anesthésie. Un taux de grossesse d’environ 60% a été rapporté après une IA chirurgicale chez le chien, mais comme pour l’IA laparoscopique, les résultats sont basés sur des études expérimentales limitées et aucune donnée de terrain n’est disponible pour évaluation en utilisant l’une ou l’autre méthode. Il est discutable de savoir s’il est éthiquement acceptable de recourir à la chirurgie pour obtenir des grossesses. La méthode, bien que préconisée par certains, est considérée par beaucoup comme contraire à l’éthique et trop stressante pour la chienne. Les risques d’infection, etc. associé à la chirurgie en général et au nombre limité d’IA chirurgicales pouvant être réalisées chez une chienne donnée sont deux inconvénients évidents. La méthode est également coûteuse et prend du temps.
1. Seager SWJ, Platz CC, Fletcher WS. Taux de conception et données connexes utilisant du sperme de chien congelé. J Reprod Fertil 1975; 45:189-192.
2. Linde-Forsberg C, Forsberg M. Fertilité chez le chien en relation avec la qualité du sperme et le temps et le site d’insémination. J Reprod Fertil 1989; 39 (Suppl): 299-310. – PubMed –
3. Linde-Forsberg C, Forsberg M. Résultats de 527 inséminations artificielles contrôlées chez le chien. J Reprod Fertil 1993; 47 (Suppl): 313-323. – PubMed –
4. Linde-Forsberg C, Ström Holst B, Govette G. Comparaison des données de fertilité de l’insémination vaginale vs intra-utérine du sperme de chien congelé-décongelé: Une étude rétrospective. Theriogenology 1999; 52:11-23. – PubMed –
5. Linde-Forsberg C. Fertility data from 2041 controlled artificial inséminations in dogs. Dans : Proceeding of the 4th Int Symp Canine Feline Reprod, Oslo, 2000, 120 p. (abstr.)
6. Thomassen R, Farstad W, Krogenaes, A, Fougner, J.A. et Andersen Berg K. Insémination artificielle avec du sperme congelé chez le chien. Une étude rétrospective. J Reprod Fertil 2001, sous presse.
7. Tsutsui T, Kawakami E, Murao I, et al. Transport des spermatozoïdes dans l’appareil reproducteur de la chienne: Observations par fistules utérines. Jpn J Vet Sci 1989; 51:560-565. – PubMed –
8. Linde-Forsberg C. Insémination artificielle avec du sperme frais, réfrigéré étendu et congelé-décongelé chez le chien. Séminaires à Vet Med Surg (Petit Animal) 1995; 10:48-58.
9. Tsutsui T, Tezuka T, Shimizu T, Murao I, Kawakami E, Ogasa A. Insémination artificielle avec du sperme frais chez des chiennes Beagle. Jpn J Vet Sci 1988; 50:193-198.
10. Andersen K. Insémination avec du sperme de chien congelé basée sur une nouvelle technique d’insémination. Zuchthyg 1975; 10:1-4.
11. Linde C. Transport du liquide radio-opaque dans l’utérus après dépôt vaginal chez la chienne œstreuse. Acta vet scand 1978; 19:463-465.
12. Funkquist B, Lagerstedt A-S, Linde C, Obel N. Hystérographie chez la chienne. Vet Radiol 1985; 26:12-18.
13. Wilson M. Insémination artificielle intra-utérine non chirurgicale chez des chiennes utilisant du sperme congelé. J Reprod Fertil 1993; 47 (Suppl): 307-311. – PubMed –
14. Battista M, Parks J, Concannon PW. Survie du sperme canin après décongélation après congélation dans des pailles ou des granulés à l’aide de TUYAUX, de lactose, de tris ou d’extenseurs de TEST. In: Proceedings of the 11th Int Congr Anim Reprod and AI, Dublin 1988; 3:229-231.
15. Wildt DE. Laparoscopie. Dans : Burke TJ, éd. Reproduction de Petits Animaux et Infertilité. Philadelphie: Lea & Febiger, 1986; 121-140.
16. Silva LDM, Onclin K, s’enclenche F, Verstegen JP. Insémination intra-utérine laparoscopique chez la chienne. Theriogenology 1995; 43:615-623.
17. Silva LDM, Verstegen JP. Comparaisons entre trois extenseurs différents pour l’insémination intra-utérine canine avec des spermatozoïdes congelés-décongelés. Theriogenology 1995; 44:571-579.
18. Silva LDM, Onclin K, Lejeune B, Verstegen JP. Comparaisons de l’insémination intravaginale et intra-utérine de chiennes avec du sperme frais ou congelé. Vet Rec 1996; 138:154-157. – PubMed –
19. Smith FO, Graham EF: Cryoconservation du sperme canin: Technique et performance. In: Proceedings of the Xth Int Congr Anim Reprod and AI, Champaign-Urbana 1984; 2:216.
20. RV Hutchison. &Vaginal dépôt intra-utérin chirurgical de sperme. Dans: Proceedings of the Canine Theriogenology Short Course 1993; 33-37.
21. RV Hutchison. Maximiser les taux de conception en utilisant du sperme canin frais refroidi ou congelé. Dans : Proceedings of the Canine Male Reprod Symp 1997; 61-70.