Enzymes de Bordure de Brosse de l’Intestin Grêle
Physiopathologie VIVO
Enzymes de bordure de brosse de l’Intestin Grêle
La dernière étape de la digestion des glucides et des protéines alimentaires se produit sur la face des entérocytes de l’intestin grêle, à proximité immédiate des transporteurs qui achemineront les sucres et les acides aminés résultants dans les cellules épithéliales. Les enzymes responsables de ce stade terminal de la digestion ne sont pas libres dans la lumière intestinale, mais plutôt attachées en tant que protéines membranaires intégrales dans la membrane plasmique de l’entérocyte. La membrane plasmique apicale abritant ces enzymes est composée de nombreux microvillosités qui s’étendent à partir de la cellule et constituent la » bordure de brosse « . Par conséquent, les enzymes incorporées dans ces microvillosités sont appelées enzymes de bordure de brosse.
La densité et la distribution des enzymes de bordure de brosse diffèrent selon les différents segments de l’intestin grêle et varient souvent en fonction de l’âge de l’animal. De plus, dans certains cas, la concentration de telles enzymes peut être modulée par le régime alimentaire; par exemple, la quantité d’enzyme sucrase-isomaltase augmente chez les animaux nourris avec un régime riche en glucides.
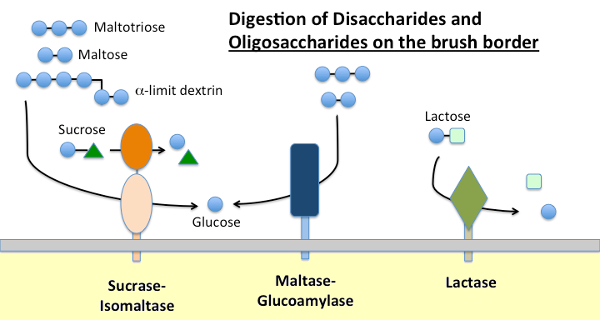
La Maltase-Glucoamylase et la Sucrase-Isomaltase
L’amidon alimentaire est digéré par l’α-amylase présente dans les sécrétions pancréatiques et, chez de nombreuses espèces, la salive. L’amylase hydrolyse les liaisons glycosidiques α-1,4 internes dans l’amidon pour générer du maltose, des oligosaccharides courts (par exemple le maltotriose) et des dextrines dites limites, qui sont des points de ramification dans l’amylopectine. Aucune de ces molécules ne peut être absorbée à travers l’épithélium de l’intestin grêle et nécessite une hydrolyse supplémentaire, finalement en glucose.
La maltase-glucoamylase et la sucrase-isomaltase sont des enzymes étroitement liées intégrées dans la membrane de bordure de brosse qui exécutent les étapes terminales de la digestion à l’aide de substrats fournis par l’action de l’amylase:
- La maltase-glycoamylase possède deux sites actifs. Le site maltase hydrolyse les résidus terminaux de D-glucose liés à l’α-1,4 du maltose ou du maltotriose, générant de l’α-D-glucose. Le site glucoamylase a également cette activité hydrolase α-1,4 mais hydrolyse également les liaisons glycosidiques α-1,6 lorsqu’elles sont adjacentes à une liaison α-1,4, libérant du β-D-glucose.
- La sucrase-isomaltase possède également deux sites actifs avec des spécificités différentes. Le site de la sucrase catalyse l’hydrolyse de la sucrase en fructose et en glucose, et est également capable d’hydrolyser le maltose. Le site d’isomaltase est important en tant que mécanisme majeur de digestion des liaisons α-1,6 des dextrines limites.
Lactase
La lactase, comme son nom l’indique, est une disaccharidase qui hydrolyse le lactose en galactose et en glucose; formellement, c’est une β-glycosidase. Le lactose est le principal glucide du lait et la lactase est abondamment présente dans la bordure de la brosse intestinale des jeunes mammifères. Chez la plupart des espèces, y compris les humains, l’expression de la lactase chute peu après le sevrage. Chez une majorité d’humains, cette non-persistance de l’activité lactase à l’âge adulte est associée à une « intolérance au lactose ». La différence entre la persistance et la non-persistance de la lactase est déterminée génétiquement.
Peptidases
Il existe un grand nombre de peptidases en bordure de brosse, qui peuvent collectivement hydrolyser la diversité des séquences d’acides aminés présentes dans les protéines alimentaires. Les principales classes de peptidases comprennent :
- Exopeptidases qui hydrolysent les acides aminés terminaux à partir de peptides. Certaines de ces enzymes ont une activité contre les résidus C-terminaux et d’autres agissent sur les acides aminés N-terminaux. Leur activité donne des acides aminés libres ou des dipeptides. À titre d’exemple de spécificité et de diversité enzymatique, l’aminopeptidase P hydrolyse l’acide aminé N-terminal des di-, tri- et oligopeptides mais uniquement s’ils sont liés à la proline, tandis que l’aminopeptidase A catalyse l’hydrolyse des acides aminés acides terminaux tels que le glutamate et l’aspartate.
- Les endopeptidases clivent les chaînes peptidiques en interne, donnant des peptides plus petits de longueur de chaîne variable.
- Une seule dipeptidase existe également comme enzyme de bordure de brosse.
L’entéropeptidase, également connue sous le nom d’entérokinase, est une autre enzyme de bordure en brosse qui a l’activité importante de catalyser l’activiation du trypsinogène en trypsine, l’une des principales protéases du pancréas. L’entéropeptidase est présente le plus abondamment dans le duodénum.
Lipases
Un certain nombre de lipases sont présentes dans la bordure en brosse de l’intestin grêle. Ceux-ci comprennent la phospholipase B1, la céramidase neutre et la sphingomyélinase alcaline.