Posts Tagged ”Mo theory; sykloaddition; organic chemistry; HOMO; LUMO; conjugated system”
yksi haastavimmista käsitteistä konjugoituneen järjestelmän reaktioissa on molekyyli orbital interactions, or Mo theory. Perusasiat tämän periaatteen voi olla vaikea ymmärtää, mutta on erittäin informatiivinen ennustamaan oikea reaktio olosuhteet ja tuloksen reaktio, jos ymmärrät niitä, mikä antaa sinulle merkittävän edun tulevaisuudessa tietokilpailuja ja tentit. Me Studyorgossa olemme laatineet yksinkertaisen selityksen MO-teorian perusteista, jotka auttavat sinua opintovalmisteluissa.
Mo-teorian periaatteet
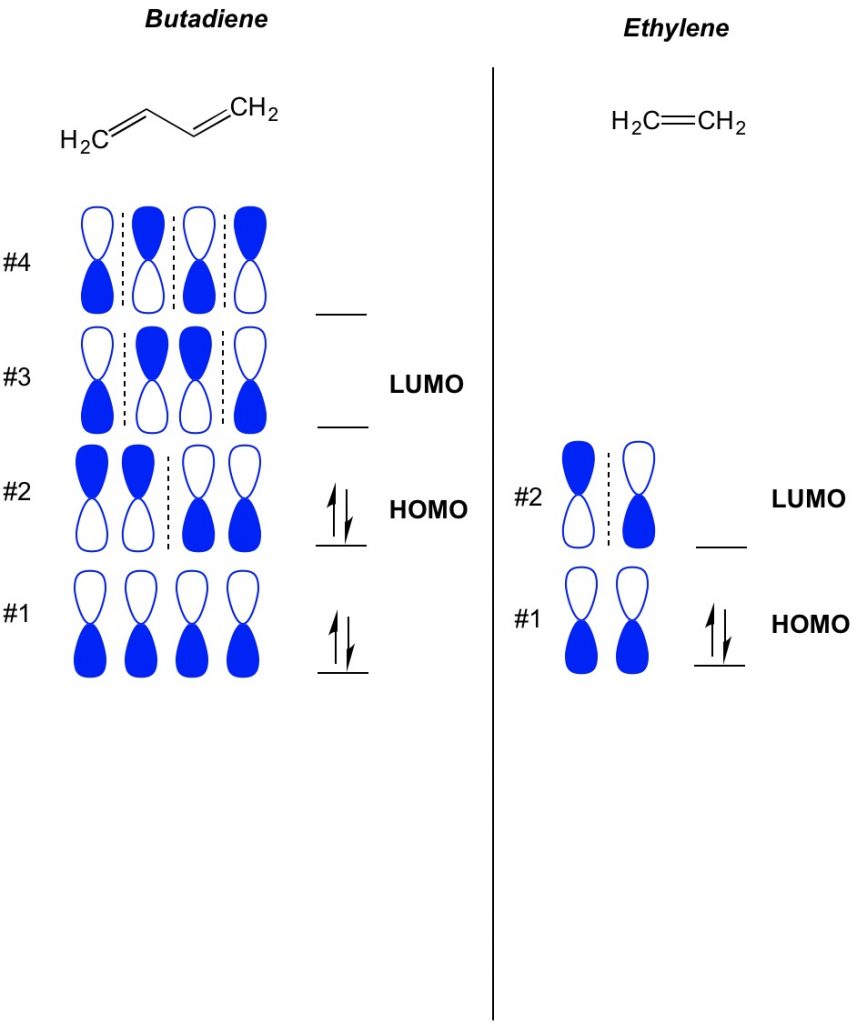
Mo-teorian peruskäsite on kuvata pi-sidosjärjestelmissä esiintyvien orbitaalien vaihtelevia kuvioita. Kuvaamme atomin ympärille keskittyneen käsipainon orbitaalin jokaisen puoliskon suunnan olevan rohkea tai avoin. Muista, on liimaus ja antibonding orbitaalit. Pohjimmiltaan orbitaalit, joilla on pienempi määrä solmuja (Kytkimet suuntaan käsipainon orbitaalin, joka näytämme kanssa katkoviivalla) käyttäytyvät enemmän kuin liimaus orbitaalit, kun taas orbitaalit, joilla on suurempi määrä solmuja käyttäytyvät kuin anti-liimaus orbitaalit. Voit määrittää, mitä orbitaalit ovat miehitetty teidän molekyyli, yksinkertaisesti laskea, kuinka monta pi sidoksia sinulla on konjugoitu järjestelmä. Alla on esimerkki butadieenista. Sillä on 4 pi-elektronia, joten täytämme ensin pienimmät molekyyliorbitaalit, kaksi kullakin orbitaalilla. Näin ollen butadieenin korkein miehitetty molekyyliorbitaali eli HOMO on #2. Tämän seurauksena butadieenin alin käyttämättömänä oleva molekyyli-obitaali eli LUMO on #3. Voimme laajentaa tämän eteeniin ja nähdä, että 2 pi-elektronilla molekyyliorbitaali #1 on HOMO ja molekyyliorbitaali #2 on LUMO.
Sykloadditiot Mo-teoria
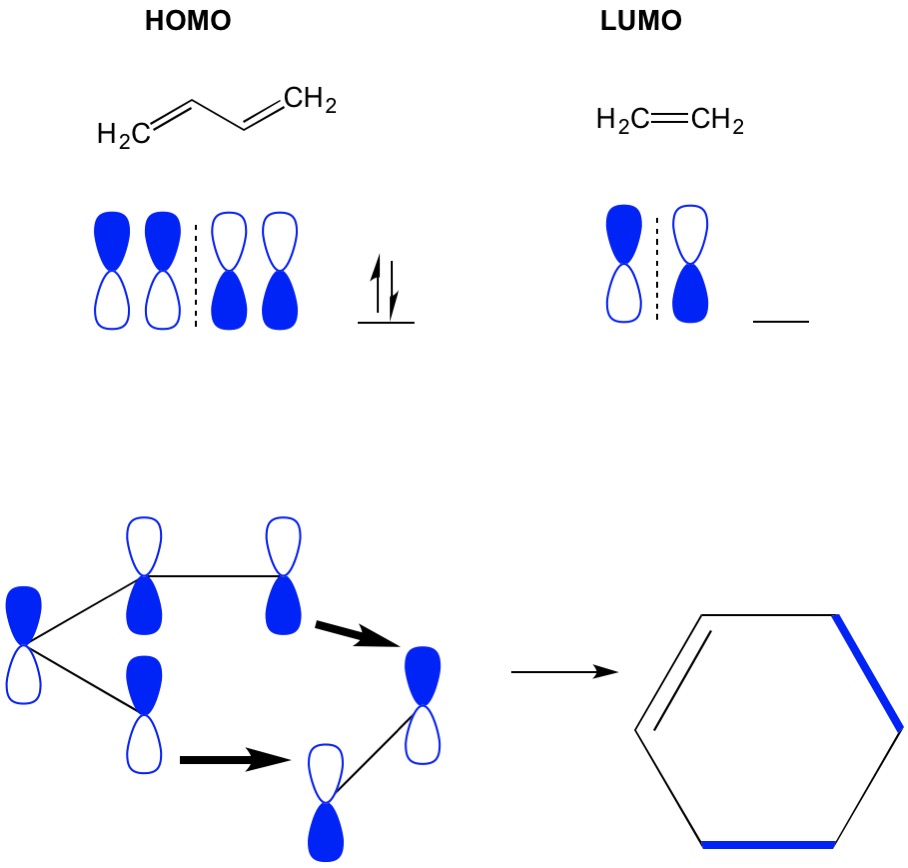
muista, että sykloadditioreaktiot kuvaavat uusien C-C sigma-sidosten muodostumista pi-elektronien uudelleenjärjestelyn kautta konjugoituneessa systeemissä. Siksi meidän on käytettävä pi-elektronien molekyyliorbitaaleja reaktion ajamiseen. Otetaan butadieenin reaktio eteenin kanssa, yksinkertaisimmillaan Diels Alder-reaktio (4+2 sykloadditiota). Aloitamme kaikkein konjugoituneimmasta molekyylistä, butadieenista ja tutkimme sen homoa. Sitten katsomme vähiten konjugoitunutta molekyyliä, etyleeniä ja tutkimme sen lumoa. Miksi? Tarvitsemme homon elektroneja virtaamaan molekyylistä toiseen, joten meidän on käytettävä LUMO-orbitaalia, jota ei ole varattu tähän prosessiin. Näemme, että solmut HOMO ja LUMO yhdenmukaistaa; se on avoin ja suljettu puolikkaat käsipainot yhdenmukaistaa. Tämä johtaa eteenpäin-reaktioon ja tuotteen, syklohekseenin, muodostumiseen.
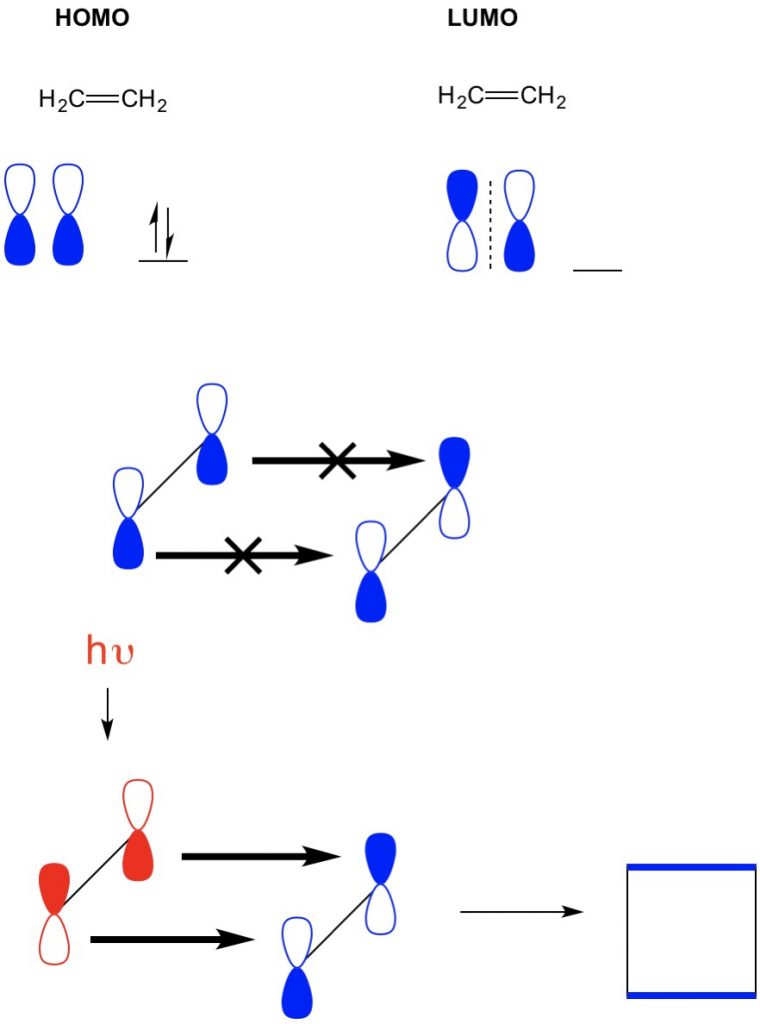
kuitenkin toisessa esimerkissä, jossa meillä on a (2+2 sykloadditio), näemme eteenin HOMO-ja LUMO-arvot eivät ole linjassa, mikä kieltää reaktion. Meillä on kuitenkin kyky virittää elektroneja homolta korkeammalle orbitaalille valon (hv) tai lämmön avulla, jolloin HOMO muuttuu. Tarkastelemme tätä käsitettä yksityiskohtaisesti edellisessä artikkelissa. Tällöin kiihtyneen eteenin HOMO ja maatilan eteenin LUMO asettuvat vastakkain ja reaktiossa syntyy syklobutaania.
toivomme, että tämä kuvaus on auttanut selventämään näitä Mo-teorian käsitteitä. Tämä on esimerkki selkeistä ja yksinkertaisista selityksistä, joita olemme valmistelleet yli 175 reaktiolle, joita on yleisesti nähty Orgo1 – ja Orgo2-kursseilla. Ilmoittaudu jo tänään opintovalmistelutarpeisiisi!