Orgaaninen kemia: Enantiomeerit ja Diastereomeerit
yhdisteet, joissa on useampi kuin yksi Stereosentteri
olemme nähneet, että enantiomeerit ovat stereoisomeereja, jotka eivät ole päällekkäisiä toistensa peilikuvia. Tähän mennessä olemme käsitelleet vain yhdisteitä, jotka sisältävät vain yhden stereogeenisen Keskuksen.Näille yhdisteille voimme tuottaa enantiomeerin muuttamalla konfiguraatiota kyseisessä stereokentässä; toisin sanoen enantiomeerit eroavat toisistaan vain tilajärjestelyiltään stereokentässä.
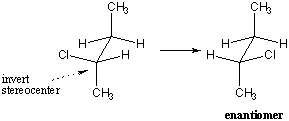
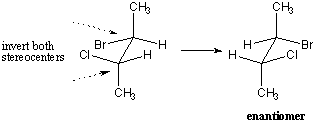
Mitä tapahtuu, kun tarkastellaan molekyylejä, joissa on useampi kuin yksi stereokeskus? On käynyt ilmi, että tällaisen molekyylin peilikuva on kääntänyt kaikki stereokentät ylösalaisin. Näin ollen tällaisen molekyylin enantiomeerilla on täsmälleen päinvastainen konfiguraatio jokaisessa stereokeskuksessa. Jokainen (R) kokoonpano tulee (s), ja päinvastoin.
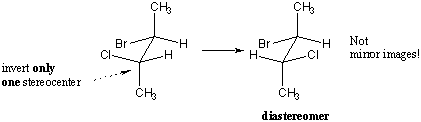
mielenkiintoinen tapaus kuitenkin tapahtuu, kun vain osa stereokentistä on ylösalaisin. Stereoisomeerit, jotka eroavat joissakin stereokentissä mutta eivät toisissa, eivät ole peilikuvia, joten ne eivät ole enantiomeerejä. Sen sijaan ne ovat diastereomeerejä. Diastereomeeri on yksinkertaisesti mikä tahansa stereoisomeeri, joka ei ole enantiomeeri. Teknisesti cis-trans-isomeerit ovat diastereomeerejä. Tyypillisesti termi on kuitenkin varattu stereoisomeereille, jotka eroavat joissakin mutta eivät kaikissa stereokentissä.
seuraavan esimerkin pitäisi auttaa selventämään tässä luvussa tähän mennessä esitettyä stereokemiallista ammattikieltä koskevia epäselvyyksiä. Tarkastellaan 2-bromi-3-klooributaania, jonka stereokentät ovat C2: ssa ja C3: ssa. Yleensä molekyylissä, jossa on n-stereosenttereitä, on 2^n stereoisomeeriä, joten 2-bromi-3-klooributaanille on yhteensä neljä vaihtoehtoa:
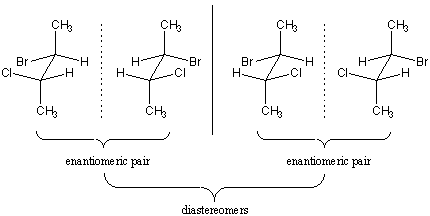
jokainen 2-bromi-3-klooributaanin neljästä stereoisomeeristä on kiraalinen. Enantiomeerejä on kaksi paria. Jokaisella molekyylillä on sen enantiomeeri; kaksi muuta molekyyliä ovat sen diastereomeerejä.
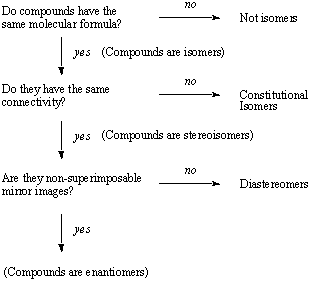
Yhteenveto isomerismista
seuraava vuokaavio tiivistää isomerismin eri tyyppien väliset suhteet: