Heikko polvissa: Miller Fisherin oireyhtymä
Miller Fisherin oireyhtymä (MFS), harvinainen, itseään rajoittava Guillain-Barrén oireyhtymän (GBS) muunnos, on anti-gq1bigg-vasta-aineoireyhtymä, joka vaikuttaa ääreishermostoon ja keskushermostoon.1 akuutti neuromuskulaarinen polyneuropaattinen tila, MFS aiheuttaa nouseva halvaus klassinen esitys triad oftalmoplegia, ataksia ja arefleksia. Tutkijat kuvasivat kliinisen Triadin ensimmäisen kerran vuonna 1932.1 kaksi vuosikymmentä myöhemmin Kanadalainen aivoinfarktiasiantuntija Charles Miller Fisher julkaisi ensimmäisenä vuonna 1956 raportin, jossa kuvattiin kliiniset löydökset ja määriteltiin tila GBS: n rajoitetuksi muodoksi.2
oireita esiintyy useita päiviä, usein talvella ja keväällä, tyypillisesti virusinfektion jälkeen, ja potilailla diplopia on usein yksi ensimmäisistä oireista. Kun potilas esittelee oireita, kuten ajoittainen esotropia, heikentynyt horisontaalinen harrastukset ja kiinteä mydriatic pupillit, ja neurologinen tentti on epänormaali, on aika ajatella GBS, erityisesti MFS. Seuraava tapaus havainnollistaa asiaan liittyviä merkkejä ja oireita ja kuvastaa tyypillistä lopputulosta.
historia
kevätkuukausina veteraanien silmäklinikalle tuotiin 27-vuotias valkoihoinen mies, joka raportoi akuuttia kaksiokulaarista diplopiaa, joka alkoi päivää aiemmin. Potilas totesi, että se oli vakio, mutta tapahtui vain etäkatselussa, jossa esineet oli siirretty vaakasuoraan. Diplopiaan ei liittynyt silmäkipua tai näön hämärtymistä. Hän valitteli myös viimeaikaisia huimausta ja tasapainovaikeuksia. Hän kertoi poskiontelotulehduksesta, jossa oli merkittävää paranasaalista tukkoisuutta, joka alkoi viikkoa ennen kaksoisnäköä. Aikaisemmat silmä-ja sairauskertomukset olivat merkityksettömiä; potilas ei tällä hetkellä käyttänyt mitään lääkkeitä eikä hänellä ollut lääkeallergioita.
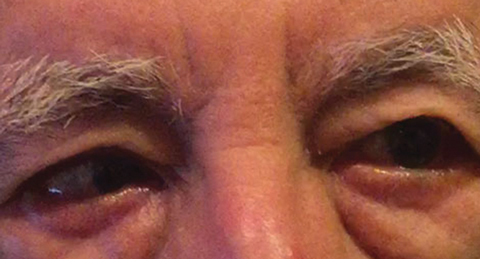
kuva. 1. Perustason tutkimuksen jälkeiseen erotusdiagnoosiin sisältyi osittainen oikean CN VI: n halvaus, joka voi viitata verisuonisairauteen, kuten tässä toisessa potilaassa. Klikkaa kuvaa suuremmaksi. Kuva: Michael DelGiodice, OD
diagnostiset tiedot
lähtötason tutkimuksessa korjaamattomia näkökykyjä oli 20/20-2 OD ja 20/25-2 OS. Pupillit olivat 5 mm yhtä pyöreitä ja reagoivat valoon ilman afferenttia pupillivikaa. Ekstraocular motilities olivat täynnä, sileä ja tarkka molemmissa silmissä ilman rajoituksia. Cover-testi etäältä paljasti ajoittaisen neljästä kuuteen prisman diopterin oikean esotropian ensisijaisessa katseessa, joka esiintyy noin 50% ajasta. Cover-testin suorittaminen nearissa paljasti neljän prisman diopteriesophorian ensisijaisessa katseessa ilman tropiaa.
vaikka tässä tapauksessa ei tehdä, lääkärin tulisi kattaa testi ensisijaisella, oikealla ja vasemmalla katseella. Potilailla, joilla on diplopia, kallon hermo kuusi (CN VI) halvaus ilmenee ei – comitant poikkeama, pahempi oikealle tai vasemmalle katse, riippuen siitä, millä puolella halvaus on. Dekompensoiva phoria taas osoittaa kilpailevaa poikkeamaa.
taittovirhe oli -0, 50 d sphere OD ja -0, 75 D sphere OS ja näkö oli korjattavissa 20/20 kummassakin silmässä. Silmänsisäiset paineet olivat normaalirajoilla molemmissa silmissä. Etu-ja takasegmentistä ei löytynyt merkkejä oikeasta ja vasemmasta silmästä. Näköhermot näyttivät terveiltä cup-to-disc-suhteen ollessa 0,15 molemmissa silmissä.
Differentiaalidiagnooseihin kuuluivat osittainen oikean CN VI: n halvaus (Kuva 1), myasthenia gravis, puristava prosessi ja dekompensoiva etäisyyden esoforia, joka aiheutti ajoittaisen oikean esotropian. Potilas kiisti aiemman binokulaarisen diplopian.
aivojen ja kiertoratojen kuvantaminen määrättiin silmäklinikalla sulkemaan pois aivoepäselvyydet, mukaan lukien puristava leesio. Tietokonetomografia (CT) skannaa aivojen ja kiertoratojen suoritettiin ja tulkitsi henkilöstön neuroradiologi. TT valittiin magneettikuvauksen (MK) sijaan ajoituksen ja saatavuuden vuoksi; testaus ja tulokset voitiin saada samana päivänä TT: n kanssa klinikalla tuntien jälkeen. Tulokset olivat mitättömiä ilman merkkejä kallonsisäisestä verenvuodosta, puristusleesiosta tai akuutista infarktista.
tt paranasaalisista sivuonteloista paljastui keskivaikea tai vaikea krooninen paranasaalinen sivuontelosairaus ja oikean yläleuan sivuonteloiden täydellinen samentuminen. Kiertoradalle ei ollut ulospääsyä. Potilaan omalääkärille ilmoitettiin potilaan oireista, silmätutkimuslöydöksistä ja CT-kuvantamistuloksista ja hän aloitti yläleuan poskiontelontulehdushoidon oraalisella atsitromysiiniannospakkauksella ja ohjeisti potilasta seuraamaan tilannetta silmäklinikalla.
potilas palasi viisi päivää myöhemmin suun kautta annetun atsitromysiinikuurin päätyttyä ja totesi, ettei etädiplopia parantunut; lisäksi hänellä ilmeni merkittävää valonarkuutta ja periokulaarista kipua molempien silmien ympärillä. Potilaan mukaan myös hänen kävelyn epätasapainonsa ja kävelyvaikeutensa pahenivat. Tutkimuksessa parhaiten korjatut näkökyvyt pysyivät 20/20 oikeassa ja vasemmassa silmässä. Pupillit laajenivat 8, 5 mm: n nopeudella, eikä kummassakaan silmässä ollut reaktiivisuutta valolle (kuva 2). Ekstraocular motilities paljasti sivusuunnassa rajoitus kipua liikkeen oikeassa silmässä ja mediaalinen rajoitus kipua liikkeen vasemmassa silmässä sopusoinnussa oikean katseen halvaus (kuva 3). Vaaka-ja pystysuuntaiset takaa-ajot olivat epätarkkoja ja nykiviä liikkeitä. Etu-ja takasegmentin löydökset jäivät merkityksettömiksi.
Erotusdiagnooseja oftalmologisen tutkimuksen jälkeen olivat vasen silmätulehdus, oikeanpuoleinen silmätulehdus ja oikeanpuoleinen silmätulehdus sekä vasemmanpuoleinen silmätulehdus, mikä saattoi selittää silmän ulkopuolisen motiliteetin löydökset. Muita eroja ovat keskiaivojen leesio tai myasthenia gravis. Erotusdiagnooseja pupillien laajentumiseen ovat kolmas hermo (CN III) halvaus, trauma ja farmakologinen laajeneminen. Potilaalla ei ollut muita löydöksiä, jotka viittaisivat kolmanteen hermovaurioon, ja hän kiisti trauman tai altistumisen lääkeaineille.
potilas ohjattiin neurologiaan jatkotutkimuksiin. Neurologiset tutkimukset kertoivat, että potilas oli täysin virkeä ja suuntautunut ilman kasvotuntemuksen heikkenemistä. Potilaalla ilmeni lievää ataksiaa, johon liittyi vaikeuksia kävellä yhdessä ja seisoa kyykkyasennossa. Proksimaalinen heikkous sekä ylä-että alaraajoissa ja epänormaalit refleksit olivat läsnä. Kaikki aistit olivat kunnossa. Aivojen ja kiertoratojen magneettikuvaus ja magneettikuvaus (MRA) olivat merkityksettömiä. Aivo-selkäydinnesteproteiini oli koholla annoksella 75 mg/dL (viitealue: 15 mg/dL-45 mg / dL), eikä muita poikkeavuuksia esiintynyt. Elektromyogrammitesteissä ei havaittu poikkeavuuksia hermojen johtumisessa selkärangasta jalkoihin ja käsiin.
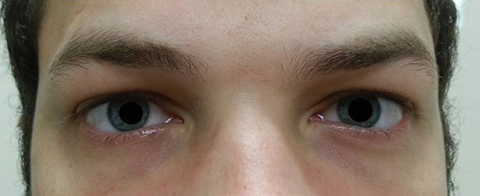
viikuna. 2. Potilaan pupillit olivat laajentuneet 8,5 mm, eikä oikeassa tai vasemmassa silmässä ollut reaktiivisuutta. Klikkaa kuvaa suuremmaksi.
diagnoosi
potilaalla oli akuutteja diplopian, ataksian ja arefleksian oireita. Kun otetaan huomioon ajoittainen oikea esotropia, heikentynyt horisontaalinen harrastuksia, kiinteä mydriatic oppilas, lievä ataksia ja epänormaalit refleksit neurologinen tentti ja kohonnut aivo-selkäydinnesteen proteiini, diagnoosi MFS tehtiin. Potilas vietiin sairaalaan tarkkailemaan mahdollisia komplikaatioita. Potilaalle annettiin silmälappu, joka peitti oikean silmän diplopian tarpeen mukaan.
Miller Fisherin oireyhtymälle ei ole tällä hetkellä julkaistuja diagnostisia kriteerejä. Diagnoosi tehdään yleensä esittämällä kliinisen Triadin yhdessä kuvantamisen ja aivo-selkäydinnestetutkimusten kanssa. Magneettikuvaus ei yleensä ole merkittävä tila, vaikka joissakin tutkimuksissa on todettu keskiaivojen, pons ja alemman ydinmetallin keskeisiä leesioita. Elektrofysiologiset tutkimukset osoittavat perifeeristen aistien johtumisen vähentyneen tai poikkeavan.
aivo-selkäydinnesteen proteiini on usein koholla, eikä muita poikkeavia löydöksiä ole. Merkittävässä tutkimuksessa 64,4%: lla MFS-potilaista todettiin kohonnut selkäydinnesteproteiini.8 positiivinen anti-GQ1b IgG vasta-ainetesti mahdollistaa lopullisen diagnoosin. Yhdessä tutkimuksessa anti-GQ1b IgG-vasta-aineita oli jopa 95%: lla potilaista, joilla oli kyseinen sairaus, mutta verrokeilla niitä ei ollut.3
neurologi diagnosoi potilaalla MFS: n oftalmoplegian, ataksian ja arefleksian kliinisen Triadin, aivojen mittaamattoman magneettikuvauksen ja MRA: n sekä kohonneen aivo-selkäydinnesteproteiinin perusteella. Siksi tässä tapauksessa ei tehty anti-GQ1b IgG-vasta-ainetestiä.
myös Guillain-Barrén oireyhtymässä ja Bickerstaffin aivotulehduksessa on havaittu useita MFS: n kliinisiä piirteitä, mikä tekee diagnoosista haastavan. Potilailla, joilla on vain Guillain-Barré, on raajojen heikkoutta, aistinvajausta, kallon neuropatiaa ja arefleksiaa, johon ei liity silmään liittyviä oireita. Bickerstaffin aivotulehdusta sairastavilla potilailla esiintyy tyypillisesti oftalmoplegiaa, ataksiaa, Hyper-refleksiaa ja tajunnan häiriöitä. Koska useita oireita ja merkkejä on läsnä kaikissa kolmessa olosuhteissa, anti-GQ1b IgG vasta-ainetitteri testaus on hyödyllistä enemmän lopullisen diagnoosin. Anti-GQ1b IgG-vasta-aine on positiivinen valtaosalla Miller Fisherin oireyhtymää sairastavista potilaista verrattuna 66 prosenttiin Bickerstaffin aivotulehdusta sairastavista ja 26 prosenttiin Guillain-Barrén oireyhtymää sairastavista.16
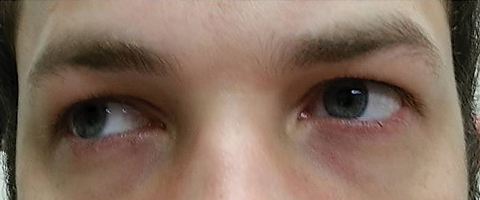
viikuna. 3. Ekstraocular motilities paljasti rajoituksia dekstroversion. Klikkaa kuvaa suuremmaksi.
hoito ja seuranta
potilas arvioitiin ottamista seuraavana päivänä, jolloin hän totesi, ettei hänellä ole näkömuutoksia tai tasapainotilan paranemista. Kiikarin diplopia oli edelleen vakio, joten oikea silmä pysyi paikattuna. Silmäkipuja kaukokatseineen ja nopeine silmänliikkeineen oli edelleen. Suppeassa vuodeosastotutkimuksessa parhaiten korjatut näkökyvyt pysyivät 20/20 oikeassa ja vasemmassa silmässä. Pupillit laajenivat 8.0mm molemmissa silmissä minimaalisella reaktiivisuudella, joka parani hieman edellisestä päivästä. Värinäkö oli normaali oikeassa ja vasemmassa silmässä. Ekstraocular motilities olivat täynnä kaikissa quadrants kipua vielä läsnä pitkälle vaakasuoraan katseet. Horisontaaliset takaa-ajot pysyivät sakkadisina nykivillä liikkeillä ja loppupisteen nystagmuksella. Näköhermot näyttivät terveiltä erillisillä marginaaleilla ja kuppi-levy-suhde 0,15 molemmissa silmissä.
kahden päivän kuluttua potilas totesi kaikkien oireiden parantuneen ja että hänen silmänsä ”voivat tänään paremmin kuin aikoihin.”Sekä silmäkipu että kiikarin diplopia hävisivät. Näkökyky pysyi 20/20 oikeassa ja vasemmassa silmässä. Pupillien koko oli 7,5 mm pimeässä ja 7,0 mm valossa, ja molempien silmien suora ja yksimielinen vaste oli parantunut. Ekstraocular motilities olivat täynnä kaikissa quadrants ilman silmäkipuja. Horisontaaliset takaa-ajot pysyivät sakkadisina nykivillä liikkeillä ja loppupisteen nystagmuksella. Neurologinen tutkimus paljasti epänormaalit refleksit, jotka pysyivät vakaina. MFS: n hoitovaihtoehtoja ovat plasmafereesi ja laskimonsisäinen (IV) immunoglobuliini IgG, mutta näitä ei otettu huomioon oftalmoplegian ja ataksian paranemisen vuoksi.
neljä päivää myöhemmin potilas ilmoitti, että kaikki oireet olivat edelleen paranemassa, ja tietokoneen käytön aikana oli jonkin verran vaikeuksia keskittyä ja seurata tilannetta. Tasapaino korjaantui 80-prosenttisesti, eikä etäisyysdiplopioita juuri esiintynyt. Acuities pysyi 20/20 OU. Oppilaat olivat 5,5 mm pimeässä ja 4,0 mm valossa 3+ suoralla ja konsensusvasteella OU. Ekstraocular motilities olivat täynnä kaikissa quadrants ilman silmäkipuja. Horisontaalisia takaa-ajoja parannettiin, eikä niissä ollut sakkaavia liikkeitä. Monokulaarinen majoitus oli normaali, joka mitattiin 8,5 ja 9 Prisma diopteria OD ja OS vastaavasti.
viikkoa myöhemmin potilas ilmoitti näkökykynsä palautuneen lähes normaaliksi ilman diplopiaa ja lieviä keskittymis-ja seurantavaikeuksia. Tasapaino ratkesi 100-prosenttisesti. Näkökyky pysyi 20/20 oikeassa ja vasemmassa silmässä. Pupillit olivat 5,5 mm pimeässä, 4,0 mm valossa 4 + suoralla ja konsensusvasteella OU. Ekstraocular motilities olivat täynnä kaikissa quadrants ilman silmäkipuja. Horisontaaliset harrastukset paranivat, eikä niissä havaittu sakkadisia liikkeitä. Silmäterveydellä ei ollut merkitystä.
hoito keskeytettiin, koska oftalmoplegia ja ataksia hävisivät ja arefleksia oli vakaa. Täydellinen toipuminen opthalmoplegiasta ja ataksiasta kesti kaksi viikkoa. Hoitoon kuului tarkka seuranta ja seuranta neljän viikon kuluttua; potilasta neuvottiin palaamaan aikaisemmin, jos jokin hänen oireistaan palaisi.
kliiniset ominaisuudet
hyvin kuvatuissa MFS-tutkimuksissa kaikilla potilailla oli kliininen triadi oftalmoplegia, ataksia ja arefleksia.4,5 oireet alkavat tyypillisesti useiden päivien aikana, ja potilaat kärsivät virusinfektiosta yhdestä neljään viikkoa ennen kliinisten oireiden alkamista.4,5 Erään tutkimuksen mukaan, johon osallistui 50 sairasta potilasta, infektion alkamisen ja neurologisten oireiden kehittymisen välinen aika on keskimäärin kahdeksan päivää.4 muita MFS: n merkkejä ovat epäselvä puhe, nielemisvaikeudet ja epänormaali kasvonilme, johon liittyy kyvyttömyys hymyillä tai viheltää.
Oftalmologiset ominaisuudet. Lääkärien on tarkkailtava mydriaasia, kannen vetäytymistä, akuutin kulman sulkeutumista ja diplopiaa, joka on seurausta CN III: een, IV: ään ja VI: een vaikuttavista hermopaloista.3, 8, 10, 22, 24 Diplopia on yleisin silmävamma, jota on raportoitu monissa MFS-tutkimuksissa.8, 16, 25, 26, 27 diplopiaa raportoitiin myös ensioireena 38, 6%: lla 223 potilaasta yhdessä merkittävässä tutkimuksessa ja 65%: lla 466 potilaasta toisessa tutkimuksessa.8, 27 toisessa tutkimuksessa 100%: lla potilaista esiintyi ulkoista oftalmoplegiaa, kun taas sisäistä oftalmoplegiaa oli 35%: lla potilaista.27 ulkoinen oftalmoplegia tarkoittaa ulkoisten silmänulkoisten lihasten heikentymistä. Sisäinen oftalmoplegia tarkoittaa pupillin sulkijalihaksen ja Sädelihaksen heikentymistä. Täydellinen oftalmoplegia vaikuttaa sekä ulkoisiin että sisäisiin lihaksiin.
retrospektiivisessä tutkimuksessa, johon osallistui 19 MFS-potilasta, kaikilla oli yksi tai useampi hermopalsius, joka vaikutti ekstrasokulaarisiin lihaksiin.25 muut tutkimukset osoittavat, että MFS-potilailla voi esiintyä useita kallon hermopalsioita, jotka voivat ilmetä kahdenvälisesti.22,24,25 yksi yleinen havainto anti-GQ1b IgG-positiivisissa häiriöissä on sieppausvaje, joka vastaa yksipuolista tai kahdenvälistä CN VI-vammaa.26,28 sisäinen oftalmoplegia aiheuttaa pupillien mydriaasia, jossa pupillien supistuminen valolle ja / tai lähellä oleva stimulaatio voi vaihdella minimaalisesta poissaolevaan.8, 26 yhdessä raportissa mydriaasia esiintyi 42%: lla potilaista. CN VII: tä esiintyi noin 45, 7%: lla MFS-potilaista, jotka aiheuttivat kasvojen heikkoutta, kyvyttömyyttä hymyillä tai viheltää.8
ataksia. Tämän kliinisen ominaisuuden syytä MFS: ssä ei täysin tunneta. Keskustelua on siitä, johtuuko ataksia toimintahäiriöstä keskitetysti pikkuaivoissa vai perifeerisesti. Ensimmäinen hypoteesi, jota tohtori Fisher ehdotti, oletti Ia-afferenttien neuronien osallisuuden.2 Tätä tuki toinen tutkimus vuosikymmeniä myöhemmin, joka osoitti poikkeavuuksia Ia-afferent kuidut MFS.11 epänormaaleja ääreishermo-oireita on myös ehdotettu, ja lihasjänteiden proprioseptiivisen syötön ja nivelreseptorien kinesteettisen informaation välillä on epäsuhta.12
on myös saatu näyttöä siitä, että ataksia on lähtöisin pikkuaivoista. Suurin osa anti-GQ1b IgG-vasta-aineesta pikkuaivoissa havaittiin käyttämällä ihmisen pikkuaivojen immunosytokemiallista värjäystä, ja se vahvistettiin edelleen western blot-tutkimuksissa, joissa todettiin lisääntynyt anti-GQ1b IgG-vasta-aine MFS-potilailla verrattuna verrokkiin, vaikka pikkuaivojen vaikutusmekanismia ei ole tutkittu.13,14 vuonna 2015 tutkijat julkaisivat TAPAUSRAPORTIN MFS-potilaasta, jolle tehtiin magneettikuvaus. N-asetyyliaspartaatti/kreatiini-suhde oli alentunut, mikä viittaa pikkuaivojen toimintahäiriöön, joka palautui normaaliksi 2, 5 kuukauden kuluttua toipumisesta.23
arefleksia. Tämä kliininen ominaisuus, yhdessä syvien jännerefleksien masennuksen kanssa, on merkki ääreishermoston osallistumisesta MFS: ään. Elektrofysiologiset tutkimukset ovat vahvistaneet epänormaalin ääreishermoston johtumisen GBS: ssä ja MFS: ssä.3 yhdessä tutkimuksessa 81, 6%: ssa MFS-tapauksista esiintyi arefeksia.8 toinen merkittävä tutkimus osoitti, että kaikki potilaat kokivat arefleksiaa, joka oli edelleen läsnä kuuden kuukauden kuluttua sen alkamisesta.4
kuinka yleinen MFS on?
Miller Fisherin oireyhtymästä on vain vähän epidemiologista tietoa. MFS: n esiintyvyys on melko harvinainen, esiintyy 0,09: llä 100 000: ta ihmistä kohti vuosittain.3 MFS esiintyy yleisemmin potilailla, joilla on Guillain-Barrén oireyhtymä, 3%: sta 25%: iin.4,6,7 tätä yhteyttä esiintyy enemmän Kaukoidästä polveutuvilla potilailla, mikä viittaa MFS: n mahdolliseen geneettiseen komponenttiin. Keskimääräinen alkamisikä on 43 vuotta, ja välillä 13-78, 5 MFS esiintyy miehillä kaksi kertaa enemmän kuin naisilla, ja suhde on kaksi-1, 03, 5 MFS esiintyy enemmän talvi-ja kevätkaudella.5,6,8 tarkka syy kausiluonteinen mieltymys ei ole määritetty, mutta on todennäköisesti liittyy post-infektoiva luonne kunnossa bakteeri-ja virusinfektioiden on todettu laukaisevan autoimmuunivaste aiheuttaa tuotannon anti-GQ1b IgG vasta MFS.
Patofysiologia
Miller Fisherin oireyhtymän patofysiologiaa ei tunneta hyvin; immunologisista ja histologisista tutkimuksista on kuitenkin olemassa useita hypoteeseja. On tunnettua, että tila kuuluu anti-GQ1b IgG-vasta-aineoireyhtymien kirjoon yhdessä Guillain-Barrén oireyhtymän ja Bickerstaffin aivotulehduksen kanssa.
gangliosidi GQ1b on ryhmä monimutkaisia lipidejä, jotka osallistuvat keskus-ja ääreishermostoon. GQ1b on aivohermojen plasmakalvorakenteen komponentti, joka toimittaa ekstrasokulaarisia lihaksia ja osallistuu solujen toimintaan presynaptisessa neuromuskulaarisessa liitoksessa.
edeltävän laukaisevan infektion autoimmuunimekanismi tuottaa anti-GQ1b IgG-vasta-aineen, joka vahingoittaa gangliosidi GQ1b: n toimintaa aiheuttaen demyelinaation. Histologisissa tutkimuksissa on havaittu demyelinaatiota ja aksonaalista turvotusta perifeerisissä ja okulomotorisissa kallohermoissa.Anti-GQ1bIgG-vasta-aine puuttuu terveiltä potilailta, mutta positiivinen yli 90%: lla MFS-potilaista.16, 25
bakteeri-ja virusinfektioiden on todettu laukaisevan autoimmuunivasteen ja aiheuttavan anti-GQ 1b IgG-vasta-aineen tuotannon. Seuraavia mykoplasma-infektioon liittyneitä taudinaiheuttajia ovat mykoplasma-keuhkokuume, HIV, kampylobakteeri jejuni, Hemophilus-influenssa, Helicobacter pylori ja Epstein-Barr-virus.4, 16 eräässä raportissa, jossa tarkasteltiin 466: ta MFS-potilasta, 90 prosentilla oli edeltävä sairaus, mukaan lukien ylähengitystieinfektio, ripuli tai molemmat.
ennuste ja hoito
Miller Fisherin oireyhtymä on itseään rajoittava sairaus, jonka ennuste on yleisesti ottaen positiivinen. Oireet yleensä paranevat muutaman viikon kuluttua ja täydellinen toipuminen tapahtuu tyypillisesti kahden tai kolmen kuukauden kuluttua. Yhdessä tutkimuksessa toipuminen alkoi keskimäärin 13 vuorokauden kuluttua oireiden alkamisesta, ja oftalmoplegia ja ataksia hävisivät kokonaan kuudessa kuukaudessa.4, 5 pahenemisvaihetta on todettu alle 3%: ssa tapauksista.4, 5
vaikka MFS on tyypillisesti itsestään rajoittuva, tilaan on liittynyt systeemisiä komplikaatioita. YLÄHENGITYSTIEINFEKTIOITA on todettu 56-76 prosentilla MFS-potilaista, mikä voi edetä koneellista ilmanvaihtoa vaativaan hengitysvajaukseen.Muita harvinaisia vakavia komplikaatioita ovat kardiomyopatia, maitohappoasidoosi ja kooma.3, 20
MFS: n hoitovaihtoehtoja ovat plasmafereesi, laskimonsisäinen immunoglobuliini IgG ja seuranta ilman hoitoa. Tutkijat olettavat, että plasmafereesi ja IV IgG saattavat nopeuttaa tehokkaasti resoluutioaikaa, koska vasta-aine Gq1b on IgG: n luokkaa ja IgG: n puoliintumisaika on noin 21 päivää, mikä on pidempi kuin IgM: n ja IgA: n 5-6 päivän puoliintumisaika.Näitä hoitoja ei kuitenkaan ole tutkittu satunnaistetuissa kaksoissokkoutetuissa lumelääkekontrolloiduissa tutkimuksissa.
yhdessä retrospektiivisessä tutkimuksessa ei voitu osoittaa plasmafereesin muuttaneen täydellisen paranemisen mahdollisuutta ja aikaa ataksian ja silmäplegian häviämiseen; plasmafereesihoidon alkamisajankohta ei myöskään vaikuttanut oireiden häviämisaikaan eikä oireiden vaikeusasteeseen niiden alkaessa. Erään tapausselostuksen mukaan plasmafereesi on kuitenkin aiheellinen silloin, kun potilaalla on voimakas ataksia, motorinen ja hengityselinten vajaatoiminta.
potilaita tulee seurata tarkasti vakavien systeemisten komplikaatioiden, kuten ylähengitysteiden vajaatoiminnan, kehittymisen varalta. Tutkimukset eivät osoita merkittävää paranemista toipumisaika IV IgG tai plasmafereesi hoito MFS, joten seuranta voi olla lääkärin paras vaihtoehto.
vaikka tila on harvinainen, sen ei tarvitse jäädä diagnosoimatta. Tunnustamalla tärkeimmät kliiniset piirteet harjoittajat voivat paljastaa potilaan oireiden syyn ja saada luottamuksen täydelliseen toipumiseen.
Drs. Wang ja Cantrell ovat Orlandon VA Medical Centerin henkilökunnan optikkoja. Tohtori Cali on Leen VETERAANIKLINIKAN optikko. Kirjoittajat haluavat kiittää Joseph Milleriä, od: tä, Paul Gruossoa, od: tä, ja Vanessa Santosia, OD: tä, avusta tämän käsikirjoituksen kanssa.
1. Collier J. Peripheral neuritis: The Morisa lectures. Edinburgh Med J. 1932: 39: 601-18.
2. Fisher M. epätavallinen muunnos akuutti idiopaattinen polyneuriitti (oireyhtymä oftalmoplegia, ataksia, ja arefleksia). N Eng J Med. 1956:255:57-65.
3. Lo YL, et al. Miller Fisherin oireyhtymän kliininen ja immunologinen kirjo. Lihashermo. 2007:36(5):615-27.
4. Mori M, Kuwabara S, Fukutake T, et al. Miller Fisherin oireyhtymän kliiniset piirteet ja ennuste. Neurologia. 2001:56(8): 1105-6.
5. Mori M, Kuwabara S, Fukutake T, et al. Plasmapharesis and Miller Fisherin syndrome: Analysis of 50 peräkkäistä tapausta. J Neurol Neurosurg Psych. 2002:72:680.
6. Yuan CL, Wang YJ, Tsai CP. Miller Fisherin syndrooma: a hospital based retrospective study. Euro J Neurol. 2000:44(2):79-85.
7. Cheng BC, Chang WN, Chang CS et al. Guillain-Barrén oireyhtymä Etelä-Taiwanissa: kliiniset ominaisuudet, ennustavat tekijät ja hoitotulokset. Euro J Neurol. 2003:10 (6):655-62.
8. Berlit P, Rakicky J. Miller Fisherin syndrooma. Kirjallisuuskatsaus. J kliininen neuro-oftalmologia. 1992:12:57-63.
9. Lyu RK, Tang LM, Cheng SY, et al. Guillain-Barrén oireyhtymä Taiwanissa: kliininen tutkimus, johon osallistui 167 potilasta. J Neurol Neurosurg Psych. 1997:63:494-500.
10. Tatsomoto M, Odaka M, Hirata K, Yuki N. eristetty abducens halsy Guillain-Barrén oireyhtymän alueellisena muunnoksena. J Neurol Sci. 2006:243:35-8.
11. Weiss ja, White JC. 1A afferentin johtumisen korrelaatio Fisherin oireyhtymän ataksian kanssa. Lihashermo. 1986:9:327-32.
12. Das P, Biswash s, et al. Miller Fisher variant of guillain-barré syndrome: a case report and clinical review. Bangabandhu Sheikh Mujib Medical Univer J. 2012:5(1): 69-71
13. Kornberg AJ, Pestronk A, Blume GM, et al. Miller Fisherin seerumin IgG: n pikkuaivojen molekyylikerroksen valikoiva värjäytyminen ja siihen liittyvät oireyhtymät. Neurologia. 1996:47:1317-20.
14. Inoue N, Koh C, Iwahashi T. seerumin antierebellaaristen vasta-aineiden osoittaminen Miller Fisherin oireyhtymää sairastavilla potilailla. Euro J Neurol. 1999:42:230-4.
15. Barontini F, Di Lollo s, Maurri s, Lambruschini P. patologisen prosessin lokalisointi Miller Fisherin oireyhtymässä. Italia J Neurol Sci. 1992:13:221-5.
16. Koga M, Yuki N, Takahashi m, et al. IgA-anti-gangliosidivasta-aineiden läheinen yhteys Guillain-Barrén ja Fisherin oireyhtymissä esiintyvään kampylobakteeri jejuni-infektioon. J Neuroimmunolia. 2003:141:112-7.
17. Guiloff RJ. Miller Fisherin oireyhtymässä. J Neurol Neurosurg Psychiat. 1977:40:801-7.
18. Chikakiya H, Kunishige M, Yoshino h, et al. Viivästynyt motorinen ja sensorinen neuropatia aivotulehdusta sairastavalla potilaalla. J Neurol Sci. 2005:234:105-8.
19. Arakata Y, Yoshimuro M, Kobayashi s, et al. Laskimonsisäisen immunoglobuliinin käyttö Miller Fisherin oireyhtymässä. Brain Develop J. 1993:15:231-3.
20. Matsumoto H, Kobayashi O, Tamura K, et al. Miller Fisher syndrome with transient coma: comparison with bickerstaff ’ s brainstem encephalitis. Brain Develop J. 2002: 24: 98-101.
21. Yeh JH, Chen WH, Chen JR, et al. Miller Fisherin Syndrome with central involvement: successful treatment with plasmapheresis. Therap Aferesis Dialysis J. 1999: 3: 69-71.
22. Papanikolaou T, Cath G, Boothman B, et al. Tapausraportti: akuutti molemminpuolinen silmätulehdus ja pupilaarinen onfleksinen mydriaasi Miller-Fisherin oireyhtymässä, jota hoidetaan laskimoon annettavalla immunoglobuliinilla. J Oftalmoli. 2010; ID 291840 artikla.
23. Sandler RD, Hoggard N, Hadjivassiliou M. Miller-Fisherin oireyhtymä: Onko ataksia keskeinen tai perifeerinen? Pikkuaivot. 2015:2:3.
24. Ejma M, Waliszewska-Prosół M, Hofman A, et al. Etenevä subakuutti Miller-Fisherin syndroomaa hoidettiin onnistuneesti plasmafereesillä. Puolalainen J Neurol Neurosurg. 2015;49(2):137-8.
25. San-Juan OD, Martínez-Herrera JF, Moreno García J, et al. Miller Fisherin syndrooma: 10 vuoden kokemus kolmannen tason keskuksessa. Euro Neurol. 2009; 62: 149-54
26. Snyder LA, Rismondo V, Miller NR. Fisherin muunnos Guillain-Barrén oireyhtymästä (Fisherin oireyhtymä). J Neuroftalmoli. 2009 joulu; 29 (4): 312-24.
27. Ito M, Kuwabara S, Odaka m, et al. Bickerstaffin aivotulehdus ja Fisherin oireyhtymä muodostavat jatkuvan spektrin: kliininen analyysi 581 tapauksesta. J Neurol. 2008;255:674-82.
28. Yuki N. akuutti ekstrasokulaaristen lihasten pareesi, joka liittyy IgG anti-GQ1b-vasta-aineeseen. Ann Neurol 1996;39: 668-72.