amiinien ja pKaH: n emäksisyys
Kvantifioimalla amiinien emäksisyys käyttämällä ”Konjugaattihapon pKa”, alias ”pKaH”
Miten mitataan amiinin emäksisyys? Esimerkki: mikä on vahvempi pohja: pyridiini tai piperidiini?
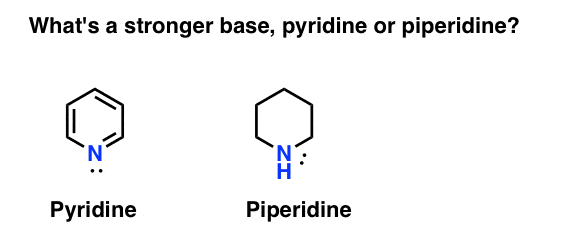
jos sanoit piperidiini, Onneksi olkoon – se on todellakin vahvempi emäs.
mutta miksi? Ja kuinka paljon vahvempi? Miten näihin kysymyksiin voi yrittää vastata? Loppujen lopuksi voimme helposti verrata happojen vahvuutta tutkimalla niiden pKa: ta. Eikö meidän pitäisi pystyä tekemään sama emästen kanssa?
kyllä, tavallaan. Tässä on kaksi keskeistä kohtaa tälle päivälle:
- paras tapa kvantifioida amiinin emäksisyys on tutkia sen konjugaattihapon pKa.
- mitä korkeampi konjugaattihapon pKa, sitä vahvempi emäs.
tässä viestissä näytämme joitakin erityisiä esimerkkejä siitä, miten PKA-arvoja käytetään amiinien basisiteetin vertailuun.
myöhemmässä postauksessa tarkastellaan sitten joitakin keskeisiä suuntauksia amiinien basisiteetin taustalla.
Sisällysluettelo
- pikakatsaus: happoja, emäksiä, Konjugaattihappoja ja Konjugaattiemäksiä
- käyttäen pKa: ta happamuuden mittaamiseen
- käyttäen pKa: ta amiinien emäksisyyden määrittämiseen
- ”Konjugaattihapon pKa” voidaan lyhentää muotoon ”pKaH”
- käyttämällä pKaH: ta amiinien suhteellisen emäksisyyden määrittämiseen
- joitakin varoituksen sanoja amiinien PKA-arvot
- mitkä keskeiset tekijät ohjaavat amiinien emäksisyyttä?
- toteaa
1. Nopea Arvostelu: Hapot, emäkset, Konjugaattihapot ja Konjugaattiemäkset
käydään ensin nopeasti läpi joitakin basisiteetin perusasioita.
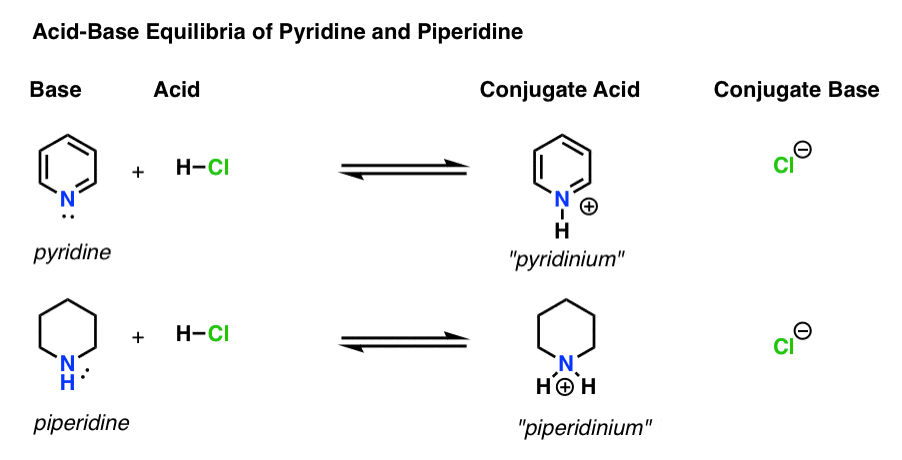
jokaisessa happo-emäs-reaktiossa on neljä toimijaa.
- emäs on laji, joka luovuttaa yksinäisen parin h+: lle (tunnetaan myös nimellä ”protoni” tai ”vetyydin”). Siinä Uusi sidos H: hon muodostuu (esim. pyridiini alla)
- konjugaattihappo on se laji , jonka jälkeen emäs muodostaa sidoksen H: hon (esim. ”pyridinium”, jolla on uusi N–H-sidos)
- happo on laji, joka menettää H+: n. Siinä Side H: hon katkeaa (esim. H-Cl)
- konjugaattiemäs on laji, joka jää jäljelle, kun happo luovuttaa h+ emäkselle (esim.Cl -)
tässä on pyridiini ja piperidiini toiminnassa. Muodostuvia ja katkeavia siteitä seuraamalla voi tunnistaa jokaisen näyttelijän.
2. Käyttämällä PKA: ta happamuuden mittaamiseen
jokainen happo-emäsreaktio voidaan kirjoittaa tasapainona eteenpäin-ja käänteisreaktion välillä. Olemme nähneet, että happamuusvakio, Ka, on mittari siitä, kuinka helposti laji dissosioituu antamaan H+: n ja konjugaattipohjan.
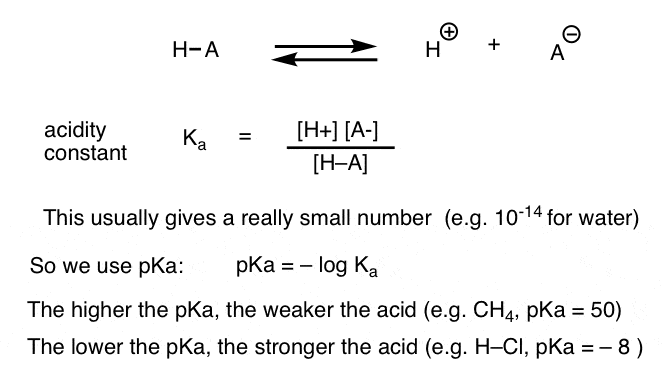
mukavuussyistä käytämme ka: n negatiivista logia, jota kutsutaan pKa: ksi, joka on samanlainen kuin tuttu pH-asteikko, mutta voi ulottua yli 14, koska se ei rajoitu tiukasti vesipitoiseen liuottimeen. pKa-arvot vaihtelevat hyvin vahvojen happojen (esim.hydrojodihappo, H–I) osalta -10: stä vähintään 50: een tiettyjen hiilivetyjen (esim. etaani) osalta.
miten näitä käsitteitä voidaan soveltaa basisiteetin mittaamiseen? Emmekö voisi muuttaa asioita ja määritellä termin Kb , joka on tasapaino sille, kuinka helposti laji yhdistyy H+: aan, määritellä PKB: n negatiiviseksi lokiksi ja vertailla emäksiä tarkastelemalla niiden pKb-arvoja?
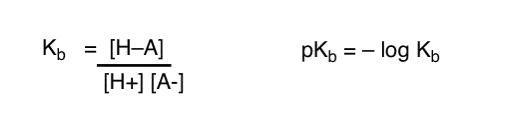
Kyllä…. voisimme. Niin kai. Jos on pakko. Mutta yleensä orgaanisten kemistien mielipide tästä aiheesta on ”Fuck pKb”.
onhan pKa-arvoja mitattu tuhansille orgaanisille molekyyleille. Haluaako joku todella joutua muistamaan myös valtavan joukon pKb: n arvoja? Ei helvetissä!
sen sijaan voimme helposti käyttää PKA-arvoja basisiteetin epäsuorana mittana. Näin.
3. Käyttämällä pKa-arvoja amiinien emäksisyyden kvantifioimiseksi
muista nämä kaksi kuolematonta proosan riviä, jotka kannattaa lausua itselle öisin:
- mitä vahvempi happo, sitä heikompi konjugaattiemäs.
- mitä heikompi happo, sitä vahvempi konjugaattiemäs.
pyridiinin konjugaattihapon (”pyridinium”) pKa on mitattu. Se on noin 5,2 .
meillä on myös piperidiinin konjugaattihapon PKA-arvo. Se on noin 11 .
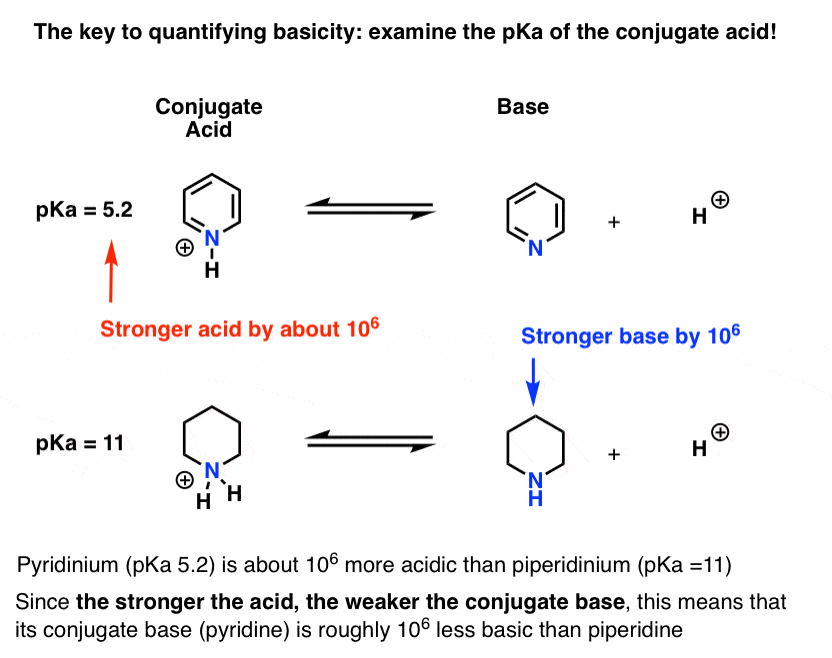
näistä pKa-arvoista voidaan päätellä, että pyridiinin konjugaattihappo on piperidiinin konjugaattihappoa vahvempi noin 6 pKa-yksikköä. Koska jokainen pKa-yksikkö on tekijä 10, se on tekijä noin 1 miljoona.
koska ”mitä vahvempi happo, sitä heikompi konjugaattiemäs”, pyridiini on siis piperidiiniä heikompi emäs kertoimella 1 miljoonaa.
4. ”Konjugaattihapon pKa ”voidaan lyhentää muotoon”pKaH”
termi, ”konjugaattihapon pKa” on vähän suupala käyttää säännöllisesti. Koska olemme luonnostaan laiskoja, haluaisimme tiivistää tätä hieman yleiseen käyttöön.
koska emäksen konjugaattihappo (”B”) on ”BH”, voimme lyhentää ”emäksen konjugaattihapon pKa” sen pKaH: ksi.
näin voidaan sanoa, että pyridiinin pKaH on 5,2 ja piperidiinin pKaH on 11.
voimme sitten kaivautua kirjallisuuteen löytääksemme muita perusteita, joihin sitä voi verrata.
esimerkiksi, kuinka emäksinen ammoniakki tarkalleen on (NH3)? Ammoniakin konjugaattihappo NH4 (+) on 9,2. Vastaavasti voidaan sanoa, että ammoniakin pKaH on 9,2. Tällöin se sijoittuu pyridiinin ja piperidiinin väliin basisuusasteikolla.
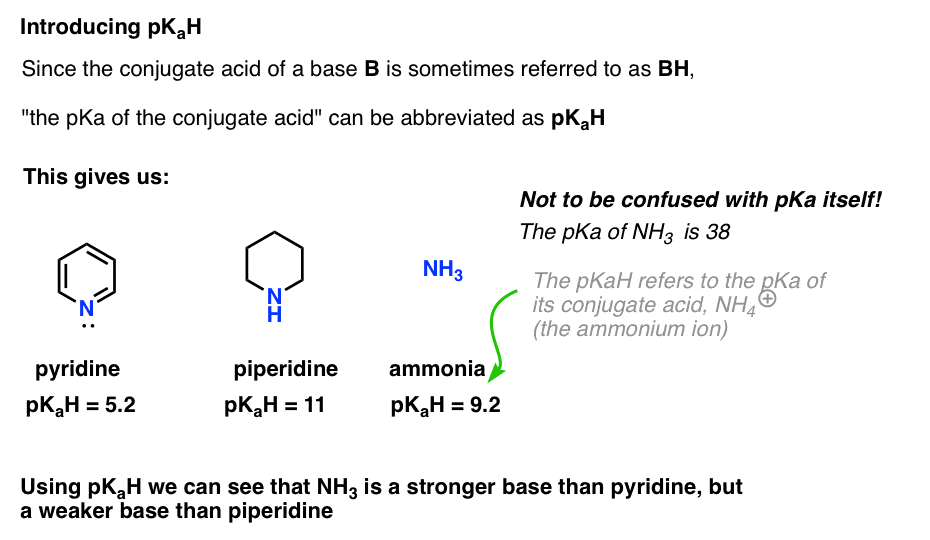
huomaa, että on erittäin tärkeää, ettei pKaH: ta sekoiteta pKa: han. Ammoniakin pKaH on 9,2, joka mittaa sen konjugaattihapon happamuutta NH4 (+).
itse ammoniakin pKa on 38, joka mittaa tasapainovakiota NH3: n dissosiaatiolle, jolloin saadaan sen konjugaattiemäs, NH2(-) ja H+.
tämä tarkoittaa, että 38 on amidi– ionin NH2 ( – ) pKaH, jonka olet saattanut kohdata aiemmin terminaalisen alkyynien deprotonointiin käytettynä vahvana emäsnä (NaNH2) (pKa =25). Käyttämällä pKaH, voimme määrittää, että NH2 ( – ) on noin (38-9) = 29 suuruusluokkaa enemmän perus kuin NH3 !
5. PKaH: n käyttäminen amiinien
suhteellisten perusteiden määrittämiseen pKaH: n avulla emästen suhteellisten vahvuuksien määrittämiseen on melko hyödyllinen temppu.
Tässä muutamia edustavia esimerkkejä typpeä sisältävistä molekyyleistä. Alla on niiden konjugaattihappojen pKa.
mikä on vahvin pohja täällä? Mikä on heikoin?
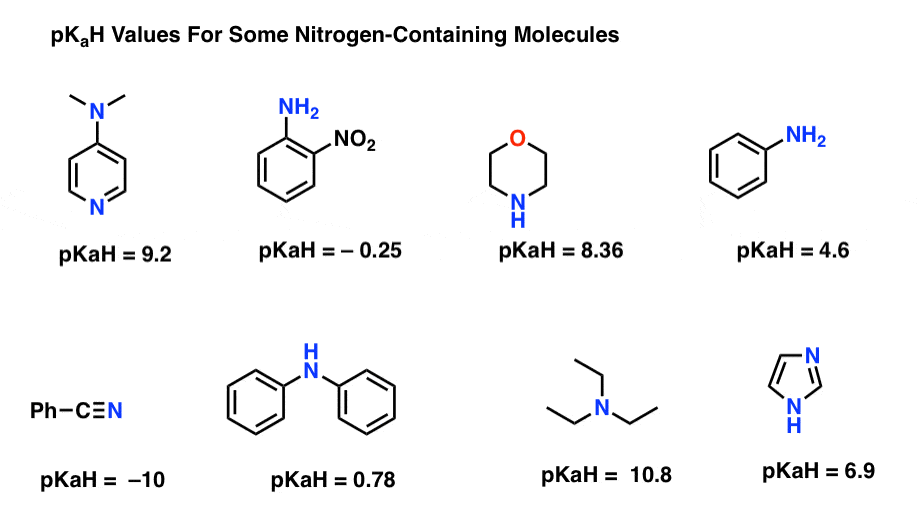
tässä pienin pkah-arvo on -10 nitriilille (alhaalla vasemmalla). Tämä tarkoittaa, että nitriili on pienin näistä molekyyleistä.
tässä korkein pKaH-arvo on 10,8 trietyyliamiinille. Tämä tekee trietyyliamiinista vahvimman emäksen kaikista luetelluista.
joitakin varoituksen sanoja amiinien pKa-arvoista
kaksi asiaa, joita kannattaa varoa, varsinkin lukiessa muita aiheeseen liittyviä verkkolähteitä.
aluksi joskus amiinien pKaH-arvot ilmoitetaan ilman selitystä pKa-arvoina. Parhaat pKa-pöydät eivät tätä tee, mutta jyvät on vaikea lajitella akanoista, kun on vasta aloittelemassa.
Jos näet amiinille anomaalisen alhaisen pKa-arvon, se viittaa todennäköisesti konjugaattihapon pKaH-arvoon.
esimerkiksi tässä on PKA-taulukko, jossa metyyliamiinin (CH3NH2) pKa: ksi on listattu 10,63.
se on matala. Toivottavasti tässä vaiheessa tällainen arvo 10 pKa Amine pitäisi tuntua oudolta, varsinkin kun pKa läheistä sukua NH3 on 38.
arvo 10,63 viittaa itse asiassa metyyliamiinien konjugaattihapon pKa: han, ei itse metyyliamiiniin. Se on pKaH-arvo.
vastaavasti samassa taulukossa trimetyyliamiinin pKa on 9,8 . Jälleen, tämä on itse asiassa sen pKaH. En löydä trimetyyliamiinille varsinaista pKa-arvoa, mutta arvelisin sen olevan >40, koska trimetyyliamiinin konjugaattiemäs on karbanioni (CH3)2n–CH2(–) ).
toinen, harvinaisempi sekaannuksen lähde on se, että joskus amiinin pKaH ilmoitetaan sen pKb: ksi, kuten tässä taulukossa, joka ilmoittaa NH3: n pKb: n 9.2 . Tämä ei pidä paikkaansa.
taas PKB-arvot eivät juuri nouse esiin perustutkintoa suorittavassa orgaanisessa kemiassa, vaikka minulle on kerrottu, että ne joskus esiintyvät dat / MCAT: ssa.
7. Mitkä Avaintekijät Ohjaavat Amiinien Emäksisyyttä?
nyt kun olemme oppineet ainakin kvantifioimaan ja tulkitsemaan amiinien ja niiden konjugaattihappojen pKa-arvoja, voimme alkaa kysyä avainkysymystä: miksi? Mitkä avaintekijät ohjaavat amiinien emäksisyyttä? Mitkä ovat tärkeimmät suuntaukset?
esimerkiksi miksi pyridiini on heikompi emäs kuin piperidiini? Miksi nitriilit ovat vielä heikompia emäksiä? Miksi elektroneja vetäytyvät ryhmät pyrkivät tekemään amiineista heikompia emäksiä?
hyvä uutinen on se, että jos jo ymmärtää happamuutta säätelevät tekijät, on yksinkertaisesti sovellettava täsmälleen samoja periaatteita – mutta päinvastoin!
käsittelemme asiaa seuraavassa viestissä. Viisi tekijää, jotka vaikuttavat amiinien Emäksisyyteen
huomautukset
alaviite 1. On monia happoja, jotka ovat ei-emäksiä (kuten NH4, josta puuttuu yksinäinen pari) ja monia emäksiä, jotka ovat ei-happoja, kuten Cl (–), joka ei kykene hyväksymään yksinäistä paria. Siksi on väärin sanoa: ”mitä vahvempi happo, sitä heikompi emäs”.
alaviite 2. Se on mitta, joka saadaan käyttämällä vettä liuottimena. Saatat nähdä toisen arvon, 3.4, joka saadaan, kun dimetyylisulfoksidia (DMSO) käytetään liuottimena. Katso Bordwellin PKA-taulukot (DMSO)