Enzimas para Bordes de Cepillos del Intestino Delgado
Fisiopatología VIVO
Enzimas para Bordes de Cepillos del Intestino Delgado
El paso final en la digestión de carbohidratos y proteínas dietéticos se produce en la cara de los enterocitos del intestino delgado, en las inmediaciones de los transportadores que transportarán los azúcares y aminoácidos resultantes a las células epiteliales. Las enzimas responsables de esta etapa terminal de la digestión no están libres en la luz intestinal, sino atadas como proteínas de membrana integrales en la membrana plasmática del enterocito. La membrana plasmática apical que contiene estas enzimas está compuesta de numerosas microvellosidades que se extienden desde la célula y constituyen el «borde del cepillo». Por lo tanto, las enzimas incrustadas en esas microvellosidades se conocen como enzimas de borde de pincel.
La densidad y distribución de las enzimas de borde de cepillo difiere entre los diferentes segmentos del intestino delgado y, a menudo, varía según la edad del animal. Además, en algunos casos, la concentración de estas enzimas puede ser modulada por la dieta; por ejemplo, la cantidad de la enzima sacarasa-isomaltasa aumenta en animales alimentados con una dieta alta en carbohidratos.
Maltasa-Glucoamilasa y Sacarasa-Isomaltasa
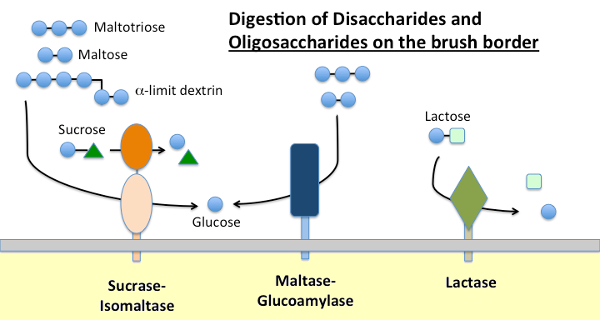
El almidón dietético es digerido por α-amilasa presente en las secreciones pancreáticas y, en muchas especies, en la saliva. La amilasa hidroliza enlaces glicosídicos α-1,4 internos en el almidón para generar maltosa, oligosacáridos cortos (por ejemplo, maltotriosa) y las llamadas dextrinas límite, que son puntos de ramificación en la amilopectina. Ninguna de estas moléculas puede ser absorbida a través del epitelio del intestino delgado y requiere más hidrólisis, en última instancia, en glucosa.
La maltasa-glucoamilasa y la sacarasa-isomaltasa son enzimas estrechamente relacionadas incrustadas en la membrana del borde del cepillo que ejecutan las etapas terminales de la digestión utilizando sustratos proporcionados por la acción de la amilasa:
- La maltasa-glicoamilasa tiene dos sitios activos. El sitio de la maltasa hidroliza residuos terminales de D-glucosa enlazados a α-1,4 de maltosa o maltotriosa, generando α-D-glucosa. El sitio de la glucoamilasa también tiene actividad α-1,4 hidrolasa, pero también hidroliza enlaces glucosídicos α-1,6 cuando están adyacentes a un enlace α-1,4, liberando β-D-glucosa.
- La sacarasa-isomaltasa también tiene dos sitios activos con diferentes especificidades. El sitio de la sacarasa cataliza la hidrólisis de la sacarasa en fructosa y glucosa, y también es capaz de hidrolizar maltosa. El sitio de la isomaltasa es importante como el mecanismo principal para digerir los enlaces α-1,6 de las dextrinas límite.
Lactasa
La lactasa, como su nombre lo indica, es una disacaridasa que hidroliza la lactosa en galactosa y glucosa; formalmente, es una β-glucosidasa. La lactosa es el principal carbohidrato en la leche y la lactasa está abundantemente presente en el borde del cepillo del intestino delgado de los mamíferos jóvenes. En la mayoría de las especies, incluidos los seres humanos, la expresión de lactasa se desploma poco después del destete. En la mayoría de los seres humanos, esta no persistencia de la actividad de la lactasa en la edad adulta se asocia con «intolerancia a la lactosa». La diferencia entre persistencia y no persistencia de lactasa se determina genéticamente.
Peptidasas
Hay un gran número de peptidasas de borde de cepillo, que colectivamente pueden hidrolizar la diversidad de secuencias de aminoácidos diversas presentes en las proteínas dietéticas. Las principales clases de peptidasas incluyen:
- Exopeptidasas que hidrolizan los aminoácidos terminales de los péptidos. Algunas de estas enzimas tienen actividad contra residuos C-terminales y otras trabajan en aminoácidos N-terminales. Su actividad produce aminoácidos o dipéptidos libres. Como ejemplo de especificidad y diversidad enzimática, la aminopeptidasa P hidroliza el aminoácido N-terminal a partir de di, tri y oligopéptidos, pero solo si están vinculados a la prolina, mientras que la aminopeptidasa A cataliza la hidrólisis de aminoácidos ácidos terminales como el glutamato y el aspartato.
- Las endopeptidasas cortan las cadenas de péptidos internamente, produciendo péptidos más pequeños de longitud variable de cadena.
- Una sola dipeptidasa también existe como enzima de borde de pincel.
La enteropeptidasa, también conocida como enterocinasa, es otra enzima de borde de cepillo que tiene la importante actividad de catalizar la activación del tripsinógeno en tripsina, una de las principales proteasas del páncreas. La enteropeptidasa está presente más abundantemente en el duodeno.
Lipasas
Un número de lipasas están presentes en el borde del cepillo del intestino delgado. Estos incluyen fosfolipasa B1, ceramidasa neutra y esfingomielinasa alcalina.