Eche un vistazo a los artículos recientes
Resumen
Antecedentes: Una endometriosis pulmonar es una de las formas relativamente raras de la endometriosis extragenital y, de acuerdo con sus síntomas clínico-patológicos, se considera dentro de los términos del «síndrome de endometriosis torácica», es decir, cuando el endometrio funcional se encuentra en la pleura, el diafragma, las vías respiratorias o el parénquima pulmonar en sí.
Objetivos: se observaron 42 casos de esta enfermedad. La edad de los pacientes varió de 16 a 61 años, siendo el promedio de 40,5 ± 0,4 años.
Resultados: En la mayoría de los casos la endometriosis afectó el diafragma y se acompañó de un neumotórax con el complejo sintomático correspondiente, mientras que los focos pulmonares se presentaron más raros, siendo asintomáticos o fingiendo alguna patología quirúrgica u otra. La cirugía y el estudio histológico fueron cruciales para verificar el diagnóstico. Se detectaron inmunohistoquímicamente receptores de progesterona y estrógeno y producción de Ki-67 en el tejido endometrioide de los focos pulmonares.
Conclusión: Se requirió el uso de los métodos histológicos e inmunohistoquímicos integrales para hacer más confiable el diagnóstico final de la endometriosis pulmonar. Tiene un gran significado práctico siendo uno de los requisitos previos más importantes para la prescripción de un tratamiento adecuado.
Palabras clave
síndrome de endometriosis torácica, endometriosis extragenital, endometriosis pulmonar, lesión de diafragma, neumotórax, verificación histológica del diagnóstico
Introducción
La endometriosis es un crecimiento del tejido similar al endometrio fuera de la cavidad uterina que se acompaña de una reacción inflamatoria crónica, que en la mayoría de los casos conduce al desarrollo de un síndrome de dolor y / o infertilidad. Actualmente, es una de las enfermedades ginecológicas más comunes. Esta patología ocurre en el 2-10% de las mujeres en edad reproductiva y casi en el 50% de las mujeres con infertilidad .
Una de las formas relativamente raras de la endometriosis se caracteriza por el desarrollo del tejido endometrial fuera del sistema reproductor. Los focos extragenitales pueden existir de forma independiente como formaciones separadas y como componentes de las lesiones concomitantes . Los casos de endometriosis extragenital representan el 6-8% del número total de endometriosis observadas. Entre los órganos no relacionados con el sistema reproductivo, se encuentran los intestinos, el tracto urinario y los pulmones que se ven afectados con mayor frecuencia .
Hart fue el primero en diagnosticar la endometriosis pulmonar (EP) póstumamente en 1912. Observó en una mujer de 72 años numerosos nódulos subpleurales que variaban del tamaño de un guisante al de una nuez. El examen histológico mostró adenomiosis de origen uterino; se extirpó un tumor en el útero de la paciente 22 años antes .
Durante la última década, el número de publicaciones sobre la endometriosis ha aumentado notablemente. El concepto de «síndrome de endometriosis torácica» (STE) se ha desarrollado y utilizado en casos en los que el endometrio funcional se encuentra en la pleura, el diafragma, las vías respiratorias o el propio parénquima pulmonar .
Channabasavaiah y Joseph han presentado resultados de un análisis de 110 casos clínicos de endometriosis intratorácica verificada histológicamente que fueron publicados entre 2001 y 2007. Legras et al. han estudiado retrospectivamente 229 casos de neumotórax en mujeres descritos en la literatura especializada escrita en inglés de 2000 a 2011 y afirman que se diagnosticó el EET en 54 casos (24%).
La pregunta de cómo un endometrio funcional entra en el pecho sigue abierta . Sampson fue el primero en sugerir que el endometrio se transfiere de la cavidad uterina a la abdominal a través de las trompas de Falopio a través de la llamada «menstruación retrógrada», es decir, la descarga de cierta cantidad de sangre a la cavidad pélvica durante la menstruación. Este tipo de reflujo ocurre en un gran número de mujeres sanas . Sampson también planteó la hipótesis de la existencia de la endometriosis metastásica o embólica, lo que permite especular sobre las rutas hematógenas de la propagación de la endometriosis. Hobbs y Bortnick confirmaron esta hipótesis introduciendo experimentalmente la suspensión endometrial en las venas de los oídos de los conejos, lo que resultó en el desarrollo de la EP en el 79 por ciento de los casos.
El STE se manifiesta con mayor frecuencia en el neumotórax recurrente, hemoptisis, tos o dolor de pecho, y más raramente en el hemotórax asociado con la menstruación . La EP es una de las formas más raras de la EET. Las manifestaciones clínicas más importantes de la primera son tos, hemoptisis y sensación de pesadez en el pecho (un síntoma de «abrigo de piel pesado») que se producen durante la menstruación, pero no necesariamente en todos los ciclos menstruales.
De acuerdo con la literatura, el neumotórax asociado con el STE se encuentra en aproximadamente el 10-24 por ciento de las mujeres con neumotórax espontáneo .
La radiografía de tórax (principalmente TCAR) revela cuatro variantes de la patología: opacidades lineales o reticulares, nódulos pequeños, espacios aéreos quísticos, septos alveolares engrosados. Estos hallazgos radiológicos, en particular los combinados con hemoptisis y dolor torácico, a menudo se consideran evidencia de una lesión pulmonar de naturaleza tuberculosa o neoplásica.
Una lesión de diafragma generalmente se detecta por accidente durante una intervención quirúrgica debido al neumotórax. Antes de la cirugía, esta patología rara vez se detecta debido a la extensión limitada de las lesiones y la baja resolución de los métodos radiológicos.
Casi sin excepción, la enfermedad afecta a un centro tendinoso de la cúpula del diafragma derecho y puede aparecer en dos tipos. El primero toma la forma de implantes endometriales azules o morados debajo de la pleura parietal de hasta 5 mm de tamaño. Los segundos son defectos redondos o en forma de hendidura en el diafragma.
La falta de síntomas específicos, de marcadores de laboratorio y de patrones radiológicos característicos dificulta el diagnóstico preoperatorio de DP. A menudo se diagnostica finalmente solo después de una confirmación por los métodos histológicos, entre ellos la inmunohistoquímica, incluida la expresión de receptores de estrógeno y progesterona .
Por lo tanto, la intervención quirúrgica a menudo es necesaria con fines diagnósticos y terapéuticos. Aunque la operación verifica el diagnóstico como regla general y elimina cualquier lesión endometrial heterotópica, este tipo de tratamiento permanece incompleto sin una terapia hormonal supresora. Su objetivo es bloquear la ovulación, suprimir la secreción de estrógenos y suprimir el crecimiento epitelial en el foco endometrial .
Un número relativamente pequeño de los casos de STE descritos en la literatura especializada mundial y la falta de su cuadro clínico patognomónico nos llevó a resumir nuestra propia experiencia en el diagnóstico y tratamiento de esta enfermedad.
Métodos
Hemos analizado 42 casos de STE observados en nuestros hospitales durante el período de 2004 a 2016. La edad de los pacientes varió de 16 a 61 años, siendo el promedio de 40,5±0,4 años.
35 pacientes fueron hospitalizados por neumotórax espontáneo, 3 con masas tumorales redondeadas, 1 con quiste y 3 con infiltración en tejido pulmonar. Significativamente, en 41 pacientes el proceso patológico se localizó en el pulmón derecho.
Resultados
Las principales quejas de todos los pacientes hospitalizados se enumeran en la Tabla 1.
Cuadro 1. Complaints of patients with the thoracic endometriosis syndrome
|
Complaints |
Patients (n=42) |
|
|
abs. number |
per cent |
|
|
Chest pain |
85,7 |
|
|
Dyspnea |
73,8 |
|
|
Dry cough |
50,0 |
|
|
Infertility |
14,3 |
|
|
Hemoptisis |
9,5 |
|
En la mayoría de los casos, no era un dolor en el pecho (85,7 por ciento); hemoptisis se encontró con menos frecuencia (9,5 por ciento). Se observó disnea solo en 31 pacientes con neumotórax; 6 mujeres sufrieron infertilidad. En la anamnesis, 5 pacientes tenían mioma uterino y en 2 pacientes había quiste endometrial de ovario.
TCAR de tórax detectó sombras redondeadas en los pulmones (3 casos), infiltrados con cavidades de paredes delgadas (6 casos), quiste pulmonar (1 caso), bullas de varios diámetros (6 casos) y una masa en la región paravertebral considerada neurinoma (1 caso) (Figura 1). Al mismo tiempo, no se detectaron cambios en el tejido pulmonar en 26 de 42 casos (61,9% de los pacientes).
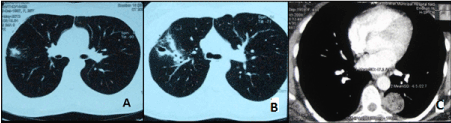
Figura. 1. TACAR de tórax de pacientes con endometriosis pulmonar A-infiltración de tejido pulmonar; B-cavidades pequeñas; C-nódulos periféricos.
Desafortunadamente, un examen preoperatorio no nos permite sugerir el TES en ningún caso, ya que la expresión CA-125 tampoco indica la posibilidad de que lo haga. Al mismo tiempo, un análisis retrospectivo de los datos postoperatorios sugirió que existía un prerrequisito esencial para este diagnóstico.
Los diagnósticos preoperatorios fueron los siguientes: neumotórax espontáneo primario en 35 casos, tuberculosis pulmonar infiltrativa en 3 casos, hemosiderosis pulmonar, neurinoma de mediastino, tumor pulmonar y quiste pulmonar, cada uno en uno.
La intervención quirúrgica se realizó en 37 de 42 pacientes. De las 35 mujeres con neumotórax, 30 (el 85,7%) fueron operadas. Se realizó resección pulmonar atípica en 27 casos (90% de los pacientes), pleurectomía costal en 28 casos (93,3%) y resección del centro del tendón del diafragma en 25 casos (83,3%).
De 7 pacientes sin neumotórax, 6 fueron sometidos a la resección pulmonar atípica y 1 a la lobectomía.
En todos los casos se realizó un examen histológico del material quirúrgico. Las secciones de parafina fueron teñidas con hematoxilina y eosina, azul alciano y picrofuchsina por van Gieson. La inmunohistoquímica se realizó utilizando anticuerpos contra receptores de progesterona y estrógeno, así como anticuerpos monoclonales de ratón contra Ki-67 y bcl 2 (Dako, Dinamarca).
En la correlación de datos clínicos e histológicos, el STE se diagnosticó en todos los casos y se puede subdividir en las siguientes categorías: perforación de la cúpula derecha del diafragma con implantes endometriales histológicamente identificados (6 pacientes); heterotopias endometriales intrapulmonares en forma de ganglios, infiltrados y quistes (11 pacientes); lesiones multifocales de pulmón y diafragma (1 paciente). Se observó una perforación de la cúpula derecha del diafragma sin endometrio identificado histológicamente («diafragma poroso») en 24 casos.
La evaluación macroscópica de los pulmones extirpados detectó quistes con material marrón oscuro (6 casos). Las paredes de los quistes eran gruesas, su superficie interna lisa (5 casos) o con excrecencias papilares (1 caso). 5 observaciones restantes revelaron pequeños focos de hemorragia en las áreas subpleurales.
El examen microscópico detectó numerosos grupos de glándulas endometriales con un estroma citogénico. La estructura de estas glándulas correspondía a varias fases del ciclo menstrual 9 (viz. una etapa de proliferación o secreción) presentada en diferentes cantidades. El tipo endometrial de epitelio de las glándulas era generalmente pseudoestratificado, aplanado o columnar; los núcleos celulares estaban ubicados en los diferentes niveles; el citoplasma contenía gotas secretas; aquí y allá se notaron algunos signos de descamación del epitelio. En la luz alveolar y en el intersticio pulmonar se encontraron con frecuencia depósitos de hemosiderina. El estroma glandular estaba representado por células alargadas con núcleos en forma de huso, en algunos lugares con características de decidualización (Figura 2). En 5 casos se observó una transformación quística de las glándulas junto con hemorragias a su alrededor. Algunos depósitos de hemosiderina y una transformación fibroblástica de un estroma citogénico fueron evidentes en la mayoría de los casos.
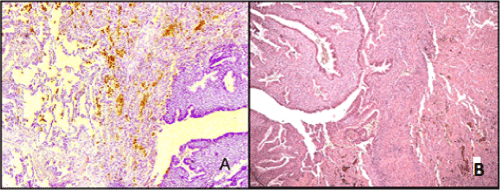
Figura. 2. Endometriosis pulmonar. A-Islotes de proliferación de glándulas endometriales. En la luz alveolar hay depósitos de hemosiderina. Tinción de hematoxilina y eosina (X 100); Epitelio proliferativo B de las glándulas con gotas secretas en el citoplasma. Estroma con características de decidualización. Tinción de hematoxilina y eosina (X 160).
En todos los casos se realizó el estudio inmunohistoquímico. Reveló la expresión de receptores de progesterona y estrógeno en el epitelio de la glándula y células de estroma citogénico (Figura 3 A, B), así como la expresión de la oncoproteína bcl-2 en el epitelio de la glándula y actividad proliferativa moderada (Ki-67) en el estroma citogénico (Figura 3 C).
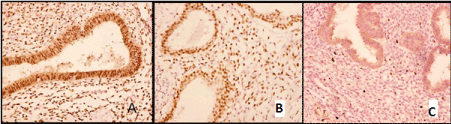
Figura. 3. Endometriosis pulmonar: A-expresión de receptores de progesterona en células epiteliales glandulares (X200); B – idéntica a los receptores de estrógeno (X200); expresión de C – Ki-67 en el estroma citogénico (X100).
A continuación se muestran dos ejemplos de nuestras observaciones.
Ejemplo 1. Paciente F., 52 años. El diagnóstico clínico fue un tumor del lóbulo inferior del pulmón derecho. Seis años antes, la extirpación del útero sin apéndices se realizó a causa del mioma de útero con adenomiosis; la paciente sufría de infertilidad. 6 años después de la cirugía hubo quejas de dolores periódicos en el pecho, tos y hemoptisis. La radiografía del tórax reveló una sombra redonda de 4 cm de diámetro en el lóbulo inferior del pulmón derecho. La TCAR mostró una formación redondeada, de 4х3х2, 5 cm de tamaño, de estructura heterogénea con contornos bien definidos. El examen no pudo verificar el diagnóstico preciso, por lo que se realizó la lobectomía inferior derecha. Macroscópicamente, se detectó una formación de tipo» panal » con contornos bien definidos y pequeñas cavidades de hasta 0,7 cm llenas de líquido marrón espeso. Había un tejido fibroso denso y homogéneo entre las cavidades. El examen histológico reveló glándulas endometrioides transformadas quísticas con un epitelio proliferativo en sus paredes, así como una formación de papilas y un estroma citogénico fibroso, junto con una hiperplasia leiomiomatosa alrededor de las estructuras glandulares (Figura 4).
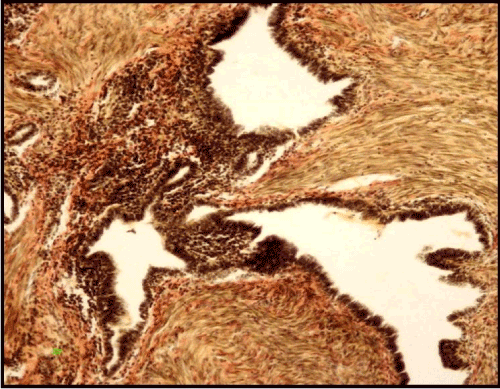
Figura. 4. Pulmonar endometriosis con estructuras papilares y leiomyomatous hiperplasia. Tinción de Van Gieson (X 160).
Ejemplo 2: Paciente A., 42 años. El diagnóstico clínico fue el neumotórax espontáneo del lado derecho. En el primer día del ciclo menstrual, apareció dolor en la mitad derecha del pecho. Se acompañó de tos seca y ligera disnea. La radiografía de tórax reveló un neumotórax del lado derecho con una atelectasia del 50% y un desplazamiento del mediastino hacia la izquierda. Al ingreso al hospital se realizó una toracoscopia diagnóstica de lado derecho con drenaje de la cavidad pleural. El centro tendinoso del diafragma mostraba perforaciones e implantes endometriales (Figura 5). La TCAR del tórax no reveló cambios en el tejido pulmonar. Se realizó videotoracoscopia del lado derecho, resección del centro del tendón del diafragma y pleurectomía costal subtotal. Macroscópicamente, se detectaron algunas perforaciones en el centro del tendón y nódulos parduscos con contornos bien definidos de hasta 0,5 cm. Se ubicaban en la superficie del diafragma pleural sin penetrar a través de él. El examen histológico mostró algunas lesiones endometriales quísticas en el fondo fibroso.
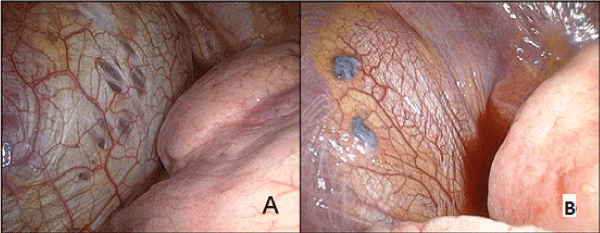
Figura. 5. Lesiones del diafragma reveladas en operación. A-perforaciones en el centro del tendón del diafragma; B-implantes endometrioides.
En este caso, así como en todos los demás, el inicio y la desaparición de los síntomas clínicos y radiológicos coincidieron con el inicio y el final del ciclo menstrual. Sin embargo, este hecho escapó a los físicos.
Discusión
Como prueba clara de las palabras pronunciadas una vez por el conocido oncomorfólogo ruso Golovin , la endometriosis extragenital confirma que cada tejido es una unidad estable formada históricamente que posee ciertas propiedades y potencias morfogenéticas, que no desaparecen por completo incluso en caso de interrelaciones anormales entre un organismo y un tumor. Este enfoque es extremadamente importante para entender la EP como un proceso patológico toto coelo.
En la mayoría de nuestras observaciones, la endometriosis afectó el diafragma y se acompañó del neumotórax con un complejo sintomático correspondiente, mientras que la heterotopía pulmonar se presentó más rara siendo asintomática o fingiendo cierta patología quirúrgica u otra.
Vale la pena mencionar que la lesión de la mitad izquierda del tórax se diagnosticó solo en un caso (viz. implantes en la cúpula izquierda del diafragma y el pulmón izquierdo), lo que confirma el hecho de que el STE es la patología del lado derecho. Sugerimos que la razón de esta selectividad es el hecho de que la cúpula derecha del diafragma junto con el hígado, aunque no está rígidamente unida, funciona durante la respiración como un pistón que proporciona un «efecto de succión». Supuestamente, esta es también la razón por la que es exactamente el espacio debajo del domo derecho del diafragma donde puede llegar cierta cantidad de sangre menstrual de la pelvis. La reabsorción sanguínea se lleva a cabo con la participación activa del aparato linfático del peritoneo . Los fragmentos endometriales llegan al espacio subpleural a través de los vasos linfáticos que perforan el diafragma y permanecen fijos allí en la mayoría de los casos. La necrosis y lisis posteriores del endometrio pueden llevar a los defectos de perforación. Hipotéticamente, es posible que en casos raros pequeños fragmentos de endometrio lleguen a la vena cava superior a través de los vasos linfáticos del mediastino y luego penetren en el parénquima pulmonar formando ganglios, o quistes.
El hipodiagnóstico clínico y morfológico del STE está condicionado no solo por su rareza, sino también por la falta de un análisis complejo y completo y la correlación de los datos anamnésicos, clínicos e histológicos.
Dada la creciente incidencia de la endometriosis, la pulmonar entre otras, parece esencial incluir esta enfermedad en el rango de diagnóstico diferencial, especialmente cuando se trata de mujeres en edad fértil con patología pulmonar derecha poco clara y antecedentes ginecológicos comprometidos. En tales casos, es aconsejable reclutar ginecólogos para excluir la adenomiosis y la endometriosis pélvica. En el caso de las enfermedades pulmonares recurrentes oscuras, es imperativo realizar la resonancia magnética de los pequeños órganos de la pelvis.
Nuestros datos permiten determinar algunas características importantes y confiables de los TES de la siguiente manera: la localización predominantemente del lado derecho de la enfermedad, la edad relativamente joven de las pacientes, la recurrencia cíclica de la hemoptisis y las molestias o dolores en el pecho, el neumotórax recurrente del lado derecho, la correlación de la aparición y/o regresión de los síntomas radiológicos con el inicio y/o el final del ciclo menstrual, uno u otro de los problemas ginecológicos (a saber, infertilidad, dolor pélvico, algomenorrea) y cirugías en los órganos pélvicos en la anamnesis.
La cirugía diagnóstica requiere un uso extensivo de todo el material de la operación con muestras de corte para el examen histológico de todas las áreas pulmonares afectadas, ya que las características microscópicas de la endometriosis en diferentes partes del pulmón, incluso las vecinas, pueden variar considerablemente. Desde el punto de vista diagnóstico, la característica morfológica distintiva esencial del DP es una combinación de los signos de estabilidad, progresión o regresión dentro de la misma muestra de tejido pulmonar o en las muestras adyacentes. Para que el diagnóstico final del STE sea más fiable, se requiere el uso de los métodos histológicos e inmunohistoquímicos integrales. El diagnóstico preciso de la endometriosis es de gran importancia práctica, ya que es un requisito previo para la selección del tratamiento adecuado.
- Tsvelev YV, Abashin VG, et al. (2007) Endometriosis: modern views on the etiology, terminology and classification. Vestnik Rus Military Medical Academy 4: 42-47 .
- Olive DL, Schwartz LB (1993) Endometriosis. N Engl J Med 328: 1759-1769.
- Ozhiganova EN (2009) Endometriosis and endometrioid disease (working standards of postmortem examination). SPb. .
- Harada M, Osuga Y, Izumi G, Takamura M, Takemura Y, et al. (2011) Dienogest, a new conservative strategy for extragenital endometriosis: a pilot study. Gynecol Endocrinol 27: 717-720.
- Bergqvist A (1993) Diferentes tipos de endometriosis extragenital: una revisión. Gynecol Endocrinol 7: 207-221.
- Joseph J, Sahn SA (1996) Síndrome de endometriosis torácica: nuevas observaciones a partir de un análisis de 110 casos. Am J Med 100: 164-170.
- Alifano M, Trisolini R, Cancellieri A, Regnard JF (2006) Endometriosis torácica: conocimiento actual. Ann Thorac Surg 81: 761-769.
- Flieder DB, Moran CA, Travis WD, Koss MN, Mark EJ (1998) Pleuro-pulmonary endometriosis and pulmonary ectopic deciduosis: a clinicopathologic and immuno-histochemical study of 10 cases with emphasis on diagnostic pitfalls. Hum Pathol 29: 1495-1503.
- Channabasavaiah AD y Joseph JV (2010) Endometriosis torácica: revisitando la asociación entre la presentación clínica y la patología torácica con base en hallazgos toracoscópicos en 11 pacientes. Medone. Baltimore 89: 183-188.
- Legras A, Mansuet-Lupo A, Rousset-Jablonski C, Bobbio A, Magdeleinat P, et al. (2014) Neumotórax en mujeres en edad fértil: una clasificación actualizada basada en hallazgos clínicos y patológicos. Pecho 145: 354-360.11.
- Hobbs JE y Bortnick AR. (1940) Endometriosis of the lung; an experimental and clinical study. Am J Obstet Gynecol 40: 832-843.
- Pichurov AA, OrzheshkovskiÄ OV, Dvorakovskaia IV, Romanova LA, Ivanishchak BE, et al. (2014) . Vestn Khir Im I I Grek 173: 26-29.
- Sampson JA (1927) Endometriosis peritoneal debida a la diseminación menstrual del tejido endometrial a la cavidad peritoneal. Soy J Obstet. Gynecol 14: 422-469.
- Adamyan LV, Kulakov VI, and Andreeva EN (2006). Endometriosis. M., Medizina. .Agarwal N. y Subramanian AA (2010) Endometriosis. Morfología, presentaciones clínicas y patología molecular. J Lab Physicians 10: 1-9.
- IablonskiÄ PK, Pichurov AA, OrzheshkovskiÄ OV, Petrun’kin AM, Goncharuk IV (2014). Vestn Khir Im I I Grek 173: 89-95.
- Terada Y, Chen F, Shoji T, Itoh H, Wada H, et al. (1999) Un caso de endometriosis endobronquial tratado por subsegmentectomía. Chest 115: 1475-1478. 18. Koizumi T, Inagaki H, et al. (1999) Uso exitoso de un agonista de la hormona liberadora de gonadotropina en una paciente con endometriosis pulmonar. Respiration 66: 544-546.
- Golovin DI (1975) Atlas de tumores humanos. Leningrado, Medizina. .
- Abu-Hijleh MF, Habbal OA, Moqattash ST (1995) El papel del diafragma en la absorción linfática de la cavidad peritoneal. J Anat 186: 453-467.