Posts Tagged „MO-Theorie; Cycloaddition; organische Chemie; HOMO; LUMO; konjugiertes System“
Eines der schwierigsten Konzepte bei konjugierten Systemreaktionen sind molekülorbitale Wechselwirkungen oder MO-Theorie. Die Grundlagen dieses Prinzips können schwer zu verstehen sein, werden aber sehr informativ sein, um die richtigen Reaktionsbedingungen und das Ergebnis der Reaktion vorherzusagen, wenn Sie sie verstehen, was Ihnen einen großen Vorteil bei zukünftigen Tests und Prüfungen verschafft. Wir bei StudyOrgo haben eine einfache Erklärung der Grundlagen der MO-Theorie entwickelt, um Ihnen bei Ihren Studienvorbereitungen zu helfen.
Prinzipien der MO-Theorie
Das Grundkonzept der MO-Theorie besteht darin, die alternierenden Muster von Orbitalen zu beschreiben, die in Pi-Bindungssystemen existieren. Wir beschreiben die Ausrichtung jeder Hälfte des Hantelorbitals, das um ein Atom zentriert ist, als fett oder offen. Denken Sie daran, es gibt bindende und antibindende Orbitale. Im Wesentlichen verhalten sich Orbitale mit einer geringeren Anzahl von Knoten (Schalter in der Ausrichtung des Hantelorbitals, die wir mit der gestrichelten Linie zeigen) eher wie Bonding-Orbitale, während sich Orbitale mit einer höheren Anzahl von Knoten wie Anti-Bonding-Orbitale verhalten. Um zu bestimmen, welche Orbitale auf Ihrem Molekül besetzt sind, zählen Sie einfach, wie viele Pi-Bindungen Sie in Ihrem konjugierten System haben. Unten ist ein Beispiel für Butadien. Es hat 4 pi-Elektronen, also füllen wir zuerst die niedrigsten Molekülorbitale, zwei in jedem Orbital. Daher ist das höchste besetzte Molekülorbital oder HOMO in Butadien # 2. Infolgedessen ist das niedrigste unbesetzte molekulare Obital oder LUMO in Butadien # 3. Wir können dies auf Ethylen ausdehnen und sehen, dass mit 2 pi-Elektronen das Molekülorbital # 1 das HOMO und das Molekülorbital # 2 das LUMO ist.
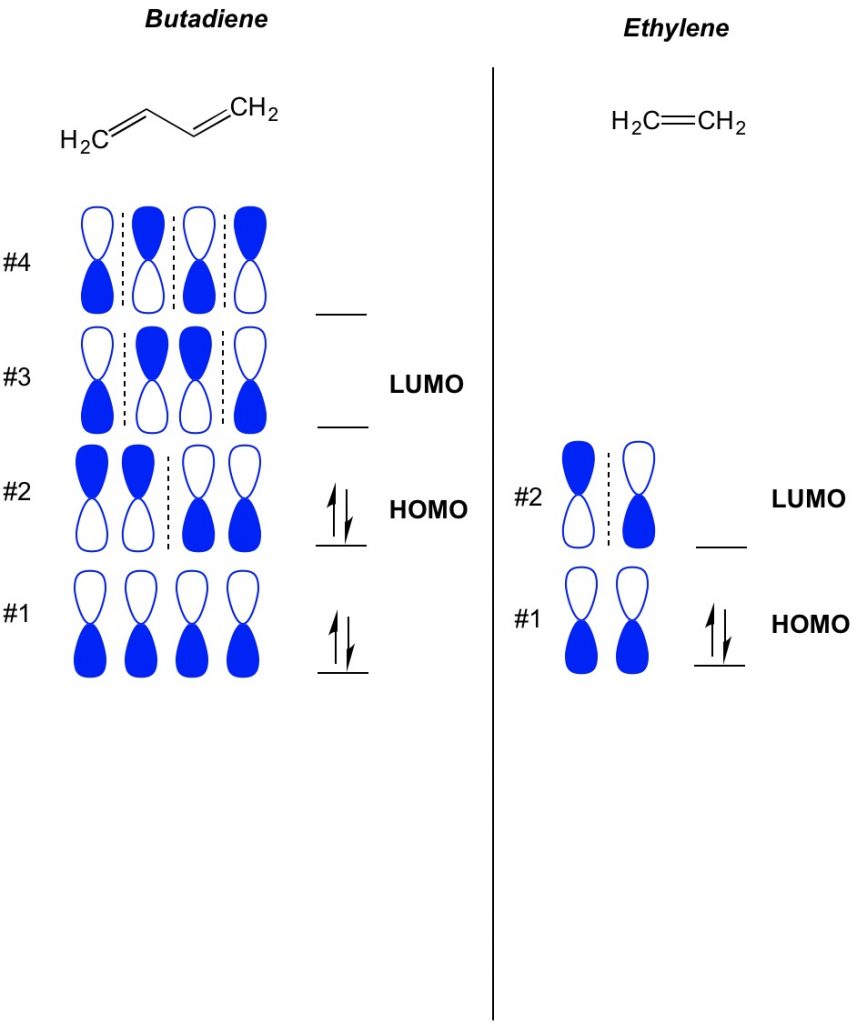
Cycloadditionen MO-Theorie
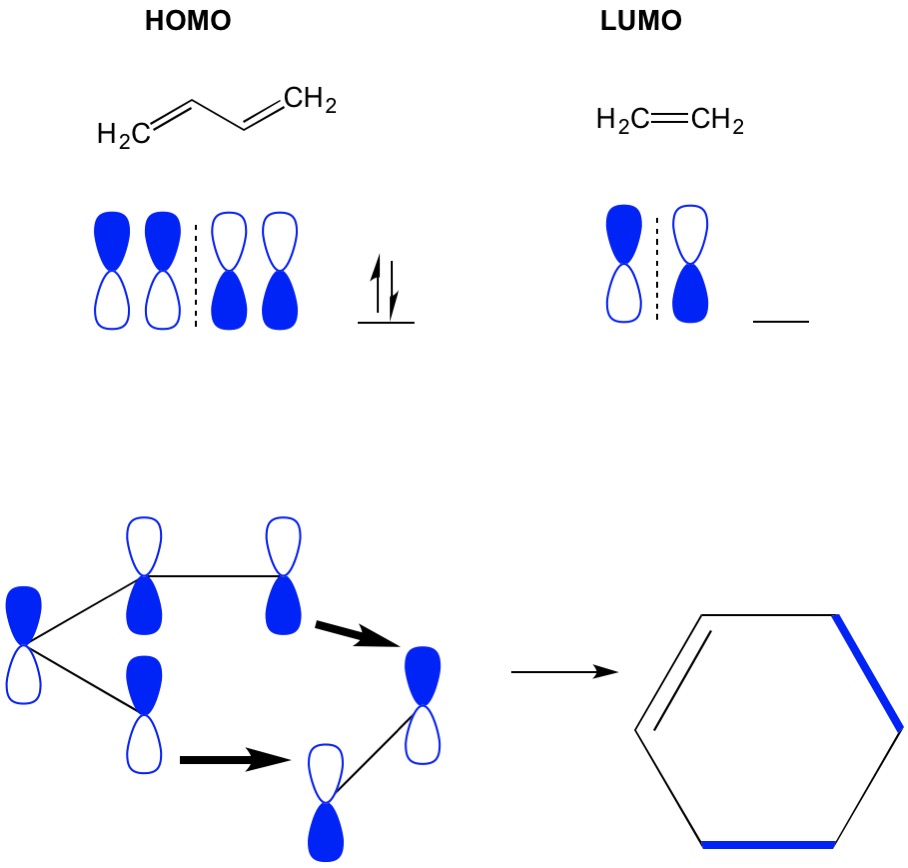
Denken Sie daran, dass Cycloadditionsreaktionen die Bildung neuer CC-Sigma-Bindungen durch Umlagerung der Pi-Elektronen in einem konjugierten System beschreiben. Daher müssen wir die Molekülorbitale der Pi-Elektronen verwenden, um die Reaktion anzutreiben. Nehmen wir die Reaktion von Butadien mit Ethylen, die einfachste Diels-Alder-Reaktion (4 + 2-Cycloaddition). Wir beginnen mit dem am meisten konjugierten Molekül, Butadien, und untersuchen seine STRUKTUR. Dann betrachten wir das am wenigsten konjugierte Molekül Ethylen und untersuchen sein LUMO. Warum? Wir brauchen die Elektronen von einem HOMO, um von einem Molekül zum anderen zu fließen, also müssen wir das LUMO-Orbital verwenden, das für diesen Prozess nicht besetzt ist. Wir sehen, dass sich Knoten des HOMO und LUMO ausrichten; das heißt, die offenen und geschlossenen Hälften der Hanteln richten sich aus. Dies führt zu einer Vorwärtsreaktion und Bildung des Produkts Cyclohexen.
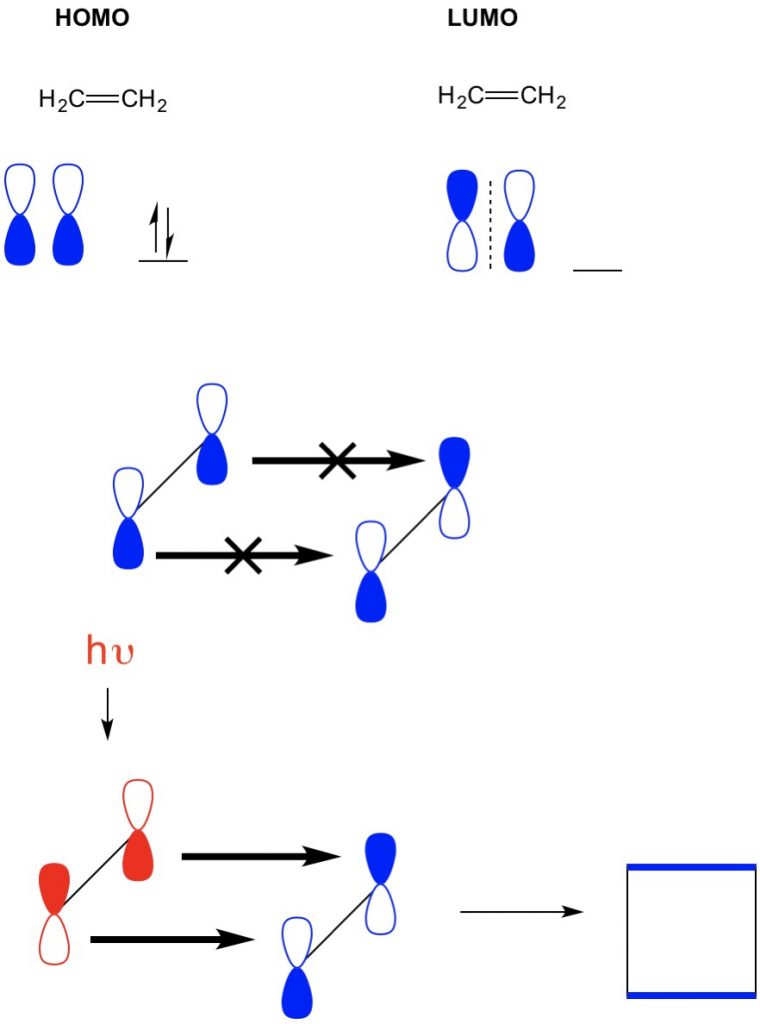
In einem anderen Beispiel, in dem wir eine (2 + 2-Cycloaddition) haben, sehen wir jedoch, dass HOMO und LUMO von Ethylen nicht übereinstimmen, was die Reaktion verbietet. Wir haben jedoch die Fähigkeit, Elektronen aus dem HOMO mit Licht (hv) oder Wärme zu einem höheren Orbital anzuregen und so den HOMO zu verändern. Wir überprüfen dieses Konzept im Detail in einem früheren Artikel. Wenn wir dies tun, richten sich das HOMO von angeregtem Ethylen und LUMO von Ethylen im Grundzustand aus und die Reaktion erzeugt Cyclobutan.
Wir hoffen, dass diese Beschreibung dazu beigetragen hat, diese Konzepte der MO-Theorie zu klären. Dies ist ein Beispiel für die klaren und einfachen Expatiationen, die wir für über 175 Reaktionen vorbereitet haben, die häufig in Orgo1- und Orgo2-Kursen auftreten. Melden Sie sich noch heute für Ihre Studienvorbereitung an!