Low-Tension-Glaukom: Ein Oxymoron in der Augenheilkunde
Ciro Costagliola, MD1; Luca Agnifili, MD, PhD2; Leonardo Mastropasqua, MD2; Alfonso di Costanzo, MD1 (Autorenzugehörigkeiten anzeigen)
Zitiervorschlag für diesen Artikel: Costagliola C, Agnifili L, Mastropasqua L, di Costanzo A. Low-Tension-Glaukom: Ein Oxymoron in der Augenheilkunde. Zurück Chronische Dis 2019;16:180534. DOI: http://dx.doi.org/10.5888/pcd16.180534external Symbol.
Der Begriff Glaukom bezieht sich auf eine Gruppe von Augenerkrankungen, die durch fortschreitende Schädigung des Sehnervs und Gesichtsfeldverlust gekennzeichnet sind (1). Glaukomatöse Optikusneuropathie ist auf den fortschreitenden Verlust von Ganglienzellen der Netzhaut zurückzuführen; Erhöhter Augeninnendruck (IOD) ist ein Hauptrisikofaktor. Der IOD kann direkt, mechanisch oder indirekt durch Beeinflussung der Blutversorgung wirken (2). Faktoren, die das Fortschreiten der glaukomatösen Optikusneuropathie beeinflussen, sind höheres Alter, fortgeschrittenes Krankheitsstadium, höherer Augeninnendruck und Bandscheibenblutungen (3). Bei Patienten mit primärem Offenwinkelglaukom (POAG) ist der erhöhte Widerstand gegen wässrigen Abfluss durch das Trabekelnetzwerk der Hauptschuldige für erhöhten Augeninnendruck. Trotz ausreichender Kontrolle des Augeninnendrucks kann die glaukomatöse Optikusneuropathie jedoch häufig weiter fortschreiten. Somit werden Faktoren erkannt, die nicht mit dem Augeninnendruck zusammenhängen, wobei die wichtigste eine Abnahme der Blutversorgung des Sehnervs ist (4).
Andere Faktoren, die nicht mit dem Augeninnendruck zusammenhängen, sind Glutamattoxizität, oxidativer Stress, Autoimmunität und vaskuläre Dysregulation (3). Das Low-Tension-Glaukom (LTG) ist definiert als eine Form des Glaukoms, die POAG genau nachahmt, aber der Augeninnendruck liegt im normalen Bereich und die wahrscheinliche Pathogenese ist vaskulär.
Die kontroversen Fragen sind 1) Ist LTG eine Krankheit im Spektrum von POAG (auf der linken Seite der Verteilung von IOP, auf den niedrigsten Ebenen)?, 2) ist das Aussehen der Papille sekundär zur Hypoperfusion des Sehnervs aufgrund von Gefäßerkrankungen?, oder 3) sollte LTG in ein Spektrum angeborener und erworbener Optikusneuropathien aufgenommen werden, die eine glaukomatöse Optikusneuropathie simulieren können?
Top
Ist das Low-Tension-Glaukom eine Erkrankung im Spektrum des primären Offenwinkelglaukoms?
Als Albrecht von Graefe 1857 eine Form des Glaukoms beschrieb, die eine Schädigung des Sehnervenkopfes und einen offenen Vorderkammerwinkel mit einem Augeninnendruck im Referenzbereich zeigte, galt die digitale Palpationstonometrie als Goldstandard. Wenn er ein Abdrucktonometer verwendet hätte, um den Augeninnendruck zu messen, wäre der Hauptnachteil der Tonometrie gewesen, dass sie bei Kontakt mit dem Auge so viel Flüssigkeit verdrängte, dass die gemessenen Messwerte sehr variabel und ungenau wären. Umgekehrt hätte er, wenn er die Einrückungstonometrie verwendet hätte, die Fehlklassifizierung, die sich aus dem Vorhandensein einer dünnen zentralen Hornhaut ergibt, nicht berücksichtigt (1). Viele Diagnosen von LTG betrafen Augen mit dünnen Hornhäuten und basierten auf falsch niedrigen Werten für den Augeninnendruck, ein Befund, der einige Zweifel an der Diagnose von LTG aufkommen lässt (5). Darüber hinaus muss das Fehlen eines erhöhten Augeninnendrucks bei Messungen festgestellt werden, die mehr als einmal oder tagsüber durchgeführt wurden, da der Augeninnendruck bei gesunden Probanden tägliche und nächtliche Schwankungen aufweist, und noch mehr bei Patienten mit POAG oder LTG (6). Für Variationen des Augeninnendrucks können 3 Populationen von LTG-Patienten unterschieden werden: Patienten ohne Augeninnendruckschwankungen, Patienten mit täglicher Augeninnendruckakrophase (der Kamm oder die Spitze eines Zyklus) und Patienten mit nächtlicher Augeninnendruckakrophase (7). Patienten in den 2 letzten Kategorien sollten als echte POAG-Patienten und nicht als LTG-Patienten betrachtet werden, bei denen eine glaukomatöse Optikusneuropathie trotz normalem Augeninnendruck auftritt. Es ist wahrscheinlich, dass Patienten mit einer täglichen oder nächtlichen Akrophase in Studien aufgenommen wurden, die auf der mechanischen Theorie basieren; eine Verringerung des Augeninnendrucks könnte das Fortschreiten des Gesichtsfeldverlusts nur bei diesen Patienten verlangsamen (8). Daten aus der Niederdruckglaukom-Behandlungsstudie hoben die Rolle des Augeninnendrucks bei der LTG-Pathogenese hervor; Das Fortschreiten des Gesichtsfeldverlusts wurde nach 2-jähriger Behandlung mit Timolol 0, 5% um 9, 1% und mit Brimonidin 0, 2% um 39, 1% reduziert (8). In dieser Studie wurden die IOP-Werte jedoch ausschließlich tagsüber aufgezeichnet. Daher ist nicht bekannt, ob Patienten mit einem schlechteren Gesichtsfeld eine nächtliche Akrophase des Augeninnendrucks hatten. Andere Studien zu asymmetrischem LTG berichteten, dass das Auge mit höherem Augeninnendruck eine größere glaukomatöse Schädigung aufweist als das Auge mit niedrigerem Augeninnendruck, was die Rolle des Augeninnendrucks bei der Pathogenese unterstützt (9). In all diesen klinischen Studien wurde der Augeninnendruck jedoch nur während der Bürozeiten gemessen; Daher wurde das Verhalten des nächtlichen Augeninnendrucks nicht aufgezeichnet. Eine kürzlich durchgeführte Studie, in der nychthemerale IOP-Kurven mit einem telemetrischen Sensor ausgewertet wurden, zeigte eine nächtliche Akrophase mit IOP-Spikes bei Patienten mit LTG, obwohl diese Spikes signifikant niedriger waren als die Spikes bei Patienten mit POAG (7). Diese Studie berichtete, dass der Augeninnendruck nachts bei 40% bis 80% der Patienten mit Normalspannungs-Glaukom seinen Höhepunkt erreichte und das Muster bei diesen Patienten dem Muster bei Patienten mit POAG ähnelte. In 24-Stunden-Kurven hatten Patienten mit LTG und POAG ausgeprägtere IOD-Muster am Abend und in der Nacht als am Morgen, mit mehr Peaks und größerer IOD-Fluktuation während der Nacht als während des Abends (7). Andere Faktoren können die Hypothese einer primären IOD-bedingten mechanischen Belastung bei LTG bestätigen, wie z. B. das Vorhandensein von Veränderungen in den Abflusswegen des Kammerwassers, die denen bei POAG ähnlich sind (10).
Bei Patienten, bei denen LTG als Krankheit im Spektrum der POAG angesehen werden kann, müssen mit Hilfe eines Augenarztes ähnliche diagnostische und therapeutische Strategien wie bei Patienten mit hyperbarem Glaukom implementiert werden (Abbildung).
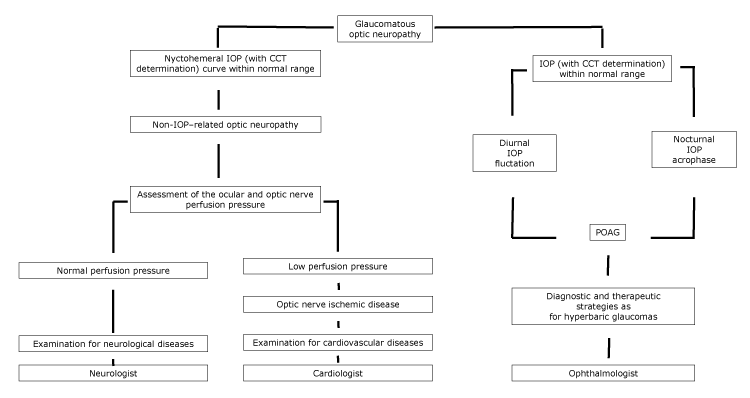
Abbildung.
Vorgeschlagene Flussdiagramm der Optikusneuropathie, mit fachlicher Überweisung, nach den nychthemeral IOP Eigenschaften. Abkürzungen: CCT, zentrale Hornhautdicke; IOP, Augeninnendruck; POAG, primäres Offenwinkelglaukom.
Top
Ist das Aussehen der Papille sekundär zur Hypoperfusion des Sehnervs aufgrund von Gefäßerkrankungen?
Bei Patienten mit LTG und normalen nychthemeralen IOP-Kurven können mechanische Faktoren nicht für die Optikusneuropathie verantwortlich sein; druckunabhängige Faktoren können beteiligt sein, wobei vaskuläre Veränderungen möglicherweise die wichtigsten sind (5). Eine glaukomatöse Optikusneuropathie kann bei Patienten mit kardiovaskulären Ereignissen in der Vorgeschichte oder mit chronischer Atherosklerose oder obstruktiven arteriellen Erkrankungen beobachtet werden (11). Eine verringerte Blutflussgeschwindigkeit in den retrobulbären Arterien und im zerebralen Kreislauf, ein niedriger diastolischer Blutdruck und ein kleinerer Durchmesser der zentralen Netzhautgefäße wurden ebenfalls bei Patienten mit LTG beobachtet (5). Bei diesen Patienten ist die Pathogenese der Erkrankung auf einen gestörten Augenperfusionsdruck zurückzuführen, der hauptsächlich mit einer primären vaskulären Dysregulation oder einer generalisierten Dysfunktion des endothelialen oder autonomen Nervensystems zusammenhängt (5,11). Es ist jedoch unklar, ob diese Faktoren die Ursache oder das Ergebnis der Optikusneuropathie waren. Aus klinischer Sicht zeigt LTG eine höhere Inzidenz von Bandscheibenblutungen und ist häufiger mit Gefäßerkrankungen wie Migräne, obstruktiver Schlafapnoe oder Raynaud-Syndrom assoziiert als mit IOD (5). Schließlich zeigt etwa die Hälfte der LTG-Patienten mit präperimetrischer Erkrankung trotz normaler Augeninnendruck-Werte ein Fortschreiten der Schädigung (12). All diese Ergebnisse deuten auf die wichtige Rolle der vaskulären Dysregulation hin.
Bei Patienten mit Herz-Kreislauf-Erkrankungen kann das Schröpfen der Papille tendenziell nicht fortschreiten, wenn die zugrunde liegende Ursache der Optikusneuropathie kontrolliert wurde. Darüber hinaus können LTG-Patienten eine zirkumpapilläre Atrophie sowie zerebrale kortikale Mikroinfarkte aufweisen, die Anzeichen einer Ischämie sind (5). Bei Patienten, bei denen Gefäßerkrankungen eine Sehnervenhypoperfusion induzieren, muss eine vollständige diagnostische Untersuchung auf Herz-Kreislauf-Erkrankungen durchgeführt werden, mit Hilfe eines Kardiologen (Abbildung).
Top
Sollte LTG in ein Spektrum angeborener und erworbener Optikusneuropathien aufgenommen werden, die eine glaukomatöse Optikusneuropathie simulieren können?
Wenn die häufigeren Ursachen des Papillen-Schröpfens ausgeschlossen wurden, sollte die Möglichkeit einer neurodegenerativen Optikusneuropathie in Betracht gezogen werden. Diese Fälle sind am frustrierendsten, da die Schädigung der Papille auch nach einer Senkung des Augeninnendrucks fortschreitet. Viele angeborene und erworbene Optikusneuropathien gehören zu dieser Gruppe von Fällen, und die Unterscheidung zwischen glaukomatösem und nicht-glaukomatösem Schröpfen kann selbst für erfahrene Beobachter eine Herausforderung darstellen (13). Unter den angeborenen Formen des Papillen-Schröpfens könnten Megalopapille, autosomal dominante Optikusatrophie und hereditäre Optikusneuropathie von Leber eine Papillengrabung hervorrufen, die eine glaukomatöse Optikusneuropathie simuliert.Die erworbenen Neuropathien können sekundär zu entzündlichen, kompressiven, toxischen und traumatischen Ursachen sein. Eine Optikusneuritis kann zu einer Erhöhung des Cup-to-Disc-Verhältnisses führen, das, obwohl einseitig, mit einer glaukomatösen Optikusneuropathie verwechselt werden kann. Kompressive Läsionen einschließlich Meningeom, Hypophysenadenom, Kraniopharyngeom und Aneurysma der A. carotis interna können zu asymmetrischem Papillen-Schröpfen führen und fälschlicherweise LTG zugeschrieben werden. Eine Methanol- und Ethambutolvergiftung kann zu einem bilateralen Papillen-Schröpfen führen, ähnlich einer glaukomatösen Optikusneuropathie, die sekundär zum axonalen Verlust ist. Wenn also ein asymmetrisch vergrößerter Becher beobachtet wird, sind weitere neuro-ophthalmologische Untersuchungen erforderlich (13).
Schließlich spielt unter den Bedingungen, die zum Schröpfen der Papille führen, das Altern eine Hauptrolle. Harju et al fanden heraus, dass der Grad des Papillen-Schröpfens bei gesunden älteren Studienteilnehmern aufgrund des physiologischen Faserverlusts zunahm. Ihre Studienpopulation war angemessen und stellte eine Reihe gesunder Augen ohne Glaukom dar; Während der 11-jährigen Nachbeobachtung entwickelten keine Studienteilnehmer Gesichtsfeldveränderungen, und es wurde kein signifikanter Anstieg des Augeninnendrucks aufgezeichnet (14). In letzterem Fall muss eine vollständige diagnostische Untersuchung auf neurologische Erkrankungen mit Hilfe eines Neurologen durchgeführt werden (Abbildung).Verbesserungen in den Diagnosetechniken machen es einfacher als vorher, Papillen-Schröpfen zu klassifizieren; eine Beschreibung der Papillen-Eigenschaften kombiniert mit der Abbildung der Netzhautnervenfaserschicht und der Papillen-Topographie erlaubt die Unterscheidung zwischen glaukomatösem und nicht-glaukomatösem Papillen-Schröpfen. Darüber hinaus hilft eine sorgfältige Analyse der Anamnese des Patienten zusammen mit der morphologischen und funktionellen Beurteilung des Sehnervs, Störungen zu identifizieren.
Der Begriff LTG könnte ein Oxymoron sein, eine nostalgische Erinnerung an die Vergangenheit, als eine definierte Diagnose nicht möglich war. Die Verwendung des Begriffs ist wie die Verwendung des Wortes „Fieber“, wenn es keine hohe Temperatur gibt, oder das Sagen von festina lente („mehr Eile, weniger Geschwindigkeit“). Der Begriff LTG kann irreführend oder ungenau sein, da er sich auf ein mechanisches Problem des Augeninnendrucks bezieht, während das Schröpfen der Papille und der Gesichtsfeldverlust bei Augen mit normalem Augeninnendruck durch andere Faktoren verursacht werden. Daher sollten Augenärzte bei Vorliegen eines Papillen-Schröpfens mit normalem Augeninnendruck neben dem Augeninnendruck auch andere plausible Ursachen für eine Schädigung des Sehnervs untersuchen.
Top
Acknowledgements
Diese Studie erhielt keinen spezifischen Zuschuss von einer Förderstelle im öffentlichen, kommerziellen oder gemeinnützigen Sektor.
Oben
Autoreninformation
Korrespondierender Autor: Luca Agnifili, MD, PhD, Augenklinik, Via dei Vestini, 66100, Chieti (CH), Italien. Telefon: +39-0871-358489. E-Mail: [email protected] .
Author Affiliations: 1abteilung für Medizin und Gesundheitswissenschaften, Universität von Molise, Campobasso, Italien. 2abteilung für Medizin und Alternswissenschaft, Augenklinik, Universität G. d’Annunzio of Chieti-Pescara, Chieti, Italy.
Top
- Coleman AL, Miglior S. Risk factors for glaucoma onset and progression. Surv Ophthalmol 2008;53(6, Suppl):S3–10. CrossRefexternal icon PubMedexternal icon
- Costagliola C, dell’Omo R, Romano MR, Rinaldi M, Zeppa L, Parmeggiani F. Pharmacotherapy of intraocular pressure: part I. Parasympathomimetic, sympathomimetic and sympatholytics. Expert Opin Pharmacother 2009;10(16):2663–77. CrossRefexternal icon PubMedexternal icon
- Weinreb RN, Aung T, Medeiros FA. The pathophysiology and treatment of glaucoma: a review. JAMA 2014;311(18):1901–11. CrossRefexternal icon PubMedexternal icon
- Cherecheanu AP, Garhofer G, Schmidl D, Werkmeister R, Schmetterer L. Ocular perfusion pressure and ocular blood flow in glaucoma. Curr Opin Pharmacol 2013;13(1):36–42. CrossRefexternal icon PubMedexternal icon
- Mastropasqua R, Fasanella V, Agnifili L, Fresina M, Di Staso S, Di Gregorio A, et al. Advance in the pathogenesis and treatment of normal-tension glaucoma. Prog Brain Res 2015;221:213–32. CrossRefexternal icon PubMedexternal icon
- Moon Y, Lee JY, Jeong DW, Kim S, Han S, Kook MS. Relationship between nocturnal intraocular pressure elevation and diurnal intraocular pressure level in normal-tension glaucoma patients. Invest Ophthalmol Vis Sci 2015;56(9):5271–9. CrossRefexternal icon PubMedexternal icon
- Agnifili L, Mastropasqua R, Frezzotti P, Fasanella V, Motolese I, Pedrotti E, et al. Circadian intraocular pressure patterns in healthy subjects, primary open angle and normal tension glaucoma patients with a contact lens sensor. Acta Ophthalmol 2015;93(1):e14-21. CrossRefexternal icon PubMedexternal icon
- De Moraes CG, Liebmann JM, Greenfield DS, Gardiner SK, Ritch R, Krupin T; Studiengruppe zur Behandlung von Niederdruckglaukom. Risikofaktoren für das Fortschreiten des Gesichtsfelds in der Niederdruckglaukom-Behandlungsstudie. Am J Ophthalmol 2012;154(4):702-11. CrossRefexternal icon PubMedexternal icon
- Cartwright MJ, Anderson DR. Korrelation asymmetrischer Schäden mit asymmetrischem Augeninnendruck bei Normalspannungs-Glaukom (Low-Tension-Glaukom). Arch Ophthalmol 1988;106(7):898-900. CrossRefexternal icon PubMedexternal icon
- Agnifili L, Carpineto P, Fasanella V, Mastropasqua R, Zappacosta A, Di Staso S, et al. Conjunctival findings in hyperbaric and low-tension glaucoma: an in vivo confocal microscopy study. Acta Ophthalmol 2012;90(2):e132–7. CrossRefexternal icon PubMedexternal icon
- Hayreh SS, Jonas JB. Appearance of the optic disk and retinal nerve fiber layer in atherosclerosis and arterial hypertension: an experimental study in rhesus monkeys. Am J Ophthalmol 2000;130(1):91–6. CrossRefexternal icon PubMedexternal icon
- Collaborative Normal-Tension Glaucoma Study Group. Comparison of glaucomatous progression between untreated patients with normal-tension glaucoma and patients with therapeutically reduced intraocular pressures. Am J Ophthalmol 1998;126(4):487–97. CrossRefexternal icon PubMedexternal icon
- Fraser CL, White AJ, Plant GT, Martin KR. Optic nerve cupping and the neuro-ophthalmologist. J Neuroophthalmol 2013;33(4):377–89. PubMedexternal icon
- Harju M, Kurvinen L, Saari J, Vesti E. Change in optic nerve head topography in healthy volunteers: an 11-year follow-up. Br J Ophthalmol 2011;95(6):818–21. CrossRefexternal icon PubMedexternal icon
Top