Journal of Neurology and Neuroscience
Schlüsselwörter
SIDS; Me5; Hippocampus; Schlafphasen; SIUDS; Schnuller; SUDC
Einführung
Schnullergebrauch und nicht nahrhaftes Saugen
Nicht nahrhaftes Saugen ist ein normales Verhalten von Fötus und Neugeborenen. Schnuller (auch als Dummies bekannt) werden seit über 2000 Jahren verwendet, um diesen angeborenen Wunsch zu erfüllen . Diese Scheinnippel können Säuglinge beruhigen oder beruhigen und sind auch bei kleineren medizinischen Eingriffen nützlich . Zum Beispiel wurde gezeigt, dass das Saugen von Schnullern das Weinen bei jungen Säuglingen reduziert, die sich einer Venenpunktion unterziehen . 1979 wurde postuliert, dass die Verwendung von Schnullern das Risiko eines plötzlichen Kindstods (SIDS) zu einem Zeitpunkt verringern könnte, als SIDS mit Schlafapnoe assoziiert war. Obwohl diese Beziehung widerlegt wurde, gibt es starke und konsistente Beweise dafür, dass weniger Säuglinge mit SIDS während des Nachtschlafs einen Schnuller verwenden als altersgerechte Kontrollkinder . Die Mechanismen, mit denen Schnuller Schutz vor SIDS bieten, bleiben unklar, obwohl zwei Mechanismen vorgeschlagen wurden. Erstens kann der Schutz mit Auswirkungen auf die autonome Kontrolle zusammenhängen . Zweitens können Schnuller die Erregbarkeit aus dem Schlaf erhöhen .
Das Me5
Gegenstand unserer Forschung ist der mesencephalic trigeminus nucleus (Me5), eine einzigartige Nervenformation im Zentralnervensystem (ZNS), da er der einzige Ort intraneuraxialer Ganglien ist. Das heißt, es enthält die Zellkörper primärer afferenter sensorischer Neuronen. Dieses schmale Zellband verläuft unmittelbar neben dem periaquäduktalen Grau (PAG) und erstreckt sich von der Grenze zwischen Pons Varolii und Mittelhirn bis zum oberen Colliculus (obere Grenze des Mittelhirns). Seine untere Grenze ist rostral zum motorischen Trigeminuskern (Mo5). Neben Me5 befindet sich medial und vor dem vierten Ventrikel der Locus coeruleus, die Hauptquelle für noradrenerge Fasern im Nervensystem. Der LC und Me5 sind in der frühen Entwicklung eng miteinander verwandt; Der LC ist wichtig für die Differenzierung von Me5-Neuronen, die für die ordnungsgemäße LC-Funktion notwendig sind .
Das Me5 ist vollständig von der Formatio reticularis (RF) umgeben, und sein kaudaler Teil ist sein Kern, der aus kleinen, multipolaren, fusiformen Gamma-Aminobuttersäure (GABA) -Ergiezellen besteht, die rostral zum Mo5 liegen und die wir als Me5c bezeichnen (kaudaler Teil des mesencephalic trigeminus nucleus) . Umgekehrt sitzt der rostrale Teil im Mittelhirn und besteht aus großen pseudo-unipolaren glutamatergen Zellen ohne Dendriten .Me5-Zellen haben Gap Junctions, die somato-somatische Synapsen zwischen kleinen Gruppen von Neuronen bilden . Jedes Neuron ist fast vollständig mit Prozessen bedeckt, die von zwei oder mehr Astrozyten ausgehen (normalerweise bedecken Astrozyten mehr Neuronen) . Die peripheren Äste der Neuronen des mesencephalischen Trigeminuskerns innervieren hauptsächlich Mechanorezeptoren im Parodontalband. Diese Rezeptoren sind bemerkenswert empfindlich auf die Bewegung der Muskeln im Kiefer; Sie werden durch eine einfache Berührung der Zähne aktiviert, es wird nur eine sehr geringe Kraft benötigt (1N und 4N in den Frontzähnen bzw. Darüber hinaus können Me5 parodontale Mechanorezeptoren von „Feuer“ in Abwesenheit von Reizen . Die zentralen Äste gehen zum motorischen Trigeminuskern, zum retikulären parvozellulären Bereich und zur dorsolateralen Mittelhirnregion (dorsaler Raphe-Kern und lateraler dorsaler Kern des Tegmentums ) . Wenn sie als „Probst-Strecke“ durch die Varolio-Brücke absteigen, überqueren sie den dorsolateralen Bulbus auf Höhe des dorsalen Nucleus des Vagusnervs, gelangen in das laterale Tegmentalfeld und enden im Rückenmark auf Höhe des Nucleus caudatus trigeminus bis C1 / C3 . Durch die großen Neuronen des Nucleus Probst, die ventral zum solitären Trakt liegen, erreichen sie den hypoglossalen Nucleus, den trigeminalen hauptsensorischen und caudatalen Nucleus, den solitären Nucleus und schließlich den supra-trigeminalen Nucleus . Die Nervenzellen der RF des Mittelhirns, insbesondere die des DRN und der LDT, senden sowohl direkt als auch durch den Thalamus weit verbreitete aspezifische Projektionen an den gesamten Kortex und sind Teil des aufsteigenden retikulären Aktivatorsystems (ARAS). Das Me5 liefert glutamaterge Signale an Mo5 über seine großen pseudo-unipolaren Neuronen und GABAerge Signale von seinen kleinen Me5c-Neuronen (Abbildung 1) .
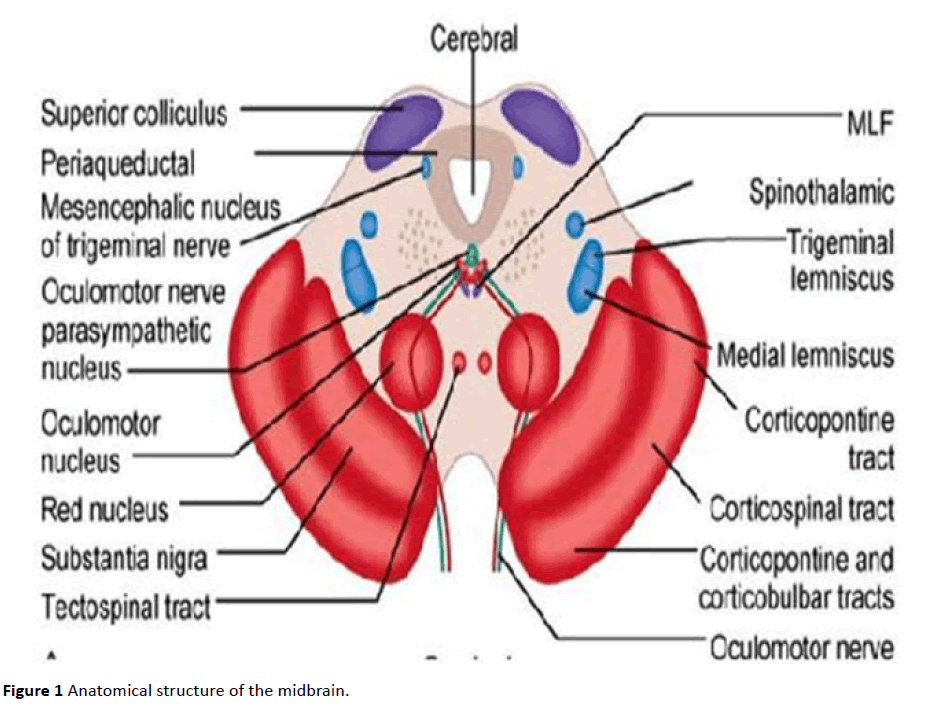
Abbildung 1 Anatomische Struktur des Mittelhirns.
Säuglingsschlafmuster
Vor und unmittelbar nach der Geburt ist Schlaf im Wesentlichen nur REM-Schlaf (Rapid Eye Movement), aber die Dauer des Nicht-REM-Schlafs (NREM) nimmt ab dem ersten Lebensmonat rapide zu. In der Tat wird der Säuglingsschlaf genauer als „Verhaltenszustände“ bezeichnet, die als ruhiger Schlaf (QS, der dem NREM-Schlaf entspricht), aktiver Schlaf (AS, der dem REM-Schlaf entspricht), unbestimmter Schlaf (IS) und Wachheit (W, aktiv oder ruhig) bezeichnet werden. Ein Neugeborenes unterscheidet nicht zwischen Tag und Nacht, und der 25-Stunden-Schlafrhythmus von Neugeborenen ist unabhängig von der Umgebung und wird nur von inneren Bedürfnissen wie Hunger und Durst bestimmt.
Schlaf tritt auf, wenn die VLPO und MNPO des Hypothalamus GABA und Galanin auf ihre Hirnstammziele übertragen, insbesondere auf diejenigen in den ARAS (DRN, LC, TMN usw.). Die Produktion von Acetylcholin, Dopamin, Histamin, Serotonin und Orexin nimmt ab, und es kommt zu einer Hemmung der parasympathischen Kerne und LC, die sympathischen präganglionären Spinalneuronen Noradrenalin zuführen.
Die Hypothese
Das Baby beginnt zu schlafen, was erfordert, dass die VLPO- und MNPO-Kerne GABA an den Hirnstamm und den Hypothalamus abgeben.
Wenn GABA seine Zielzellen erreicht, werden sie gehemmt, da die Membranpotentialdifferenz nach dem Eintritt von Chlorid stark negativ ist. Diese Hemmung verhindert die Freisetzung von Neurotransmittern und die Aktivität kritischer Proteine (z.B. Dopamintransporter oder Monoaminoxidase). Daher werden Autopsiebefunde von Säuglingen mit SIDS wahrscheinlich einen Mangel an diesen Proteinen aufweisen. Ihr Mangel ist wahrscheinlich eher eine Wirkung von SIDS als eine Ursache. Zu einem bestimmten Zeitpunkt im Schlaf, wenn der GABA-Spiegel angestiegen ist und viele Zellen gehemmt sind, wird ein intrinsischer Mechanismus des Hirnstamms aktiviert. Das Me5 besteht größtenteils aus pseudo-unipolaren Zellen, aber sein kaudaler Abschluss (Me5c) besteht aus kleinen multipolaren Zellen, die typischerweise gabaerg sind. Da sie sich direkt gegenüber dem Mo5 befinden, werden sie normalerweise unter Ruhebedingungen gehemmt. Wenn aus dem Hypothalamus freigesetztes GABA Me5c-Zellen hemmt, wird die Me5-Hemmung des Mo5 aufgehoben. Die Kaumuskulatur zieht sich zusammen und die Zähne berühren sich, wodurch das Me5 aktiviert wird und Glutamat an ARAS-Kerne, PAG- und Parasympathikuskerne abgegeben wird. Das Nettoergebnis ist die Abschwächung der hemmenden Wirkung von GABA. Unter diesen Bedingungen sterben bestimmte Nervenzellen ab und aktivieren Gliazellen, die IL1-Beta und Prostaglandine freisetzen, die die Substanz-P-Spiegel erhöhen. Diese Ereignisse sind wahrscheinlich häufig, enden aber selten mit tödlichem Ausgang; sie können jedoch die Entwicklung des Kindes beeinträchtigen und möglicherweise zu einer extremen Schwäche des „Hirnstammsystems“ führen, mit vielen Kernen und Zellen, die nicht richtig funktionieren. In diesem Szenario könnte ein Baby eine hohe „Empfindlichkeit“ gegenüber zahlreichen Faktoren haben, die normalerweise nicht tödlich sind, aber aufgrund der Schwäche des Systems zu diesem Zeitpunkt (z. B. langes QT, triviale Infektionen usw.) auftreten können.).
In diesem Zusammenhang würden wir erwarten, Gliose zu finden; Leukomalazie; Gehirnhypoplasie; erhöhte Substanz-P-Spiegel; und verminderte Serotonin-, Dopamin-, Acetylcholin-, Noradrenalin-, Histamin- und Orexinspiegel.
Ein wichtiger Faktor ist die Schlafposition. In Bauchlage erfordert jeder Atemzug mehr Arbeit, um den Brustkorb zu vergrößern, der Wirbelsäule, Lunge und Herz enthält. Bei einem Neugeborenen wiegen diese Strukturen ~ 0,5 kg von 3-4 kg Gesamtgewicht. Es ist ähnlich wie ein erwachsener Mann von 80 kg, der mit ~ 10 kg Gewicht auf dem Brustkorb auf dem Rücken schläft. Wenn die Belastung des Atmungssystems nicht durch bestimmte Neurotransmitter, insbesondere Serotonin, unterstützt wird, kann es zum Tod kommen. Der Schnuller ist in der Lage, das Me5 zu aktivieren, das dann Glutamat auf ARAS-Kerne und seine Ziele freisetzt und so eine übermäßige gabaerge Übertragung und Hirnstamm- „Schwäche“ verhindert.“
Schlussfolgerung
Unser Ätio-Pathogenese-Modell umfasst viele Aspekte, die mit den Eigenschaften von SIDS übereinstimmen. Insbesondere wird erklärt, warum die Verwendung von Schnullern SIDS verhindern kann. Es zeigt auch, warum das Ungleichgewicht der Neurotransmission im Schlaf besonders gefährlich ist. Insbesondere kann es die meisten Autopsiebefunde im Hippocampus von Säuglingen mit SIDS erklären . Dies wird durch Tierstudien unterstützt, in denen die bilaterale Läsion von Me5-Fasern zu einer ähnlichen Verletzung des Gyrus dentatus hippocampus führte .Wir nehmen an, dass Anomalien im SIDS-Gehirn nicht auf die innige Beziehung zwischen Me5 und Hippocampus zurückzuführen sind; Vielmehr sind sie auf Veränderungen im REM-Schlaf zurückzuführen, die durch Me5-Dysfunktion verursacht werden . Bei der Geburt müssen Neuronen auf ihre Bedürfnisse durch vollständige Expression der entsprechenden Gene reagieren, aber dieses System kann versagen, insbesondere im Zusammenhang mit Umweltproblemen wie Zigarettenrauch oder Schlafen in Bauchlage. Diese Einflüsse machen das Atmen schwieriger und weniger effizient, entweder durch Wiedereinführung von emittiertem Kohlendioxid oder durch herausfordernde Brustkorbausdehnung. Dies könnte die Reifung wichtiger Mittelhirnstrukturen verhindern und zu SIDS führen.
Interessenkonflikt
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Ethikerklärung
Die im Manuskript vorgestellte Studie bezieht keine menschlichen oder tierischen Probanden ein.
- Levin S (1971) Dummies. S Afr Med J 45: 237-240.Zempsky WT, Cravero JP (2004) American Academy of Pediatrics Ausschuss für pädiatrische Notfallmedizin und Abschnitt über Anästhesiologie und Schmerzmedizin. Linderung von Schmerzen und Angstzuständen bei pädiatrischen Patienten in Notfallsystemen. Pädiatrie 114: 1348-1356.Curtis SJ, Jou H, Ali S, Vandermeer B, Klassen T (2007) Eine randomisierte kontrollierte Studie mit Saccharose und / oder Schnuller als Analgesie für Säuglinge, die eine Venenpunktion in einer pädiatrischen Notaufnahme erhalten. BMC Pädiatrie 7: 27.
- Cozzi F, Albani R, Cardi E (1979) Eine gemeinsame Patho-Physiologie für plötzlichen Kindstod und Schlafapnoe. ‚Das Vakuum-Glosso-Ptosis-Syndrom‘. MedHypothesen 5: 329-338.
- Yiallourou SR, Poole H, Prathivadi P, Odoi A, Wong FY, et al. (2014) Die Auswirkungen der Verwendung von Schnullern auf den Blutdruck und die autonome Aktivität von Säuglingen während des Schlafes. Schlaf Med 15: 1508-1516.
- Franco P, Scaillet S, Wermenbol V, Valente F, Groswasser J, et al. (2000) Der Einfluss eines Schnullers auf die Erregung von Säuglingen aus dem Schlaf. JOH 136,775-779.
- Hanzer M, Zotter H, Sauseng W, Pfurtscheller K, Müller W, et al. (2009) Die Verwendung von Schnullern verändert nicht die Häufigkeit oder Dauer spontaner Erregungen bei schlafenden Säuglingen. Schlaf Med 10: 464-470.
- Espana A, Clotman F (2012) One cut Faktoren steuern die Entwicklung des Locus coeruleus und des mesencephalic trigeminus nucleus. Mol Cell Neurosci 50: 93-102.Morgane PJ, Jacobs MS (1979) Raphe Projektionen auf den Locus coeruleus in der Ratte. Gehirn Resp 4: 519-534.
- Hayar A, Poulter MO, Pelkey K, Feltz P, Marshall KC (1997) Mesencephalic Trigeminus neuron Reaktionen auf Gamma-Aminobuttersäure. Gehirn Res 753: 120 -127.
- Copray JC, Liem RS (1993) Überleben und Neuritenbildung mesencephaler Trigeminusneuronen der Ratte in vitro. Arch Oral Biol 38: 547-557.
- Rokx JT, Juch PJ, Van Willigen JD (1985) Über die bilaterale Innervation der Kaumuskulatur: eine Studie mit retrograden Tracern. 140: 237-243.
- Paik SK, Kwak MK, Ahn DK, Kim YK, Kim DS, et al. (2000) Die Entwicklung der Neurobiologie in der Neurobiologie. Neuroreport 16: 1561-1564.
- Lazarov NE (2000) Der mesencephale Trigeminuskern bei der Katze. Adv Anat Embryol Zelle Biol 153: 1-103.
- Henderson G, Pepper CM, Shefner SA (1982) Elektrophysiologische Eigenschaften von Neuronen, die im Locus coeruleus und mesencephalic nucleus des Nervus trigeminus in vitro enthalten sind. Exp. Res 45: 29-37.Curti S, Hoge G, Nagy JI, Pereda AE (2012) Synergie zwischen elektrischer Kopplung und Membraneigenschaften fördert eine starke Synchronisation von Neuronen des mesencephalen Trigeminuskerns. Jucci 32: 4341-4359.
- Liem RS, Copray JC, Van Willigen JD (1991) Ultrastruktur des mesencephalen Trigeminuskerns der Ratte. Acta Anat (Basel) 140: 112-119.
- Trulsson M (2006) Sensorisch-motorische Funktion menschlicher parodontaler Mechanorezeptoren. J Oral Rehabil 33: 262-273.
- Trulsson M (2007) Kraftkodierung durch menschliche parodontale Mechanorezeptoren während des Kauens. Arch Oral Biol 52: 357-360.
- Trulsson M, Gunne HSJ (1998) Nahrungshaltungs- und Beißverhalten bei Menschen ohne parodontale Rezeptoren. 77: 574-582.
- Trulsson M, Johansson RS, Olsson KA (1992) Richtungsempfindlichkeit menschlicher parodontaler mechanorezeptiver Afferenzen gegenüber Kräften, die auf die Zähne ausgeübt werden. J Physiol 447: 373-389.
- Rokx JT, Juch PJ, Van Willigen JD (1986) Anordnung und Verbindungen von mesencephalen Trigeminusneuronen in der Ratte. Acta Anat (Basel) 127: 7-15.
- Matsushita M, Okado N, Ikeda M, Hosoya Y (1981) Absteigende Projektionen von den spinalen und mesencephalen Kernen des Trigeminusnervs zum Rückenmark bei der Katze. Eine Studie mit der Meerrettich-Peroxidase-Technik. J Comp Neurol 196: 173-187.
- Sirkin DW, Feng AS (1987) Autoradiographische Untersuchung der absteigenden Bahnen von der Pontin-retikulären Formation und dem mesencephalic Trigeminus nucleus in der Ratte. J Comp Neurol 256: 483-493.
- Nieuwenhuys R, Voogd JD, Van Huijzen C (2008) Das zentrale Nervensystem des Menschen. New York: Springer.
- Matesz C (1981) Periphere und zentrale Verteilung der Fasern der mesencephalic Trigeminuswurzel in der Ratte. Neuroscience 27: 13-17.
- Kolta A, Westberg KG, Lund JP (2000) Identifizierung von Hirnstamm-Interneuronen, die auf den Trigeminus-Motorkern und angrenzende Strukturen im Kaninchen projizieren. J Chem Neuroanat 19: 175-195.
- Hayar A, Poulter MO, Pelkey K, Feltz P, Marshall KC (1997) Mesencephalic Trigeminus neuron Reaktionen auf Gamma-Aminobuttersäure. Gehirn Res 753: 120-127.
- Meier-Koll A (1979) Wechselwirkungen endogener Rhythmen während der postnatalen Entwicklung. Verhaltensbeobachtungen und polygraphische Studien an einem normalen Säugling. Int J Chronobiol 6: 179-189.
- Kinney HC, Cryan JB, Haynes RL, Paterson DS, Haas EA, et al. (2015) Dentale Gyrusanomalien bei plötzlichem ungeklärtem Tod bei Säuglingen: morphologischer Marker für die zugrunde liegende Anfälligkeit des Gehirns. Acta Neuropathol 129: 65-80.
- Ishii T, Suenaga R, Iwata W, Miyata R, Fujikawa R, et al. (2010) Bilaterale Läsionen des mesencephalen Trigeminus-Sensorkerns stimulieren die Hippocampus-Neurogenese, führen jedoch zu schweren Defiziten beim Zurücksetzen des räumlichen Gedächtnisses. Gehirn Res 1342: 74-84.
- Lopez J, Roffwarg HP, Dreher A, Bissette G, Karolewicz B, et al. (2008) Rapid Eye movement Schlafentzug verringert die langfristige Potenzierungsstabilität und beeinflusst einige glutamaterge Signalproteine während der Hippocampusentwicklung. Neurowissenschaften 153: 44-53.