Intrauterine Insemination beim Hund

In: Recent Advances in Small Animal Reproduction, P. W. Concannon, G. England und J. Verstegen (Hrsg.) Publisher: Deutsche Gesellschaft für Veterinärmedizin (www.ivis.org ), Ithaca, New York, USA.
Intra-uterine Insemination beim Hund mit dem skandinavischen trans-zervikalen Katheter und Vergleich mit anderen Methoden ( 2-Feb-2001 )
C. Linde-Forsberg
Veterinärmedizinische Fakultät, Abteilung für Geburtshilfe und Gynäkologie, Schwedische Universität für Agrarwissenschaften, Uppsala, Schweden
Einleitung
Das Interesse an der Konservierung von Hundesamen und künstlicher Befruchtung (KI) nimmt weltweit stetig zu, dennoch werden jedes Jahr vergleichsweise wenige Studien auf diesem Gebiet veröffentlicht, und es ist besonders schwierig, Daten von künstlichen Befruchtungen mit frischem Samen oder Samen zu finden, der nach verschiedenen Methoden zum Kühlen oder Einfrieren und Auftauen konserviert wurde, und auch Ergebnisse zu vergleichen, wenn verschiedene techniken zur Durchführung der Besamungen werden verwendet. Ein Grund für den Mangel an Daten ist, dass es teuer ist, experimentelle Studien an Hunden durchzuführen, und nur wenige Forschungszentren können groß genug Hundekolonien für diese Art von Studien halten. Ein weiterer Grund ist, dass die meisten großen Unternehmen, die Hundesamen für Hundezüchter verarbeiten und vertreiben, auf rein kommerzieller Basis arbeiten, und obwohl einige von ihnen Aufzeichnungen über ihre Ergebnisse zu führen scheinen, werden weder diese Ergebnisse noch die Zusammensetzung der Extender oder die Methoden zur Konservierung des Samens bekannt gegeben. Jedes so gewonnene Wissen wird daher bei den verschiedenen Unternehmen verbleiben und der wissenschaftlichen Welt und damit auch den Hundezüchtern im Allgemeinen keinen Nutzen bringen. Die einzigen Studien zur künstlichen Befruchtung von Hunden, die über Fruchtbarkeitsergebnisse aus einer großen Anzahl von Besamungen berichten, sind die von Seager et al., an 156 gefroren aufgetauten Samen-AIs unter Verwendung der vaginalen Ablagerung, Linde-Forsberg & Forsberg an 470 bzw. 527 AIs unter Verwendung von frischem, gekühltem und gefroren aufgetautem Samen und vaginaler sowie intrauteriner AI, Linde-Forsberg et al., auf 327 gefrorenen aufgetauten Samen-AIs, vaginale und intrauterine KI vergleichend, berichtet Linde-Forsberg über 2041 AIs mit frischem und gekühltem Sperma und gefrorenem aufgetautem Sperma und verwendet sowohl vaginale als auch intrauterine KI, und Thomassen et al., auf 312 gefroren-aufgetaut hauptsächlich intrauterine AIs. Eine Reihe von Faktoren sind für die Bestimmung der Erfolgsrate der künstlichen Befruchtung bei Hunden von Bedeutung, z. B. Wann und wie oft während des Östruszyklus der Hündin die künstliche Befruchtung durchgeführt wird, Samenqualität und -handhabung sowie die Besamungstechnik. Weitere Informationen zu diesen Facetten finden Sie in den zitierten Referenzen. Dieses Papier wird sich nur mit den Besamungstechniken und den Auswirkungen des Ortes der Samenablagerung befassen. Die jüngsten klinischen Studien haben die Bedeutung der intrauterinen im Gegensatz zur intravaginalen künstlichen Befruchtung beim Hund hervorgehoben und sind die ersten, die signifikant bessere Ergebnisse zeigen, wenn Sperma in der Gebärmutter und nicht in der Vagina abgelagert wurde. In der Studie von Linde-Forsberg et al., die Wurfrate unter Verwendung der intrauterinen Ablagerung von frozenthawed Samen war 84.4 % im Vergleich zu 58.9 % mit vaginaler Ablagerung, und die mittlere Wurfgröße betrug 5,4 + 3,0 im Vergleich zu 4,0
+2,7 Welpen / Wurf (P<0,001). Fertilitätsdaten von 2041 künstlichen Befruchtungen von Hunden, die zwischen 1990 und 1998 bei schwedischen Hündinnen durchgeführt und innerhalb von 2 Wochen an den Kennel Club gemeldet wurden (d. H. b. bevor ein Schwangerschaftstest hätte durchgeführt werden können, um Verzerrungen der Ergebnisse zu vermeiden), zeigten, dass signifikant höhere Wurfraten und Wurfgrößen nicht nur mit gefrorenem aufgetautem Sperma, sondern auch mit frischem sowie gekühltem verlängertem Sperma erhalten wurden, wenn das Sperma in der Gebärmutter und nicht in der Vagina abgelagert worden war (Tabelle 1).

Die in Tabelle 1 gezeigten Ergebnisse mit Frischsperma sind etwas zu hoch, da 11 % dieser Hündinnen aus verschiedenen Gründen nicht nur künstlich besamt, sondern auch gepaart wurden. Der häufigste Grund dafür war, dass die Züchter versuchten, die Hündinnen während der Brunst zu früh zu paaren, und wenn sich die Hunde nicht paaren würden, baten ihre Besitzer um eine KI. Die Wurfrate in der ebenfalls verpaarten Gruppe betrug 84,5% bei einer mittleren Wurfgröße von 6,0 + 2,8 Jungtieren, verglichen mit einer Wurfrate von 48,9% und einer mittleren Wurfgröße von 5,8 + 2,8 Jungtieren für die Hündinnen, die nur künstlich besamt wurden. Es scheint daher, dass eine Reihe der KIs, die mit frischem Samen durchgeführt werden, tatsächlich zu einem nicht optimalen Zeitpunkt während der Brunst durchgeführt werden, normalerweise aufgrund der Unerfahrenheit des Züchters, aber das vergleichsweise schlechte Ergebnis ist wahrscheinlich auch darauf zurückzuführen, dass KI aufgrund verschiedener Probleme bei den Hunden angefordert wird. Die schwedischen Daten zeigen jedoch deutlich, dass die intrauterine KI beim Hund die Wurfrate und Wurfgröße signifikant verbessert. Die Wurfrate durch intrauterine KI stieg im Vergleich zur vaginalen KI von 36% für frischen Samen auf 50% für gefrorenen aufgetauten Samen. Und mit intrauteriner AI stieg die mittlere Wurfgröße um 0,3 Welpen pro Wurf für gefrorenen Samen und um 0,6 und 0,7 pro Wurf für frischen und gekühlten verlängerten Samen. In diesem Zusammenhang ist es auch interessant festzustellen, dass der Hund bei der natürlichen Paarung als eine Art mit intrauteriner Samenablagerung angesehen wird, da die Spermatozoen zum Zeitpunkt der Kopulationsbindung die Eileiter erreicht haben . Die spermienreiche Fraktion wird bei der Intromission und im Frühstadium der Kopulationsbindung ejakuliert, gefolgt von einem großen Volumen Prostataflüssigkeit, das die Spermatozoen sofort aus der engen Schädelvagina durch den Gebärmutterhals in den Uteruskörper und die Hörner spült. Die Vagina scheint eine ungünstige Umgebung für Hunde-Spermatozoen zu bieten, da ein großer Teil ihre Schwänze innerhalb von Minuten nach der Ablagerung in der Schädelvagina verliert . Es wurde auch gezeigt, dass etwa 10-mal so viele Spermatozoen erforderlich sind, um ähnliche Ergebnisse durch vaginale AI wie durch intrauterine AI mit frischem Samen sowie mit gefrorenem aufgetautem Samen zu erzielen . Es gibt daher viele Faktoren, die zu den schlechteren Ergebnissen beitragen, die durch intravaginale Samenablagerung im Vergleich zur intrauterinen Ablagerung erzielt werden.
Methoden zur Durchführung der intrauterinen AI beim Hund.
Die intrauterine AI beim Hund kann transzervikal entweder mit dem skandinavischen (oder norwegischen) Katheter oder mit einem starren faseroptischen Vaginalendoskop zur Visualisierung des Gebärmutterhalses und einem Hundeharnkatheter zur transversalen Untersuchung erfolgen. Intrauterine AI kann auch durch invasive Methoden wie Laparoskopie oder vollständige Bauchchirurgie erreicht werden. In einigen Ländern können letztere Methoden illegal sein oder nicht als ethisch akzeptabel angesehen werden.
Palpation des Gebärmutterhalses
Für die Person, die eine Hunde-AI durchführen möchte, ist es unbedingt erforderlich, zu lernen, wie der Gebärmutterhals durch abdominale Palpation lokalisiert wird, um den Samen an der richtigen Stelle ablegen zu können und Verletzungen der Hündin zu vermeiden. Die Hündin sollte einen leeren Magen und eine leere Blase haben, um den Eingriff zu erleichtern. Für Trainingszwecke wird empfohlen, die Einweg-Vaginal-AI-Katheter aus Kunststoff für Hunde (Minitüb GmbH, Tiefenbach, Deutschland) zu verwenden (Abb. 1).
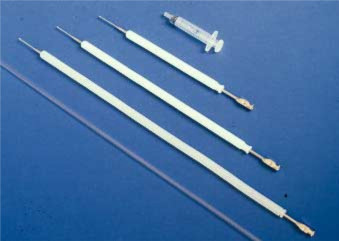
Abbildung 1. Die drei Größen des vaginalen künstlichen Befruchtungskatheters für Hunde und des vaginalen künstlichen Befruchtungskatheters für den einmaligen Gebrauch aus Kunststoff.Da sich die Harnröhrenöffnung der Hündin am Beckenrand befindet, ist es überraschend einfach, den AI-Katheter oder ein dünnes starres Endoskop unbeabsichtigt in die Harnblase einzuführen. Abgesehen von den Gefahren der Perforation der Blase mit dem Katheter ist es offensichtlich, dass nach einer KI keine Schwangerschaft folgen würde. Daher sollte die korrekte Position des Katheters immer durch Abtasten überprüft werden, bevor eine Samendosis abgegeben wird. Wenn sich der Katheter in der Harnblase befindet, können der Schädelteil der Vagina und der Gebärmutterhals über dem Katheter abgetastet werden. Die Wände der Harnblase sind normalerweise dünner als die der Vagina, und die Spitze des Katheters fällt deutlicher auf, als wenn sie in der Vagina wäre. Um den Gebärmutterhals abzutasten, wird ein AI-Katheter in die Vagina der Hündin eingeführt. Die Einführung des Katheters wird erleichtert, wenn die Vulva angehoben wird, bis sie knapp unter dem Anus liegt (wie wenn die Hündin für den Rüden steht). Wenn die Spitze des Katheters so weit eingeführt wird, dass er sofort kranial bis zum Beckenrand reicht, sollte er palpiert werden. Kranial fällt die Vagina bei den meisten Hündinnen leicht nach unten ab. Bei einigen Rassen, insbesondere bei Sichthunden mit sehr gewölbter Lende, hat die Vagina jedoch eine eher dorsale Richtung. Das kraniale Ende des Katheters sollte nun näher an die Bauchdecke abgesenkt werden, um für die Palpation zugänglicher zu werden. Wenn die Katheterspitze palpiert und damit ihre korrekte Position in der Vagina überprüft werden kann, wird sie unter fortgesetzter palpatorischer Kontrolle vorsichtig weiter eingeführt, bis sie den parazervikalen Bereich erreicht. Dies ist der schmale, kraniale Teil der Vagina, der durch die dorsale, mediane post-zervikale Falte erzeugt wird und als 1 bis 2 cm lange, feste Struktur palpiert werden kann. Es endet am Gebärmutterhals, der bei einer Hündin im Östrus eine 0,5 bis 1,5 cm harte, abgerundete bis eiförmige frei bewegliche Struktur ist. Es ist in der Regel nicht möglich, die äußere Schutzhülle des Herzkatheters, die einen Durchmesser von 10 mm hat, in den parazervikalen Bereich zu führen. Auch der dünnere Kunststoff-AI-Katheter mit einem Durchmesser von 5 mm kann bei einigen Hündinnen, insbesondere bei kleineren Rassen oder solchen, die keinen Wurf von Welpen zur Welt gebracht haben, zu breit sein, um in den parazervikalen Bereich eingeführt zu werden. Sobald der Gebärmutterhals identifiziert wurde, können der Corpus uteri und die Uterushörner vor dieser Struktur palpiert werden. Senken Sie die Spitze des Katheters ab und schließen Sie dann die Daumenspitze gegen die des Zeigefingers über dem Katheter. Ihre Größe und Konsistenz werden dann offensichtlich. (Diese Methode der Palpation der Gebärmutter ist auch sehr nützlich für die Früherkennung der Schwangerschaft und zur Untersuchung von Hündinnen mit Verdacht auf Pyometra).
Intrauterine Insemination mit dem skandinavischen Katheter
Der skandinavische Katheter besteht aus einem 1 – 2 mm breiten Stahlkatheter mit einer 0.75 mm bis 1 mm Durchmesser Spitze, und kommt in drei verschiedenen Längen: 20, 30 oder 40 cm. Es wird zusammen mit einer äußeren Schutzhülle aus Nylon mit einem Durchmesser von 10 mm verwendet (Abb. 1 und Fig. 2). Der mittelgroße Katheter passt für die meisten kleinen und mittelgroßen Hündinnen. Die Ausrüstung ist erhältlich bei der Norwegian Fur Breeders‘ Association, P.O. Box 136, Økern, N-0509 Oslo 5, Norwegen.

Abbildung 2. Eine Nahaufnahme der beiden Spitzengrößen des skandinavischen AI-Katheters für Hunde.
Die intrauterine AI mit dem skandinavischen Katheter wird durchgeführt, wenn die Hündin auf dem Boden oder auf einem Tisch steht. Sedierung ist sehr selten erforderlich, im Gegenteil, die meisten Hündinnen im Östrus akzeptieren diese Art der Handhabung frei. Falls eine leichte Sedierung erforderlich sein sollte, z.B. bei einer sehr großen, fettleibigen oder nervösen Hündin, kann 1 – 3 mg / kg Xylazin IM oder IV verwendet werden. Der innere Stahlkatheter, mit der Spitze innerhalb und geschützt durch die Nylonhülle, wird in die Vagina eingeführt. Das kraniale Ende der Nylonscheide wird wie zuvor beschrieben vor dem Beckenrand abgetastet. Wenn die Spitze der Katheterhülle näher an die Bauchdecke abgesenkt wurde, befindet sich der Gebärmutterhals normalerweise einige cm davor und darüber. Der Stahlkatheter wird dann durch die Hülle eingeführt, bis seine Spitze den ventralen Fornix erreicht. Der Gebärmutterhals wird zwischen Daumen und Zeigefinger fixiert und durch eine leicht nach unten gerichtete Traktion am Corpus uteri so geneigt, dass der Winkel des Gebärmutterhalskanals horizontaler wird (Abb. 3).
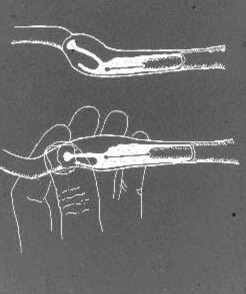
Abbildung 3. Eine schematische Zeichnung der eckzahnparazervikalen Region und des Zervikalkanals, wobei der Zervixkatheter in der Schädelvagina positioniert ist. Durch Manipulation am Gebärmutterhals und Corpus uteri wird der Winkel des Gebärmutterhalses geändert, um den Gebärmutterhalskanal besser auf die Spitze des Katheters auszurichten und die Katheterisierung zu erleichtern.
Die Spitze des Katheters wird dann vorsichtig zurückgezogen, während sie wiederholt gegen die Oberfläche des Gebärmutterhalses gedrückt wird, um die Öffnung des Gebärmutterhalskanals zu erreichen. Das Gefühl, wenn diese Öffnung gefunden wird, kann in den meisten Fällen als das Gefühl beschrieben werden, Knorpel zu berühren, d. H. „knusprig“. Sobald die Öffnung gefunden wurde, fixieren Sie den Katheter und beginnen Sie, den Gebärmutterhals gegen den Katheter zu drücken. Der Zervikalkanal ist 5 bis 10 mm lang und nicht immer ganz gerade. Daher muss möglicherweise ein leichter Druck ausgeübt werden, während der Katheter gedreht wird, um ihn durchzulassen. Bei den meisten Hündinnen ist die Spitze des Katheters leicht vor dem Gebärmutterhals im Corpus uteri zu spüren. Bei einigen Hündinnen ist das Gefühl jedoch nicht so ausgeprägt. Die Spritze, die Samen enthält, wird mit dem Katheter verbunden und der Samen langsam in die Gebärmutter infundiert. Manchmal besteht ein Infusionswiderstand, abhängig davon, ob die Öffnung des Katheters gegen die Endometriumschleimhaut drückt. Eine leichte Traktion des Corpus uteri oder des Gebärmutterhalses nach unten lindert normalerweise die Situation und ermöglicht die Sameninfusion. Um zu überprüfen, ob sich der Katheter wirklich in der Gebärmutter der Hündin befindet, können 1 – 2 ml physiologische Kochsalzlösung infundiert werden. Wenn sich der Katheter in der richtigen Position im Uteruskörper befindet, kann die Flüssigkeit leicht infundiert werden. Wenn sich der Katheter andererseits im parazervikalen Bereich befindet, kommt es zu einem fast sofortigen Rückfluss von Kochsalzlösung zwischen dem Katheter und der Nylonhülle. Der Katheter wird entfernt und die Hinterhand der Hündin angehoben und die Hündin nach der KI 5 – 10 Minuten in dieser Position gehalten, um den Rückfluss des Samens zu minimieren und den Uterustransport der Spermatozoen zu den Eileitern zu erleichtern . Die Hündin sollte auch um die perineale Region herum gefiedert sein, da angenommen wird, dass dies die Uteruskontraktionen stimuliert. Das Erlernen dieser Technik erfordert etwas Übung, aber sobald es gelernt ist, ist es eine schnelle Methode, die normalerweise innerhalb von Minuten durchgeführt wird. Es wird empfohlen, zunächst Organproben für Trainingszwecke und anatomische Untersuchungen zu erhalten. Es ist auch von Vorteil, wenn besonders die ersten Versuche bei Hündinnen gemacht werden, die einen oder mehrere Würfe zur Welt gebracht haben, da sie normalerweise viel einfacher zu katheterisieren sind. Perforationen können auftreten, wenn der Katheter blind oder mit Gewalt eingeführt wird. Vorausgesetzt, dass die Katheterisierung unter sorgfältiger palpatorischer Kontrolle durchgeführt wird, ist die Technik jedoch für die Hündin völlig sicher. Einige Hündinnen sind schwieriger zu katheterisieren, insbesondere solche, die zu einigen Riesenrassen gehören, sowie fettleibige oder nervöse Tiere. Mit dem skandinavischen Katheter waren nur zwischen 2 und 3,5% der Versuche einer intrauterinen Katheterisierung erfolglos . Es wurde berichtet, dass die resultierenden Wurfraten bei Verwendung von gefrorenem und aufgetautem Sperma 84 betragen.5% und 71%, wenn sie von erfahrenen Besamern durchgeführt wurden, durchschnittlich 65% mit frischem und gekühltem Sperma und 52% mit gefrorenem und aufgetautem Sperma, in einer größeren Feldstudie, an der auch weniger erfahrene Besamungen teilnahmen (Abb. 1). Diese Technik kann auch für die intrauterine Infusion von Kontrastmittel zur hysterographischen Untersuchung der Hündin verwendet werden .
Intrauterine Insemination mittels endoskopischer Visualisierung des Gebärmutterhalses
Die transzervikale intrauterine Insemination kann auch mit Hilfe eines starren faseroptischen Endoskops und eines Harn- oder Angiographiekatheters im Stehen und ohne Sedierung erfolgen (Abb. 4 und Fig. 5).

Die intrauterine Insemination mittels Laparoskopie
Die abdominale Laparoskopie sollte eine etwas akzeptablere Alternative zur vollständigen Operation für AI beim Hund bieten. Die Technik wurde von Wildt und Silva et al. . Eine Schwangerschaftsrate von 60 bis 73% wurde von AI mit Laparoskopie berichtet , aber die Anzahl der Hündinnen in diesen Studien war gering.
Intrauterine Insemination mittels Operation
Es wurde über eine Operation zur Durchführung einer intrauterinen Insemination berichtet . Verschiedene chirurgische Verfahren wurden verwendet, mit der Hündin unter Vollnarkose und in dorsaler Liegeposition. Das ventrale Abdomen wird abgeschnitten, und nach routinemäßiger chirurgischer Vorbereitung wird ein 4-6 cm langer Einschnitt in der Mitte zwischen Schambein und Nabel durch die Linea alba gemacht. Der Uterus wird durch den Einschnitt angehoben, und die Nadel der Spritze, die den Samen enthält, wird in einem Winkel von 45o mit der Abschrägung der Nadel nach oben in das Lumen des Uteruskörpers eingeführt. Der Samen wird langsam in die Gebärmutter injiziert. Es sollte leicht mit offensichtlicher Ausdehnung der Uterushörner fließen, oder die Nadel sollte neu positioniert werden. Eine mit Kochsalzlösung angefeuchtete Gaze wird über die Injektionsstelle gehalten, nachdem die Nadel zurückgezogen wurde. Nach 1 min wird die Gaze entfernt, der Uterus in den Bauch eingeführt und die Wunde routinemäßig geschlossen. Um einen Rückfluss des Samens zu vermeiden, sollte die Hündin mit erhobenem Rücken positioniert werden, wenn sie sich von der Narkose erholt. Etwa 60% Schwangerschaftsrate wurde nach chirurgischer KI beim Hund berichtet , aber wie bei der laparoskopischen KI basieren die Ergebnisse auf begrenzten experimentellen Studien und es liegen keine Felddaten zur Auswertung mit beiden Methoden vor. Ob es ethisch akzeptabel ist, auf eine Operation zurückzugreifen, um Schwangerschaften zu erreichen, ist umstritten. Die Methode, obwohl von einigen befürwortet, wird von vielen als unethisch und inakzeptabel stressig für die Hündin angesehen. Infektionsrisiken etc. im Zusammenhang mit der Operation im Allgemeinen und der begrenzten Anzahl von chirurgischen KIS, die in einer bestimmten Situation durchgeführt werden können, sind zwei offensichtliche Nachteile. Das Verfahren ist auch kostspielig und zeitaufwendig.
1. In: Seager SWJ, Platz CC, Fletcher WS. Empfängnisraten und verwandte Daten unter Verwendung von gefrorenem Hundesamen. J Reprod Fertil 1975;45:189-192.
2. Linde-Forsberg C, Forsberg M. Fruchtbarkeit bei Hunden in Bezug auf die Samenqualität und den Zeitpunkt und Ort der Besamung. J Reprod Fertil 1989;39(Suppl): 299-310. – PubMed –
3. Linde-Forsberg C, Forsberg M. Ergebnisse von 527 kontrollierten künstlichen Befruchtungen bei Hunden. J Reprod Fertil 1993;47(Suppl): 313-323. -PubMed –
4. Linde-Forsberg C, Ström Holst B, Govette G. Vergleich der Fertilitätsdaten aus der vaginalen mit der intrauterinen Insemination von gefrorenem aufgetautem Hundesamen: Eine retrospektive Studie. Theriogenologie 1999;52: 11-23. -PubMed –
5. Linde-Forsberg C. Fertilitätsdaten von 2041 kontrollierten künstlichen Befruchtungen bei Hunden. In: Proceeding of the 4th Int Symp Canine Feline Reprod, Oslo, 2000, 120 S.(abstr.)
6. Thomassen R, Farstad W, Krogenaes, A, Fougner, J.A. und Andersen Berg K. Künstliche Befruchtung mit gefrorenem Samen beim Hund. Eine retrospektive Studie. J Reprod Fertil 2001, im Druck.
7. In: Tsutsui T, Kawakami E, Murao I, et al. Transport von Spermatozoen im Fortpflanzungstrakt der Hündin: Beobachtungen durch Uterusfisteln. Jpn J Vet Sci 1989;51: 560-565. -PubMed –
8. Linde-Forsberg C. Künstliche Befruchtung mit frischem, gekühltem und gefrorenem Samen beim Hund. Seminare in Vet Med Surg (Kleintier) 1995;10: 48-58.
9. Tsutsui T, Tezuka T, Shimizu T, Murao I, Kawakami E, Ogasa A. Künstliche Befruchtung mit frischem Sperma bei Beagle-Hündinnen. Jpn J Vet Sci 1988;50: 193-198.
10. Andersen K. Besamung mit gefrorenem Hundesamen basierend auf einer neuen Besamungstechnik. Zuchthyg 1975;10: 1-4.
11. Linde C. Transport von röntgenopaker Flüssigkeit in die Gebärmutter nach vaginaler Ablagerung in der Östrogenhündin. Acta vet scand 1978;19:463-465.
12. Funkquist B, Lagerstedt A-S, Linde C, Obel N. Hysterographie bei der Hündin. Tierarzt Radiol 1985;26:12-18.
13. Wilson M. Nicht-chirurgische intrauterine künstliche Befruchtung bei Hündinnen mit gefrorenem Samen. J Reprod Fertil 1993; 47 (Ergänzung): 307-311. -PubMed –
14. Battista M, Parks J, Concannon PW. Überleben von Hundespermien nach dem Auftauen nach dem Einfrieren in Strohhalmen oder Pellets unter Verwendung von ROHREN, Laktose, Tris oder Testverlängerern. In: Proceedings des 11. Int Congr Anim Reprod und AI, Dublin 1988;3: 229-231.
15. Wildt DE. Laparoskopie. In: Zeitschrift für Betriebswirtschaftslehre, ed. Fortpflanzung von Kleintieren und Unfruchtbarkeit. Philadelphia: Lea & Febiger, 1986;121-140.
16. Silva LDM, Onclin K, Snaps F, Verstegen JP. Laparoskopische intrauterine Insemination bei der Hündin. Theriogenologie 1995;43: 615-623.
17. Silva LDM, Verstegen JP. Vergleiche zwischen drei verschiedenen Extendern für die intrauterine Insemination von Hunden mit gefrorenen und aufgetauten Spermatozoen. Theriogenologie 1995;44: 571-579.
18. Silva LDM, Onclin K, Lejeune B, Verstegen JP. Vergleiche der intravaginalen und intrauterinen Insemination von Hündinnen mit frischem oder gefrorenem Samen. Vet Rec 1996;138: 154-157. – PubMed –
19. Smith FO, Graham EF: Kryokonservierung von Hundesamen: Technik und Leistung. In: Proceedings des X. Int Congr Anim Reprod und AI, Champaign-Urbana 1984;2: 216.
20. In: Hutchison RV. Vaginal & chirurgische intrauterine Ablagerung von Samen. In: Proceedings des Canine Theriogenology Short Course 1993; 33-37.
21. In: Hutchison RV. Maximierung der Empfängnisraten mit frisch gekühltem oder gefrorenem Hundesamen. In: Proceedings of the Canine Male Reprod Symp 1997; 61-70.