Gemeinsamer Ioneneffekt
Wissenschaft > Chemie > Physikalische Chemie > Ionengleichgewichte > Gemeinsamer Ioneneffekt
In in diesem Artikel werden wir den gemeinsamen Ioneneffekt und seine Anwendungen untersuchen.
Das Phänomen, bei dem der Dissoziationsgrad eines schwachen Elektrolyten durch Zugabe einer kleinen Menge eines starken Elektrolyten, der ein gemeinsames Ion enthält, unterdrückt wird, wird als gemeinsamer Ioneneffekt bezeichnet.
Beispiel 1: (Dissoziation einer schwachen Säure)
Die Ionisierung von schwachem Elektrolytessigsäure (CH3COOH)wird durch Zugabe von starkem Elektrolytnatriumacetat (CH3COONa) unterdrückt, das gewöhnliches Acetationen (CH3COO–)enthält
Erklärung:
Angenommen, ein Elektrolytessigsäure (CH3COOH) wird mit Wasser behandelt. Es dissoziiert und ein Gleichgewicht existiertwie folgt,
CH3COOH(aq) ⇌CH3COO–(aq) + H+(aq)
Durch Anwendung des Gesetzes der Massenaktion,
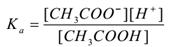
Wobei ‚Ka‘ die Dissoziationskonstante von Säure ist.
Wenn eine kleine Menge eines starken Elektrolyten wie Natriumacetat (CH3COONa) zu der wässrigen Lösung von CH3COOH gegeben wird, wird es dissoziiert und das Gleichgewicht besteht, da
CH3COONa(aq) → CH3COO–(aq) + Na+(aq)
Hier sind CH3COO– Ionen üblich, daher steigt ihre Konzentration an. Nach Le-Chateliers Prinzip verschiebt sich das Gleichgewicht nach links. Um den Wert von Ka konstant zu halten, wird die Konzentration von CH3COOH-Molekülen erhöht. Auf diese Weise wird die Ionisation von CH3COOH durch Zugabe von CH3COONa unterdrückt. Somit erhöht sich der pH-Wert der Lösung.
Beispiel – 2: (Dissoziation eines schwachen Elektrolyten):
Die Ionisierung von schwachem Elektrolytammoniumhydroxid (NH4OH)wird durch Zugabe von starkem Elektrolytammoniumchlorid (NH4Cl) unterdrückt, das gewöhnliches Ammoniumion (NH4+) enthält
Erklärung:
Angenommen, ein Elektrolytammoniumhydroxid (NH4OH)wird mit Wasser behandelt. Es dissoziiert und ein Gleichgewicht existiertwie folgt,
NH4OH(aq) ⇌ NH4+(aq) + OH–(aq)
Durch Anwendung des Gesetzes der Massenaktion,
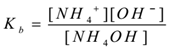
Wobei ‘Kb‘ die Dissoziationskonstante der Basis ist.
Wenn eine kleine Menge eines starken Elektrolyten wie Ammoniumchlorid (NH4Cl) zu der wässrigen Lösung von NH4OH gegeben wird, wird es dissoziiert und es besteht ein Gleichgewicht, da
NH4Cl(aq) → NH4+(aq) + Cl–(aq)
Hier sind NH4 + -Ionen üblich, daher steigt ihre Konzentration an. Nach Le-Chateliers Prinzip verschiebt sich das Gleichgewicht nach links. Um den Wert von Kb konstant zu halten, wird die Konzentration von NH4OH-Molekülen erhöht. Auf diese Weise wird die Ionisation von NH4OH durch Zugabe von NH4Cl unterdrückt. Somit nimmt der pH-Wert der Lösung ab.
Anwendungen des gemeinsamen Ioneneffekts:
Reinigung von Kochsalz:
Prinzip:
Die Zugabe von Kochsalz zu einer gesättigten Salzlösung bewirkt die Ausfällung von Salz. Wenn das ionische Produkt das Löslichkeitsprodukt überschreitet, findet eine Ausfällung statt.
Prozess und Erklärung:
Eine gesättigte Lösung von Kochsalz, frei vonsuspendierten Verunreinigungen, wird entnommen und HCl-Gas wird durchgeleitet. In einer gesättigten Lösung von unreinem NaCI besteht das Gleichgewicht wie folgt:
NaCl(aq) → Na+(aq) + Cl–(aq)
Wenn reines HCI–Gas durch diese Lösung geleitet wirdstarker Elektrolyt, dissoziiert es fast vollständig und Gleichgewicht besteht,
HCl(aq) → H+(aq) + Cl–(aq)
Jetzt ist Cl- ein gemeinsames Ion. Die Konzentration von CI- Ionen (gemeinsame Ionen) wird erhöht. Nach dem Prinzip von Jean-Chatelier verschiebt sich das Gleichgewicht nach links. Die Dissoziation von NaCI wird unterdrückt und reines NaCI als Festsalz ausgefällt. So kann reines NaCI ausgefällt werden, indem man HCI-Gas in thesaturated Lösung des unreinen NaCI leitet.
Aussalzen von Seife:
Prinzip:
Die Zugabe von gewöhnlichem Ion zu einer gesättigten Salzlösung bewirkt die Ausfällung von Salz. Wenn das ionische Produkt das Löslichkeitsprodukt überschreitet, findet eine Ausfällung statt.
Prozess und Erklärung:
Seife ist Natriumsalz höherer Fettsäuren(RCOONa). Es wird durch Hydrolyse von Ölen mit NaOH hergestellt. In gesättigter Seifenlösung besteht ein Gleichgewicht,
ROONa(aq) → RCOO–(aq) + Na+(aq)
Wenn der gesättigten Seifenlösung eine kleine Menge NaCl zugesetzt wird, dissoziiert sie als
NaCl(aq) → Na+(aq) + Cl–(aq)
Die Konzentration von Na + -Ionen (gemeinsames Ion) nimmt zu. Aufgrund des allgemeinen Ioneneffekts wird die Dissoziation von Seife verringert und Seife fällt aus und kann dann leicht aus der Seifenlösung entfernt werden. Dieser Prozess der Gewinnung fester Seife aus Seifenlösung durch Zugabe von Salz wie NaCI wird als Aussalzen von Seife bezeichnet.