Department of Animal Science – Pflanzen giftig für Vieh
Ricin Toxin aus Rizinuspflanze, Ricinus communis
Ricin ist eine der giftigsten natürlich vorkommenden Substanzen bekannt.
Die Samen der Rizinuspflanze Ricinus communis sind giftigfür Menschen, Tiere und Insekten. Eines der wichtigsten toxischen Proteine ist „Ricin“, das Stillmark 1888 benannte, als er den Extrakt der Bohnen an roten Blutkörperchen testete und sah, wie sie agglutinierten. Jetzt wissen wir, dass die Agglutination darauf zurückzuführen warzu einem anderen Toxin, das ebenfalls vorhanden war, genannt RCA (Ricinus Communisagglutinin). Ricin ist ein starkes Zytotoxin, aber ein schwaches Hämagglutinin, wobei ASRCA ein schwaches Zytotoxin und ein starkes Hämagglutinin ist.
Vergiftung durch Einnahme der Rizinusbohne ist auf Ricin zurückzuführen, NICHTRCA, weil RCA nicht in die Darmwand eindringt und nicht betroffenrote Blutkörperchen, es sei denn intravenös gegeben. Wenn RCA in das Blut injiziert wird,agglutinieren und platzen die roten Blutkörperchen durch Hämolyse.
Vielleicht kann nur ein Milligramm Ricin einen Erwachsenen töten. Die Symptome einer menschlichen Vergiftung beginnen innerhalb weniger Stunden nach der Einnahme.
Die Symptome sind:
- Bauchschmerzen
- Erbrechen
- Durchfall, manchmal blutig.
Innerhalb weniger Tage gibt es:
- schwere Dehydratation,
- eine Abnahme des Urins,
- und eine Abnahme des Blutdrucks.
Wenn der Tod nicht in 3-5 Tagen eingetreten ist, erholt sich das Opfer normalerweise.Es ist ratsam, Kinder von der Rizinuspflanze oder den Halsketten fernzuhaltenmit seinen Samen gemacht. In der Tat donít haben sie sogar in oder um ein Haus withsmall Kinder. Wenn sie die Blätter verschlucken oder die Samen schlucken, können sie getpoisoned. Die hochgiftige samen perlen in halsketten, verursachen haut irritationat die kontaktieren punkt.
Wenn der Samen ohne Kauen geschluckt wird und die Samenschale nicht beschädigt wird, wird er höchstwahrscheinlich harmlos durch den Verdauungstrakt gelangen. Wenn es jedoch gekaut oder zerbrochen und dann verschluckt wird, wird das Ricintoxin vom Darm aufgenommen.
Es wird gesagt, dass nur ein Samen ein Kind töten kann. Kinder sind empfindlicher alsErwachsene zu Flüssigkeitsverlust durch Erbrechen und Durchfall, und kann schnell becomeseverely dehydriert und sterben.
Rizinuspflanzen in einem Garten sollten nicht blühen und säen dürfen.
Rizinuspflanze, Vergiftung und Öl
 Die Rizinuspflanze, Ricinus communis, ist eine „aus dem tropischen Afrika stammende“, die in verschiedenen Sorten für das in ihren Blättern enthaltene Öl und für ihre dicke kultiviert wirdlaub.“(Alber und Alber)
Die Rizinuspflanze, Ricinus communis, ist eine „aus dem tropischen Afrika stammende“, die in verschiedenen Sorten für das in ihren Blättern enthaltene Öl und für ihre dicke kultiviert wirdlaub.“(Alber und Alber)
Die „gestielten Blätter bestehen aus meist acht strahlenden, spitzen Blätternmit leicht gezackten Rändern und markanten zentralen Adern. Viele Sorten sindgrün, aber einige sind rotbraun.“(Cooper und Johnson) Die Blüten sindgrün und unauffällig, aber rosa oder rot in den pigmentierten Sorten. Manystamens sind in der Nähe der Basis und Verzweigung Stempel sind in der Nähe der Spitze derflower. Die weichstachligen Früchte mit attraktiv gesprenkelten Samensind charakteristische Merkmale der Pflanze.
Es wird als Zierpflanze in Gärten angebaut, manchmal als Zimmerpflanze und auchwächst als Unkraut. Es ist eine jährliche im Süden und eine Staude in den Tropen, und es kann „15 Meter hoch im Freien“ erreichen. Es ist ein holziges Kraut aus der Familie der Euphorbiacea (Wolfsmilch).
Rizinusölvergiftung – Kinder
 Es ist ratsam, Kinder von der Rizinuspflanze oder den mit ihren Samen hergestellten Halsketten fernzuhalten. In der Tat haben sie nicht einmal in oder um ein Haus withsmall Kinder. Wenn sie die Blätter verschlucken oder die Samen schlucken, können sie getpoisoned. Die hochgiftige samen perlen in halsketten, verursachen haut irritationat die kontaktieren punkt.
Es ist ratsam, Kinder von der Rizinuspflanze oder den mit ihren Samen hergestellten Halsketten fernzuhalten. In der Tat haben sie nicht einmal in oder um ein Haus withsmall Kinder. Wenn sie die Blätter verschlucken oder die Samen schlucken, können sie getpoisoned. Die hochgiftige samen perlen in halsketten, verursachen haut irritationat die kontaktieren punkt.
Wenn der Samen ohne Kauen geschluckt wird und die Samenschale nicht beschädigt wird, wird er höchstwahrscheinlich harmlos durch den Verdauungstrakt gelangen. Wenn es jedoch gekaut oder zerbrochen und dann verschluckt wird, wird das Ricintoxin vom Darm aufgenommen.
Es wird gesagt, dass nur ein Samen ein Kind töten kann. Kinder sind empfindlicher alsErwachsene zu Flüssigkeitsverlust durch Erbrechen und Durchfall, und kann schnell becomeseverely dehydriert und sterben.
Rizinuspflanzen in einem Garten sollten nicht blühen und säen dürfen. Eine gute Praxis ist es, „es im Keim zu ersticken“.
Mord
 1978 wurde Ricin verwendet, um Georgi Markov 1978 zu ermorden, einen bulgarischen Journalisten, der sich gegen die bulgarische Regierung aussprach. Er wurde mit der Spitze eines Regenschirms gestochen, als er an einer Bushaltestelle in der Nähe der Waterloo Station in London wartete. Sie fanden ein perforiertes metallpelletembedded in seinem Bein, das vermutlich das Ricingift enthalten hatte.
1978 wurde Ricin verwendet, um Georgi Markov 1978 zu ermorden, einen bulgarischen Journalisten, der sich gegen die bulgarische Regierung aussprach. Er wurde mit der Spitze eines Regenschirms gestochen, als er an einer Bushaltestelle in der Nähe der Waterloo Station in London wartete. Sie fanden ein perforiertes metallpelletembedded in seinem Bein, das vermutlich das Ricingift enthalten hatte.
Tiere
 Blattläuse, rechts auf einem Blatt der Rizinuspflanze gezeichnet, sind anfälligvergiftung durch Einnahme des Phloems. Die Saftsauger starben innerhalb von 24 Stunden nach der Fütterung.
Blattläuse, rechts auf einem Blatt der Rizinuspflanze gezeichnet, sind anfälligvergiftung durch Einnahme des Phloems. Die Saftsauger starben innerhalb von 24 Stunden nach der Fütterung.
Die Larven des europäischen Maisbohrers und des südlichen Maiswurzelwurms wurden getötet, als sie mit 2% Ricin beschichtetem Futter ausgesetzt wurden. Studien wie diese werden genutzt, um „natürliche“ Pestizide zu entwickeln.
Rizinusbohnen werden als Zutat in einigen Tierfuttermitteln verwendet, nachdem das Öl extrahiert oder durch Erhitzen für 20 Minuten bei 140oC inaktiviert wurde. Versuche, Rizinusbohnen in Futtermitteln für Nutztiere zu verwenden, beinhalten verschiedene Methoden der Inaktivierung von Ricin unter Beibehaltung des Nährwerts. Einige Studien haben gezeigt, dass selbst nach einer solchen Wärmebehandlung die Toxizität erhalten bleibt. Zum Beispiel war es tödlich für Stockenten, die das Futter erhielten. „Die Toxizität des Mehls könnte entweder auf einen hitzestabilen oder wachstumshemmenden Faktor oder auf winzige Rückstände von Ricin zurückzuführen sein“(Okoye et al.) Eine Studie mit Schafen zeigte, dass autoklaviertes Castor-Bean-Meal in 10% der Schafrationen ohne negative Auswirkungen aufgenommen werden kann.
Eine Studie mit Schafen zeigte, dass autoklaviertes Castor-Bean-Meal in 10% der Schafrationen ohne negative Auswirkungen aufgenommen werden kann.
Vergiftungen von Nutztieren treten normalerweise durch versehentliche Einarbeitung von Castorbohnen in ihr Futter auf. Pferde sind besonders gefährdet.
Weitere Informationen zu den Auswirkungen von Ricin auf Nutztiere finden Sie unter…“Giftige Pflanzen“, Ricinus Communis, http://res.agr.ca./
Rizinusöl
Rizinusbohnen werden gepresst, um Rizinusöl zu extrahieren, das für medizinische Zwecke verwendet wirdzwecke. Ricin geht nicht in das Öl über, da es wasserlöslich ist,daher enthält Rizinusöl kein Ricin, sofern während seiner Herstellung keine Kreuzkontamination aufgetreten ist. Weitere Informationen, die sie beschreiben, finden Sie unter der Auflistung für Castor Bean im Canadian Poisonous Plants Information System, mit freundlicher Genehmigung von Derek B. Munro.
Mechanismus der toxischen Wirkung
 Es wurden viele zytotoxische Proteine aus einer Vielzahl von Pflanzen identifiziert, die sowohl in ihrer Struktur als auch in ihrer Funktion mit Ricin verwandt sind. Sie hemmen die Proteinsynthese, indem sie eukaryotische Ribosomen spezifisch und irreversibel inaktivieren.
Es wurden viele zytotoxische Proteine aus einer Vielzahl von Pflanzen identifiziert, die sowohl in ihrer Struktur als auch in ihrer Funktion mit Ricin verwandt sind. Sie hemmen die Proteinsynthese, indem sie eukaryotische Ribosomen spezifisch und irreversibel inaktivieren.
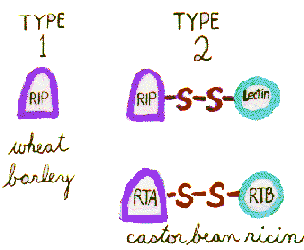
Diese „Ribosomen-inaktivierenden Proteine“ (RIPs) sind typicallyN-glykosylierte, 30 kDa Monomere (Typ 1 RIPs). Um jedoch Galactoside an die Zelloberfläche zu binden und in das Cytosol zu gelangen, um Ribosomen zu erreichen, benötigen sie ein zweites Monomer, ein Galactose-bindendes 30-kDa-Lektin. Themonomere werden durch eine Disulfidbrücke verbunden, um die toxischen Heterodimere (Typ 2 RIPs) zu bilden.
Einige Pflanzen, wie Weizen Undgerste, haben nur Typ-1-Risse und sind nicht giftig, während andere, wie der Castorbean-Pflanzensamen, die Typ-2-Risse enthalten, die zu den stärksten Zytotoxinen in der Natur gehören. 5% des Ricinussamens bestehen aus Ricin und RCA (Ricinus Communisagglutinin).
Ricin ist ein heterodimeres RIP vom Typ 2. Dieses Ribosomen-inaktivierende Enzym (32kDa), auch als A-Kette bekannt, ist durch eine Disulfidbindung an das Galactose / N-Acetylgalactosamin-bindende Lektin (34 kDa), auch B-Kette genannt, gebunden.
Ricin-Biosynthese
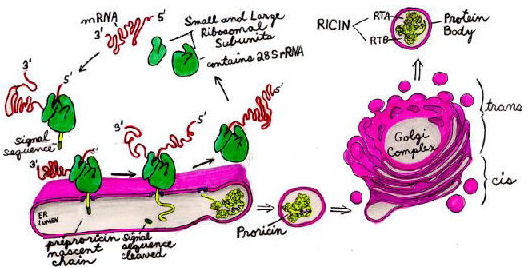
Ricin und RCA werden in den Endospermzellen reifender Samen synthetisiert und in einer Organelle gespeichert, die als „Proteinkörper“ bezeichnet wird, einem vakuolaren Kompartiment. Wenn der reife Samen keimt, werden die Toxine durch Hydrolyse zerstörtinnerhalb weniger Tage.
Ricin beginnt die Synthese als Präpropolypeptid, das sowohl A- als auch B-Ketten enthält. Die Signalsequenz des Nh3-Terminus zielt thenascent Kette zum endoplasmatischen Retikulum (ER) und wird dann abgespalten. Wenn sich das Proricin-Polypeptid verlängert, wird es innerhalb des Lumens des ER N-glykosyliert. Proteindisulfid-Isomerasen katalysieren die Disulfid-Bindungsbildung, wenn sich das Proricinmolekül selbst faltet. Proricin unterzieht sich weiteren Oligosaccharidmodifikationen innerhalb des Golgi-Komplexes und wird dann in Vesikeln zu den Proteinkörpern transportiert.
Ricin ist nicht katalytisch aktiv, bis es proteolytisch durch Anendopeptidase innerhalb der Proteinkörper gespalten wird. Dadurch wird das Polypeptid in die A-Kette und die B-Kette gespalten, die noch durch eine einzige Disulfidbindung verbunden sind. Da Ricin bis dahin inaktiv ist, vermeidet die Pflanze, ihre eigenen Ribosomen zu vergiften, falls während der Synthese und des Transports versehentlich etwas Proricin in das Cytosol gelangt.
Ricin Enzymatische Wirkung
Das Ricin Ein Teil des Heterodimers ist das Enzym, das bindet unddepuriert ein spezifisches Adenin der 28S rRNA. Das adeninering des Ribosoms wird zwischen zwei Tyrosinringen in thecatalytic Spalte des Enzyms eingeklemmt und wird durch die enzymeísN-glycosidase Handlung hydrolysiert. Das Zieladenin ist eine spezifische RNA-Sequenz, dieenthält die ungewöhnliche Tetranukleotidschleife, GAGA. Ricin ist aktiver gegen tierische als pflanzliche Ribosomen, und intakte bakterielle Ribosomen sind im Allgemeinen nicht anfällig.
Ricinstruktur
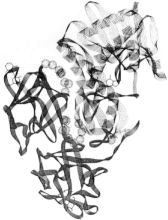 Diese Abbildung von Lord et al. zeigt eine 3-dimensionale Bandzeichnung von Ricin, die aus Röntgenkristallographiedaten modelliert wurde.Die obere rechte Hälfte, das gepunktete Band, ist die A-Kette und die untere linke Hälfte, das feste Band, ist die B-Kette.
Diese Abbildung von Lord et al. zeigt eine 3-dimensionale Bandzeichnung von Ricin, die aus Röntgenkristallographiedaten modelliert wurde.Die obere rechte Hälfte, das gepunktete Band, ist die A-Kette und die untere linke Hälfte, das feste Band, ist die B-Kette.
Die A-Kette (oder RTA)ist ein globuläres Protein mit 267 Aminosäuren. Es hat 8alpha helices und 8 beta blätter. Die Substratbindungsstelle ist die Spalte, die durch den Substratadeninring gekennzeichnet ist.
Die B-Kette (oder RTB) ist ein 262-Aminosäure-Protein, das wie Abarbell geformt ist. Es hat an jedem Ende eine Bindungsstelle für Galactose (dargestellt durch Lactosin). Diese beiden Stellen ermöglichen die Wasserstoffbindung an bestimmte Membranzucker (Galactose und N-Acetylgalactosamin). Eine Disulfidbrücke (-S-S-) verbindet rtamit RTB (ganz rechts, Mitte). Die Kugeln sind eingeschlossene Wassermoleküle.
Ricinaufnahme
Der RTB-Anteil von Ricin bindet sowohl an Glykoproteine als auch an Glykolipide an Zelloberflächen, die mit Galactose enden. Es hat zwei Bindungsstellen für Galactose, und 106 bis 108 Ricinmoleküle können pro Zelle binden. Allerdings kann nur ein Singlericin-Molekül, das in das Cytosol eintritt, über 1.500 Ribosomen inaktivieren, die die Zelle perminieren und töten.
Wie im Diagramm gezeigt, beinhaltet die 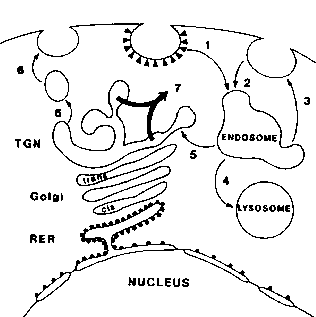 Weg zur Internalisierung von Ricin:
Weg zur Internalisierung von Ricin:
- Endozytose durch beschichtete Gruben und Vesikel oder
- Endozytose durch glatte Gruben und Vesikel. Die Vesikel verschmelzen mit Anendosom.
- Viele Ricinmoleküle werden durch Exozytose an die Zelloberfläche zurückgeführt, oder
- Die Vesikel können zu Lysosomen verschmelzen, wo das Ricin zerstört würde.
- Wenn die ricinhaltigen Vesikel mit dem Trans-Golgi-Netzwerk (TGN) verschmelzen, besteht immer noch die Möglichkeit, dass sie
- an die Zelloberfläche zurückkehren.
- Toxische Wirkung tritt auf, wenn RTA, unterstützt durch RTB, die Tgnmembran durchdringt und in das Cytosol freigesetzt wird.
Einmal im Cytosol, katalysiert der RTA die Depurinierung der Ribosomen und stoppt die Proteinsynthese.
Therapeutische Anwendungen von Immunotoxinen
Ricin kann auf spezifische Zellen, wie Krebszellen, abzielen, indem die RTA-Untereinheit an Antikörper oder Wachstumsfaktoren angepasst wird, die die unerwünschten Zellen vorzugsweise binden. Diese Immunotoxine haben sich sehr gut für In-vitro-Anwendungen, z. B. Knochenmarktransplantationen, bewährt. Obwohl sie in vielen In-vivo-Situationen nicht sehr gut funktioniert haben,sind die Fortschritte in diesem Forschungsbereich vielversprechend für die Zukunft.
IN-VITRO-ANWENDUNGEN
Bei Knochenmarktransplantationen wurden RTA-Immunotoxine erfolgreich zur Zerstörung von T-Lymphozyten im Knochenmark von histokompatiblen Spendern eingesetzt. Dies reduziert die Abstoßung des Tumorknochenmarks, ein Problem, das als „Graft-vs-Host-Krankheit“ (GVHD) bezeichnet wird. In steroidresistenten, akuten GVDH-Situationen halfen RTA-Immunotoxine, den Zustand zu lindern. Bei der autologen Knochenmarktransplantation wird eine Probe des patienteneigenen Knochenmarks mit Anti-T-Zell-Immuntoxinen behandelt, um maligne T-Zellen bei T-Zell-Leukämien und Lymphomen zu zerstören.
IN-VIVO-ANWENDUNGEN
„Bei der In-vivo-Behandlung solider Tumore können erhebliche Probleme durch schlechten Zugang des Immunotoxins (IT) zur Tumormasse, fehlende IT-Spezifität, Tumorzellheterogenität, Antigen-Shedding, Abbau oder schnelle Clearance des IT und dosislimitierende Nebenwirkungen auftreten“. (Herr et al.). Ein häufiges Problem bei Patienten, die mit Ricin-Immunotoxinen behandelt werden, ist das „vaskuläre Lecksyndrom“, bei dem Flüssigkeiten aus Blutgefäßen austreten, was zu Hypalbuminämie, Gewichtszunahme und Lungenödem führt. „Die Forschungsanstrengungen zur Erweiterung und Entwicklung von Immunotoxinen und Therapien für den klinischen Einsatz bei Krebs und AIDS werden mit Strategien fortgesetzt, die die rekombinante DNA-Technologie nutzen (Lord et al.).
Toxigene Ablation
Toxigene
„Toxigene sind DNA-Fusionen, bei denen DNA, die für ein potentes Toxin, z. B. RTA, kodiert, unter der transkriptionellen Kontrolle eines gewebe- oder entwicklungsstadienspezifischen Promotors und/oder Enhancers platziert wird. Bei intrazellulärer Expression verursacht das Toxigenprodukt den Zelltod. Die Einführung und Expression von Atoxigen in transgenen Tieren oder Pflanzen kann zu einer Zelltyp-Spezifierung führen, die zur
- Untersuchung von Entwicklungszelllinien oder zur
- Generierung von Tiermodellen degenerativer Erkrankungen verwendet werden kann.“ (Lord et al.)
Suizidtransport
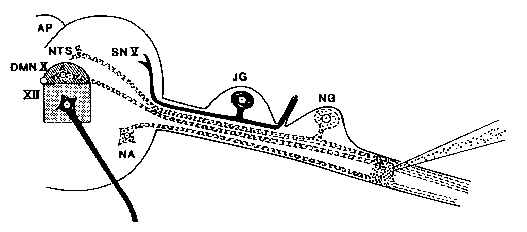
Das Diagramm zeigt die Injektion von Ricin in den Vagusnerv und die anschließende Zerstörung von Neuronen (gestrichelte Neuronen zerstört, feste Neuronen nicht betroffen).Neurowissenschaftler können Neuronen selektiv zerstören, indem sie Ricin in Nerven injizieren. Retrograde axonale Transportmechanismen bringen das Toxin zu den neuronalen Zellkörpern, wo die Ribosomen lokalisiert sind.
Die Ultrastrukturanalyse zeigt, dass Ricin zuerst die Dispersion Vonpolyribosomen verursacht und dann das raue endoplasmatische Retikulum in glatte Vesikel desorganisiert. Die Zellkörper (Perikaryon) schwellen an, die Kerne degenerierenund das gesamte Neuron zerfällt.
Da Ricin ein N-Acetyl-Galactosamin-bindendes Lektin ist, kann es mitverschiedenen Lektinen verwendet werden, die unterschiedliche Spezifitäten aufweisen, um neuronale Muster der Glykosylierung abzubilden. Wenn der Suizidtransport nach der Injektion des Toxins beobachtet wird, bestätigt dies das Vorhandensein von N-Acetylgalactosaminresten auf der neuronalen Zelloberfläche. Strategien im Suizidtransport funktionieren sehr gut Instudien von erwachsenen peripheren sensorischen und motorischen Neuronen, weil sie empfindlich auf Ricin reagieren. Neuronen im Zentralnervensystem von Erwachsenen sind resistent gegen die Ablation durch Toxin, während junge sich entwickelnde Gehirne empfindlich sind, was darauf hindeutet, dass die Gehirnentwicklung Veränderungen in der Glykosylierung von ZNS-Neuronen beinhaltet. Die galaktosterminalen Reste können entweder abgeschnitten oder durch Zugabe von Sialinsäureresiduen maskiert werden.
Bei Tiertransportversuchen tritt häufig etwas Ricin aus der Nerve aus, was zu einer systemischen Vergiftung des Tieres führt. Dieses Problem kann seinvermeidet durch gleichzeitige Verabreichung eines Ricin-Antiserums.
Der Wert von suizidalen Transportstrategien wird zusammengefasst (von Wiley und Oeltmann):
- anatomische Kartierung von Neuronen
- Modellierung degenerativer Erkrankungen von Motoneuronen
- Untersuchung der Folgen peripherer Nervenschäden und Reparaturmechanismen
- Kartierung zellulärer Neurotransmitterrezeptoren
- krankheitsbezogene Anwendungen einschließlich
- Ausrottung des latenten Herpes-simplex-Virus in Trigeminus-Sensoryneuronen
- Herstellung und Analyse von gliafibrillären Bündeln
- Behandlung von pferdeneurinen Neuromenlber, J.I., und D.M. Alber. (1993) Kindersichere Zimmerpflanzen und Schnittblumen: Ein Leitfaden, um Kinder und Pflanzen sicher unter einem Dach zu halten.Story Communications Inc., Pownal, Vermont.
Cooper, M.R. und A.W. Johnson. (1994) Giftige Pflanzen und Pilze: Ein illustrierter Leitfaden. Internationales Büro für Tiergesundheit, Weybridge;London.
Czapla, T.H. und I.A. Johnston. (1990) Wirkung von Pflanzenlektinen auf die Larvenentwicklung von Maiszünsler (Lepidoptera: pyralidae) und Südmaiswurzelwurm (Coleoptera: chrysomelidae). In: J.Econ. In: Entomol, Lanham,Md.: Entomologische Gesellschaft von Amerika, 83 (6): 2480-2485.
Frankel, A.E., (1993) Immunotoxintherapie von Krebs. Onkologie (Huntington), 7 (5): 69-78; Diskussion79-80, 83-6.
Knight, B. (1979) Ricin-ein starkes mörderisches Gift. Br. Med. J.278:350-351.
Lord, J.M., Roberts, L.M. und J.D. Robertus. (1994). FASEB J. Februar;8(2): 201-8.
Matthews, R.W. und J.R. Matthews (1978). Insektenverhalten, pub. Wileyand Sons, Inc. New York, S.507.
Okoye, JOA, Enunwaonye, CA. Okorie, A.U. und F.O.I. Anugwa (1987).Pathologische Auswirkungen der Fütterung von geröstetem Rizinusmehl Ricinus communis tochicks. Avian Pathol. 16(2):283-290.
Olaifa, J.I., Matsumura,F., Zeevaart, J.A.D., Mullin, C>A> und P.Charalambous. (1991) Letale Mengen von Ricinin in grünen Pfirsichblattläusenmyzus-persicae suzler ernährte sich von Rizinuspflanzen. Pflanze Sci. (Limerick), 73 (2): 253-256.
Purushotham, N.P., Rao, M.S. und G.V. Raghavan (1986). Verwendung Vongießmehl in der Konzentratmischung von Schafen. Indischer J. Anim. Sci.56(10):1090-1093.
Robertus, JD(1988). Toxin-Struktur. Krebs behandeln. Offenbarung 37:11-24.
Robertus, JD (1991) Die Struktur und Wirkung von Ricin, einer zytotoxischen N-Glykosidase. Sem. in: Cell Biol. 2:23-30.Vitetta, E.S. und P.E. Thorpe, (1991) Immunotoxine, die Ricin oder seine Kette enthalten, Sem. in: Cell Biol. 2:47-58.
Wiley, R. G. und T. N. Oeltmann, (1991) Ricin und verwandte Pflanzentoxine: Wirkungsmechanismen und neurobiologische Anwendungen; In, Handbook ofNatural Toxins, Vol.6, hrsg. R.F.Keeler und A.T.Tu, Marcel Dekker, Inc., New York.