Dünndarm-Bürstenrandenzyme
VIVO Pathophysiologie
Dünndarm-Bürstenrandenzyme
Der letzte Schritt bei der Verdauung von Kohlenhydraten und Proteinen aus der Nahrung erfolgt auf der Oberfläche von Dünndarm-Enterozyten in unmittelbarer Nähe der Transporter, die die resultierenden Zucker und Aminosäuren in die Epithelzellen befördern. Die Enzyme, die für dieses Endstadium der Verdauung verantwortlich sind, sind nicht frei im Darmlumen, sondern als integrale Membranproteine in der Plasmamembran der Enterozyten gebunden. Die apikale Plasmamembran, in der diese Enzyme untergebracht sind, besteht aus zahlreichen Mikrovilli, die sich von der Zelle aus erstrecken und die „Bürstengrenze“ bilden. Daher werden die in diesen Mikrovilli eingebetteten Enzyme als Bürstenrandenzyme bezeichnet.
Die Dichte und Verteilung der Borstenenzyme unterscheidet sich zwischen verschiedenen Segmenten des Dünndarms und variiert oft je nach Alter des Tieres. Zusätzlich kann in einigen Fällen die Konzentration solcher Enzyme durch Diät moduliert werden; Zum Beispiel nimmt die Menge an Sucrase-Isomaltase-Enzym bei Tieren zu, die mit einer kohlenhydratreichen Diät gefüttert werden.
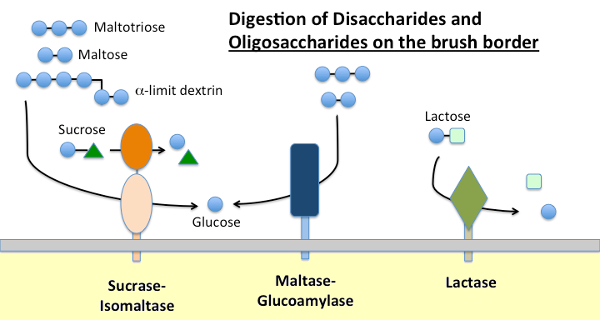
Maltase-Glucoamylase und Sucrase-Isomaltase
Nahrungsstärke wird durch α-Amylase verdaut, die in Pankreassekreten und bei vielen Arten im Speichel vorhanden ist. Amylase hydrolysiert interne α-1,4 glykosidische Bindungen in Stärke, um Maltose, kurze Oligosaccharide (z. B. Maltotriose) und sogenannte Grenzdextrine zu erzeugen, die Verzweigungspunkte in Amylopektin sind. Keines dieser Moleküle kann über das Dünndarmepithel absorbiert werden und erfordert eine weitere Hydrolyse, letztendlich in Glukose.
Maltase-Glucoamylase und Sucrase-Isomaltase sind eng verwandte Enzyme, die in die Bürstenrandmembran eingebettet sind und die Endstadien der Verdauung unter Verwendung von Substraten ausführen, die durch die Wirkung von Amylase bereitgestellt werden:
- Maltase-Glycoamylase hat zwei aktive Stellen. Die Maltasestelle hydrolysiert terminale α-1,4-verknüpfte D-Glucosereste aus Maltose oder Maltotriose und erzeugt α-D-Glucose. Die Glucoamylase-Stelle weist auch diese α-1,4-Hydrolaseaktivität auf, hydrolysiert jedoch auch α-1,6-glykosidische Verknüpfungen, wenn sie an eine α-1,4-Verknüpfung angrenzen, wodurch β-D-Glucose freigesetzt wird.
- Sucrase-Isomaltase hat auch zwei aktive Stellen mit unterschiedlichen Spezifitäten. Die Sucrase-Stelle katalysiert die Hydrolyse von Sucrase zu Fructose und Glucose und ist auch in der Lage, Maltose zu hydrolysieren. Die Isomaltase-Stelle ist wichtig als Hauptmechanismus für die Verdauung der α-1,6-Verknüpfungen der Grenzdextrine.
Lactase
Lactase ist, wie der Name schon sagt, eine Disaccharidase, die Lactose in Galactose und Glucose hydrolysiert; formal ist es eine β-Glycosidase. Laktose ist das Hauptkohlenhydrat in der Milch und Laktase ist reichlich in der Dünndarmbürstengrenze junger Säugetiere vorhanden. Bei den meisten Arten, einschließlich des Menschen, sinkt die Expression der Laktase kurz nach dem Absetzen. Bei der Mehrzahl der Menschen ist diese Nichtpersistenz der Laktaseaktivität im Erwachsenenalter mit einer „Laktoseintoleranz“ verbunden. Der Unterschied zwischen Laktase-Persistenz und Nicht-Persistenz ist genetisch bedingt.
Peptidasen
Es gibt eine große anzahl von pinsel grenze peptidasen, die kollektiv können hydrolysieren die vielfältigen aminosäure sequenz vielfalt vorhanden in diätetische proteine. Hauptklassen von Peptidasen umfassen:
- Exopeptidasen, die terminale Aminosäuren aus Peptiden hydrolysieren. Einige dieser Enzyme haben Aktivität gegen C-terminale Reste und andere arbeiten an N-terminalen Aminosäuren. Ihre Aktivität liefert freie Aminosäuren oder Dipeptide. Als Beispiel für Enzymspezifität und -vielfalt hydrolysiert Aminopeptidase P N-terminale Aminosäuren aus Di-, Tri- und Oligopeptiden, jedoch nur, wenn sie an Prolin gebunden sind, während Aminopeptidase A die Hydrolyse von terminalen sauren Aminosäuren wie Glutamat und Aspartat katalysiert.
- Endopeptidasen spalten Peptidketten intern und ergeben kleinere Peptide unterschiedlicher Kettenlänge.
- Eine einzelne Dipeptidase existiert auch als Brush-Border-Enzym.
Enteropeptidase, auch bekannt als Enterokinase, ist ein weiteres Bürstengrenzenzym, das die wichtige Aktivität hat, die Aktivierung von Trypsinogen in Trypsin, eine der wichtigsten Proteasen aus der Bauchspeicheldrüse, zu katalysieren. Enteropeptidase ist am häufigsten im Zwölffingerdarm vorhanden.
Lipasen
Eine Reihe von Lipasen sind in der Bürstengrenze des Dünndarms vorhanden. Dazu gehören Phospholipase B1, neutrale Ceramidase und alkalische Sphingomyelinase.