Chemielehrer
Was ist eine kovalente Koordinatenbindung?
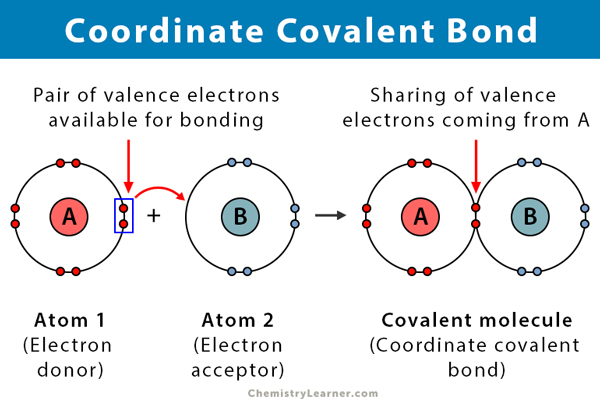
Eine kovalente Bindung entsteht, wenn zwei Atome Elektronen teilen. Eine koordinierte kovalente Bindung, auch dativkovalente Bindung genannt, ist eine Art kovalente Bindung, bei der das gemeinsame Elektronenpaar von einem der Atome stammt. Die Atome werden zusammengehalten, weil beide Kerne das Elektronenpaar anziehen. Sobald die kovalente Bindung gebildet ist, ist es unmöglich, den Ursprung der Elektronen zu unterscheiden. Diese Art der Bindung wird typischerweise bei der Bindung von Metallionen an Liganden beobachtet. An dieser Bindung können jedoch auch Nichtmetalle beteiligt sein. Die Reaktion zwischen Lewis-Säure und Base ist eine koordinierte kovalente Bindung .
Ein komplexes Ion besteht aus zwei Dingen, einem Metallion und Verbindungen, die Liganden genannt werden. Liganden sind neutrale Moleküle oder Ionen, die einsame Elektronenpaare enthalten, die sich mit dem Metallion verbinden können. Übliche Liganden sind Ammoniak (NH3), Wasser (H2O) und Halogenidionen (Cl–, Br–). Liganden gelten als Lewis-Basen, weil sie ihre Elektronenpaare mit dem Metallion teilen. Metallionen sind immer positiv und daher für einzelne Elektronenpaare sehr attraktiv.
Fakten und Eigenschaften der kovalenten Koordinatenbindung
Die kovalente Koordinatenbindung hat viele Ähnlichkeiten mit der kovalenten Bindung. Hier sind einige seiner Eigenschaften:
- Findet zwischen einem Elektronendonor und einem Elektronenakzeptor statt, typischerweise zwischen einem Metall und einem Liganden
- Findet zwischen unterschiedlichen Atomen statt
- Gebildet durch die Teilung von Elektronen, die von einem der Atome gespendet werden
- Starr und gerichtet
- Polar
- Atome folgen der Oktettregel
- Das Atom, das die Elektronen spendet, wird als Donor bezeichnet, und das Atom, das sie akzeptiert, wird als Akzeptor bezeichnet.
- Verbindungen sind in Wasser schwer löslich
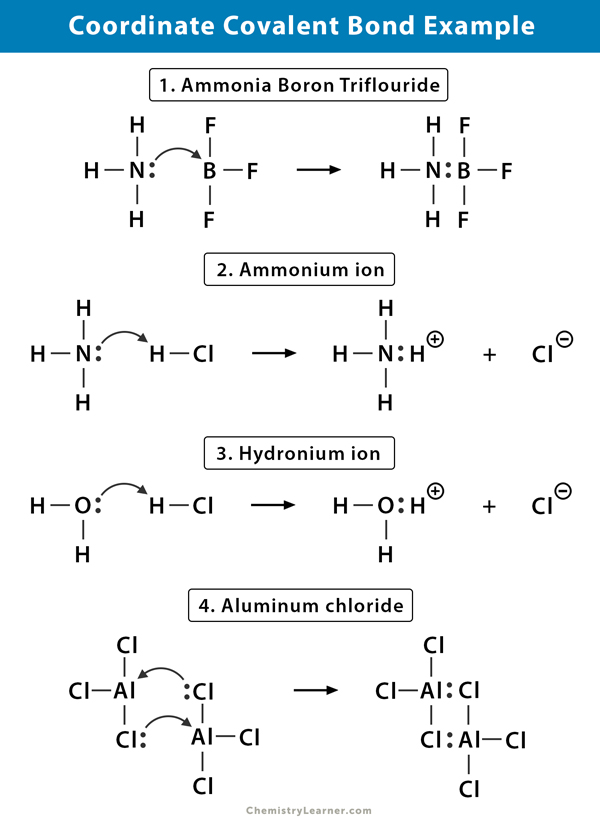
Beispiele für koordinierte kovalente Bindung
Hier sind einige Beispiele für Moleküle, bei denen eine koordinierte kovalente Bindung vorliegt .
Ammonium (NH4+) -ion
Das Ammoniumion wird aus der Reaktion von Ammoniak (NH3) -Gas mit Chlorwasserstoff (HCl) -Gas gebildet. In NH4 + wird der vierte Wasserstoff durch eine koordinierte kovalente Bindung gebunden, da nur der Wasserstoffkern vom Chlor auf den Stickstoff übertragen wird. Das Elektron des Wasserstoffs wird auf dem Chlor zurückgelassen, um ein negatives Chlorid (Cl–) -Ion zu bilden.
Ammoniak-Bortrifluorid (NH3.BF3)
Bortrifluorid (BF3) ist eine Verbindung, die keine Edelgasstruktur um das Bor (B) -Atom aufweist. Das Bor hat nur drei Elektronenpaare in seiner Volanthülle und benötigt ein Paar, um das Orbital zu vervollständigen. Daher ist BF3 Elektronenmangel. Das einsame Paar am Stickstoff (N) des Ammoniak (NH3) -Moleküls wird verwendet, um diesen Mangel zu überwinden, und eine komplexe Verbindung bildet sich durch eine koordinierte kovalente Bindung.
Hydronium ion (H3O +)
Wenn chlorwasserstoff (HCl) gas löst sich in wasser zu machen salzsäure (HCl aq.), wird im Hydroniumion eine koordinierte kovalente Bindung gebildet. Der Wasserstoff (H) -Kern wird auf das Wasser (H2O) -Molekül übertragen, das ein einzelnes Elektronenpaar aufweist, um Hydronium zu bilden. H trägt also keine Elektronen zur Bindung bei.
Aluminiumchlorid (Al2Cl6)
Die Bindung in Aluminiumchlorid (AlCl3) ist im Wesentlichen kovalent. Jedes Aluminiumatom (Al) hat ein Defizit von zwei Elektronen in seiner Volanthülle, und Chlor (Cl) hat ein einsames Paar. Al bildet eine koordinierte kovalente Bindung mit dem Cl-Atom an einer benachbarten AlCl3-Gruppe. Da jedes der beiden Al-Atome dies tut, ist Aluminiumchlorid ein kovalentes Dimermolekül mit der Formel Al2Cl6.
Kohlenmonoxid (CO)
Kohlenstoff (C) hat vier Elektronen in seiner Valenzhülle und Sauerstoff (O) hat sechs. Sowohl Kohlenstoff als auch Sauerstoff teilen sich ihre beiden Elektronen. Während die Oktettregel mit Sauerstoff zufrieden ist, gibt es immer noch ein Defizit von zwei Elektronen am Kohlenstoff. Sauerstoff teilt also seine beiden Elektronen mit Kohlenstoff, um zusätzlich zu den beiden regulären (Doppel-) kovalenten Bindungen eine koordinierte kovalente Bindung zu bilden.