Basizität von Aminen und pKaH
Quantifizierung der Basizität von Aminen unter Verwendung von „Der pKa der konjugierten Säure“, auch bekannt als „pKaH“
Wie misst man die Basizität eines Amins? Ein typisches Beispiel: Was ist eine stärkere Base: Pyridin oder Piperidin?
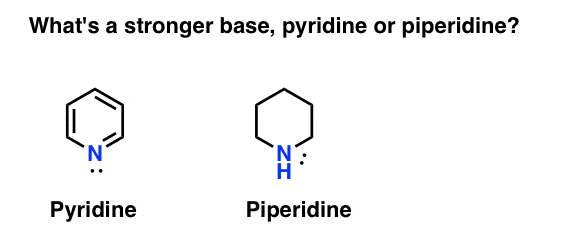
Wenn Sie Piperidin gesagt haben, herzlichen Glückwunsch – es ist in der Tat eine stärkere Base.
Aber warum? Und wie viel stärker? Wie versucht man, diese Fragen zu beantworten? Schließlich können wir die Stärke von Säuren leicht vergleichen, indem wir ihre PKAS untersuchen. Sollten wir nicht in der Lage sein, dasselbe mit Basen zu tun?
Ja, in gewisser Weise. Hier sind zwei wichtige Punkte für heute:
- Der beste Weg, die Basizität eines Amins zu quantifizieren, besteht darin, die pKa seiner konjugierten Säure zu untersuchen.
- Je höher die pKa der konjugierten Säure ist, desto stärker ist die Base.
In diesem Beitrag zeigen wir einige spezifische Beispiele, wie man pKa-Werte verwendet, um die Basizität von Aminen zu vergleichen.
In einem nachfolgenden Beitrag werden wir dann einige Schlüsseltrends untersuchen, die der Basizität von Aminen zugrunde liegen.
Inhaltsverzeichnis
- Kurzübersicht: Säuren, Basen, konjugierte Säuren und konjugierte Basen
- Verwendung von pKa zur Messung des Säuregehalts
- Verwendung von pKa zur Quantifizierung der Basizität von Aminen
- Die „pKa der konjugierten Säure“ kann als „pKaH“ abgekürzt werden
- Verwendung von pKaH zur Bestimmung der relativen Basizität von Aminen
- Einige Worte der Vorsicht pKa-Werte für Amine
- Welche Schlüsselfaktoren bestimmen die Basizität von Aminen?
- Anmerkungen
1. Schnelle Überprüfung: Säuren, Basen, konjugierte Säuren und konjugierte Basen
Lassen Sie uns zunächst einige Grundlagen der Basizität kurz überprüfen.
Es gibt vier Akteure in jeder Säure-Base-Reaktion.
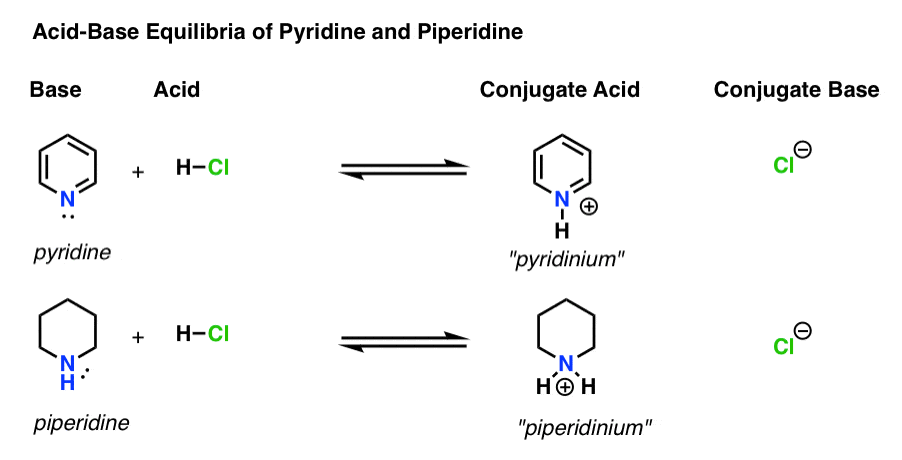
- Die Base ist die Spezies, die ein einzelnes Paar an H+ spendet (auch bekannt als „Proton“ oder „Wasserstoffkern“). Hier bildet sich die neue Bindung zu H (z. B. Pyridin, unten)
- Die konjugierte Säure ist die Spezies, die entsteht, nachdem die Base eine Bindung zu H gebildet hat (z. B. „Pyridinium“, das eine neue N–H-Bindung aufweist)
- Die Säure ist die Spezies, die H + verliert . Hier bricht die Bindung zu H (z. H-Cl)
- Die konjugierte Base ist die Spezies, die verbleibt, nachdem die Säure H+ an die Base abgegeben hat (z. B. Cl-)
Hier sind Pyridin und Piperidin in Aktion. Indem Sie den Bindungen folgen, die sich bilden und brechen, können Sie jeden Akteur identifizieren.
2. Verwendung von pKa zur Messung des Säuregehalts
Jede Säure-Base-Reaktion kann als Gleichgewicht zwischen einer Vorwärts- und einer Rückwärtsreaktion geschrieben werden. Wir haben gesehen, dass die Säurekonstante Ka ein Maß dafür ist, wie leicht eine Spezies dissoziiert, um H + und die konjugierte Base zu ergeben.
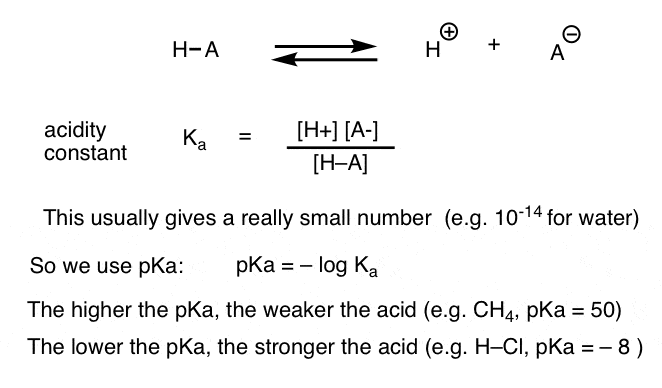
Der Einfachheit halber verwenden wir den negativen Logarithmus von Ka, genannt pKa, der der bekannten pH-Skala ähnelt, aber über 14 hinausgehen kann, da er nicht streng auf wässriges Lösungsmittel beschränkt ist. pKa-Werte reichen von -10 oder so für sehr starke Säuren (z. B. Jodwasserstoffsäure, H–I) bis 50 und höher für bestimmte Kohlenwasserstoffe (z. B. Ethan).
Wie können wir diese Konzepte anwenden, um die Basizität zu messen? Könnten wir nicht die Dinge umstellen und einen Begriff definieren, Kb, der das Gleichgewicht dafür ist, wie leicht sich eine Spezies mit H + verbindet , PKB als negatives logarithmisches Element definieren und Basen vergleichen, indem wir ihre pKb-Werte betrachten?
Ja …. wir könnten. Ich schätze. Wenn wir müssten. Aber im Allgemeinen ist die Meinung der organischen Chemiker zu diesem Thema „Schraube pKb“.
Immerhin wurden pKa-Werte für Tausende von organischen Molekülen gemessen. Möchte sich wirklich jemand auch an eine Vielzahl von pKb-Werten erinnern müssen? Hölle nein!
Stattdessen können wir leicht pKa-Werte als indirekte Messung der Basizität verwenden. Hier ist, wie.
3. Verwenden von pKa-Werten zur Quantifizierung der Basizität von Aminen
Erinnern Sie sich an diese beiden unsterblichen Prosazeilen, die es wert sind, sich jede Nacht zu rezitieren:
- Je stärker die Säure, desto schwächer die konjugierte Base.
- Je schwächer die Säure, desto stärker die konjugierte Base.
Die pKa für die konjugierte Säure von Pyridin („Pyridinium“) wurde gemessen. Es geht um 5.2 .
Wir haben auch einen Wert für die pKa für die konjugierte Säure von Piperidin. Es geht um 11 .
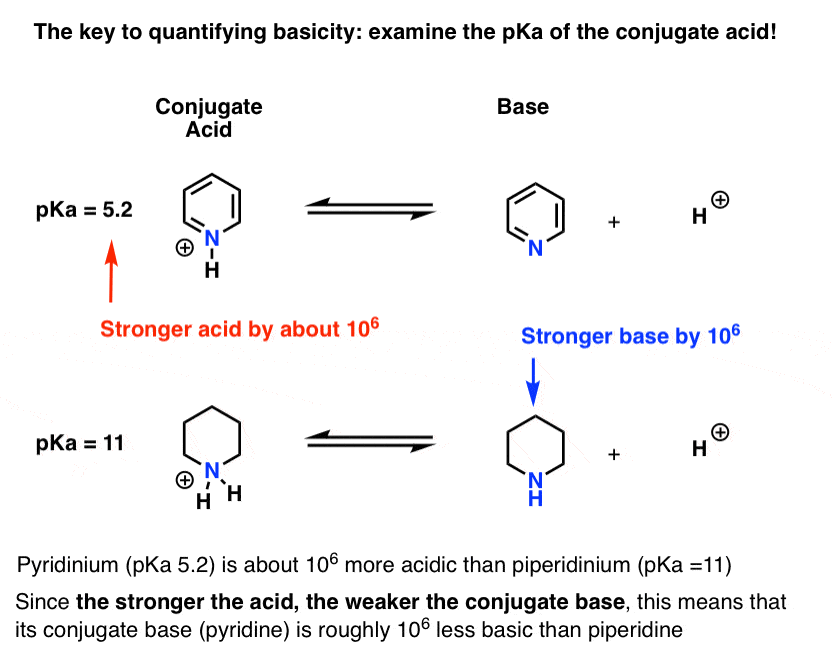
Aus diesen pKa-Werten können wir erkennen, dass die konjugierte Säure von Pyridin um etwa 6 pKa-Einheiten stärker ist als die konjugierte Säure von Piperidin. Da jede pKa-Einheit einen Faktor von 10 darstellt, ist das ein Faktor von etwa 1 Million.
Da „je stärker die Säure ist, desto schwächer ist die konjugierte Base“, ist Pyridin daher um den Faktor 1 Million eine schwächere Base als Piperidin.
4. „Die pKa der konjugierten Säure“ kann als „pKaH“ abgekürzt werden
Der Begriff „pKa der konjugierten Säure“ ist ein bisschen wie ein Schluck, um regelmäßig zu verwenden. Da wir von Natur aus faul sind, möchten wir dies für den allgemeinen Gebrauch etwas zusammenfassen.
Da die konjugierte Säure einer Base („B“) „BH“ ist, können wir „die pKa der konjugierten Säure einer Base“ als pKaH abkürzen.
Dies lässt uns sagen, dass die pKaH von Pyridin 5,2 und die pKaH von Piperidin 11 beträgt.
Wir können dann in die Literatur graben, um andere Basen zu finden, mit denen wir sie vergleichen können.
Wie basisch ist beispielsweise Ammoniak (NH3) ? Die konjugierte Säure von Ammoniak, NH4 (+), ist 9,2 . Äquivalent können wir sagen, dass die pKaH von Ammoniak 9,2 beträgt. Damit liegt es auf der Basizitätsskala zwischen Pyridin und Piperidin.
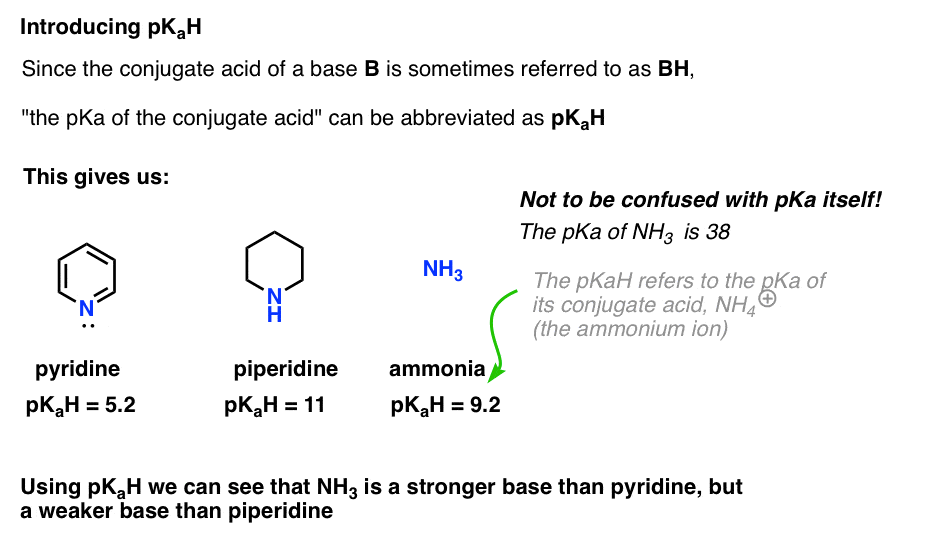
Beachten Sie, dass es sehr wichtig ist, pKaH nicht mit pKa zu verwechseln. Die pKaH von Ammoniak beträgt 9,2, was den Säuregehalt seiner konjugierten Säure NH4 (+) misst.
Die pKa von Ammoniak selbst beträgt 38, was die Gleichgewichtskonstante für die Dissoziation von NH3 zu seiner konjugierten Base NH2(-) und H + misst.
Das bedeutet, dass 38 die pKaH des Amidions NH2(–) ist, das Sie vielleicht schon einmal als starke Base (NaNH2) zur Deprotonierung terminaler Alkine (pKa = 25) angetroffen haben. Mit pKaH können wir feststellen, dass NH2(-) ungefähr (38 – 9) = 29 Größenordnungen grundlegender ist als NH3 !
5. Die Verwendung von pKaH zur Bestimmung der relativen Basizitäten von Aminen
Die Verwendung von pKaH zur Bestimmung der relativen Stärken von Basen ist ein ziemlich nützlicher Trick.
Hier sind einige repräsentative Beispiele für stickstoffhaltige Moleküle. Unten ist die pKa ihrer konjugierten Säuren.
Was ist die stärkste Basis hier? Was ist das schwächste?
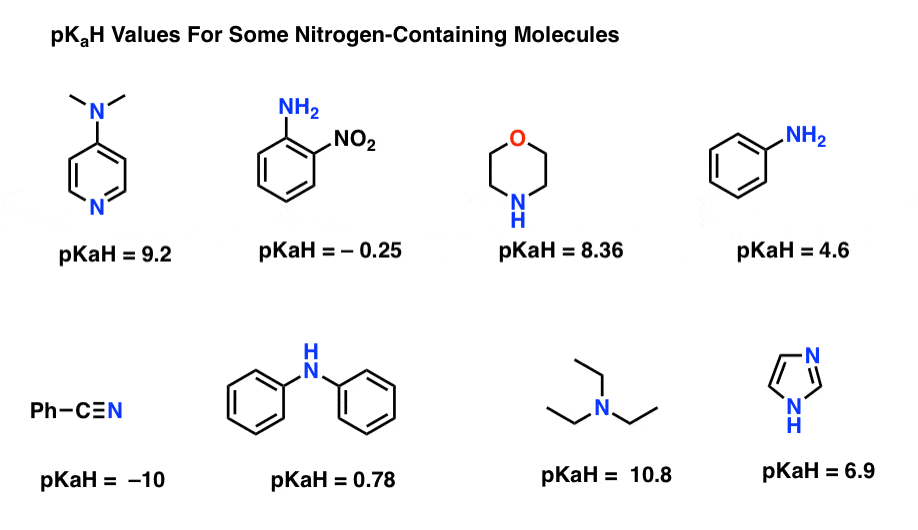
Der niedrigste pKaH-Wert liegt hier bei -10 für das Nitril (unten links). Dies bedeutet, dass das Nitril das am wenigsten basische aller dieser Moleküle ist.
Der höchste pKaH-Wert liegt hier bei 10,8 für Triethylamin. Das macht Triethylamin zur stärksten Base unter allen aufgeführten.
Einige Worte der Vorsicht zu pKa-Werten für Amine
Zwei Dinge, auf die Sie achten sollten, insbesondere wenn Sie andere Online-Quellen zu diesem Thema lesen.
Erstens werden die pKaH-Werte für Amine manchmal ohne Erklärung als pKa-Werte angegeben. Die besten pKa-Tische tun dies nicht, aber es ist schwierig, die Spreu vom Weizen zu trennen, wenn Sie gerade erst anfangen.
Wenn Sie einen anomal niedrigen pKa-Wert für ein Amin sehen, bezieht sich dies wahrscheinlich auf die pKaH der konjugierten Säure.
Hier ist zum Beispiel eine pKa-Tabelle, in der die pKa von Methylamin (CH3NH2) als 10,63 aufgeführt ist.
Das ist niedrig. Hoffentlich sollte Ihnen zu diesem Zeitpunkt ein solcher Wert von 10 für eine pKa eines Amins seltsam vorkommen, zumal die pKa des eng verwandten NH3 38 beträgt.
Der Wert von 10,63 bezieht sich tatsächlich auf die pKa der konjugierten Säure von Methylamin, NICHT auf Methylamin selbst. Es ist ein pKaH-Wert.In ähnlicher Weise listet die gleiche Tabelle Trimethylamin mit einem pKa von 9,8 auf . Auch dies ist eigentlich seine pKaH. Ich kann keinen tatsächlichen pKa-Wert für Trimethylamin finden, aber ich würde vermuten, dass es >40 ist, da die konjugierte Base von Trimethylamin das Carbanion (CH3)2N–CH2(–)) ist.Eine zweite, weniger häufige Quelle der Verwirrung ist, dass manchmal die pKaH eines Amins als seine pKb angegeben wird, wie in dieser Tabelle, die die pKb von NH3 als 9,2 angibt . Dies ist ungenau.
Auch hier kommen pKb-Werte in der organischen Chemie im Grundstudium nicht wirklich vor, obwohl mir gesagt wird, dass sie manchmal auf dem DAT / MCAT erscheinen.
7. Welche Schlüsselfaktoren bestimmen die Basizität von Aminen?
Nun, da wir zumindest gelernt haben, die pKa-Werte von Aminen und ihren konjugierten Säuren zu quantifizieren und zu interpretieren, können wir beginnen, die Schlüsselfrage zu stellen: Warum? Welche Schlüsselfaktoren bestimmen die Basizität von Aminen? Was sind die wichtigsten Trends?
Warum ist Pyridin zum Beispiel eine schwächere Base als Piperidin? Warum sind Nitrile noch schwächere Basen? Warum neigen elektronenziehende Gruppen dazu, Amine zu schwächeren Basen zu machen?
Die gute Nachricht ist, wenn Sie die Faktoren, die den Säuregehalt bestimmen, bereits verstehen, müssen Sie einfach genau die gleichen Prinzipien anwenden – aber umgekehrt!
Wir werden das im nächsten Beitrag behandeln. Fünf Faktoren, die die Basizität von Aminen beeinflussen
Anmerkungen
Fußnote 1. Es gibt viele Säuren, die Nicht-Basen sind (wie NH4, dem ein einsames Paar fehlt) und viele Basen, die Nicht-Säuren sind, wie Cl (–), das nicht in der Lage ist, ein einsames Paar zu akzeptieren. Daher ist es falsch zu sagen „Je stärker die Säure, desto schwächer die Base“.
Fußnote 2. Das ist die Messung mit Wasser als Lösungsmittel erhalten. Möglicherweise sehen Sie einen anderen Wert, 3,4, der erhalten wird, wenn Dimethylsulfoxid (DMSO) als Lösungsmittel verwendet wird. Siehe Bordwell pKa-Tabellen (DMSO)