Aktuelle Artikel
Abstract
Hintergrund: Eine pulmonale Endometriose ist eine der relativ seltenen Formen der extragenitalen Endometriose und wird entsprechend ihrer klinisch-pathologischen Symptomatik im Sinne des „thorakalen Endometriose-Syndroms“ betrachtet, d.h. wenn sich funktionierendes Endometrium in der Pleura, im Zwerchfell, in den Viae respiratoriae oder im Lungenparenchym selbst befindet.
Ziele: 42 Fälle dieser Krankheit wurden beobachtet. Das Alter der Patienten lag zwischen 16 und 61 Jahren, so dass der Durchschnitt 40,5 ± 0,4 Jahre betrug.
Ergebnisse: In den meisten Fällen betraf die Endometriose das Zwerchfell und wurde von einem Pneumothorax mit dem entsprechenden Symptomkomplex begleitet, während Lungenherde seltener auftraten, asymptomatisch waren oder eine chirurgische und andere Pathologie vortäuschten. Die Operation und die histologische Untersuchung waren entscheidend für die Überprüfung der Diagnose. Progesteron- und Östrogenrezeptoren sowie die Ki-67-Produktion wurden immunhistochemisch im endometrioiden Gewebe der Lungenherde nachgewiesen.
Fazit: Die Anwendung der umfassenden histologischen und immunhistochemischen Methoden war erforderlich, um die endgültige Diagnose der Lungenendometriose zuverlässiger zu machen. Es hat eine große praktische Bedeutung als eine der wichtigsten Voraussetzungen für die Verschreibung einer angemessenen Behandlung.
Schlüsselwörter
Thorakales Endometriose-Syndrom, extragenitale Endometriose, pulmonale Endometriose, Zwerchfellläsion, Pneumothorax, histologische Überprüfung der Diagnose
Einführung
Endometriose ist ein Wachstum des Gewebes ähnlich dem Endometrium außerhalb der Gebärmutterhöhle, das von einer chronischen Entzündungsreaktion begleitet wird, die in den meisten Fällen zur Entwicklung eines Schmerzsyndroms und /oder Unfruchtbarkeit führt. Derzeit ist es eine der häufigsten gynäkologischen Erkrankungen. Diese Pathologie tritt bei 2-10% der Frauen im gebärfähigen Alter und fast bei 50% der Frauen mit Unfruchtbarkeit auf .
Eine der relativ seltenen Formen der Endometriose ist durch die Entwicklung des Endometriumgewebes außerhalb des Fortpflanzungssystems gekennzeichnet. Extragenitale Herde können sowohl als separate Formationen als auch als Bestandteile der Begleitläsionen unabhängig voneinander existieren . Die Fälle der extragenitalen Endometriose machen 6-8% der Gesamtzahl der beobachteten Endometriose aus. Unter den Organen, die nichts mit dem Fortpflanzungssystem zu tun haben, sind der Darm, die Harnwege und die Lunge am häufigsten betroffen .Hart war der erste, der 1912 posthum die Lungenendometriose (PE) diagnostizierte. Er beobachtete bei einer Frau im Alter von 72 Jahren zahlreiche subpleurale Knoten, die von der Größe einer Erbse bis zur Größe einer Walnuss variierten. Die histologische Untersuchung ergab eine Adenomyose uterinen Ursprungs; Ein Tumor in der Gebärmutter der Patientin wurde 22 Jahre zuvor entfernt .
In den letzten zehn Jahren hat die Zahl der Publikationen zur Endometriose deutlich zugenommen. Das Konzept des „Thoracic endometriosis syndrome“ (TES) wurde entwickelt und angewendet, wenn sich das funktionierende Endometrium in der Pleura, im Zwerchfell, in den Viae respiratoriae oder im Lungenparenchym selbst befindet .Channabasavaiah und Joseph haben Ergebnisse einer Analyse von 110 klinischen Fällen der histologisch verifizierten intrathorakalen Endometriose vorgestellt, die zwischen 2001 und 2007 veröffentlicht wurden. Legras et al. haben retrospektiv 229 Fälle des Pneumothorax bei Frauen untersucht, die in der englischsprachigen Fachliteratur von 2000 bis 2011 beschrieben sind und geben an, dass der TES in 54 Fällen diagnostiziert wurde (24 Prozent).
Die Frage, wie ein funktionierendes Endometrium in die Brust gelangt, ist noch offen . Sampson war der erste, der vorschlug, dass das Endometrium durch die Eileiter durch die sogenannte „retrograde Menstruation“, dh die Abgabe einer gewissen Menge Blut in die Beckenhöhle während der Menstruation, von der Gebärmutterhöhle in die Bauchhöhle übertragen wird. Diese Art von Reflux tritt bei einer großen Anzahl gesunder Frauen auf . Sampson vermutete auch eine Existenz der metastasierten oder embolischen Endometriose, die es erlaubt, über hämatogene Wege der Endometriose-Ausbreitung zu spekulieren. Hobbs und Bortnick bestätigten diese Hypothese, indem sie die Endometriumsuspension experimentell in die Ohrvenen von Kaninchen einführten, was in 79 Prozent der Fälle zur Entwicklung der PE führte.
Das TES manifestiert sich am häufigsten im rezidivierenden Pneumothorax, Hämoptyse, Husten oder Brustschmerzen und seltener im mit der Menstruation verbundenen Hämothorax . Die PE ist eine der seltensten Formen der TES. Die wichtigsten klinischen Manifestationen der ersteren sind Husten, Hämoptyse und ein Schweregefühl in der Brust (ein „schwerer Pelzmantel“ -Symptom), die während der Menstruation auftreten, aber nicht unbedingt in jedem Menstruationszyklus.Laut der Literatur wird Pneumothorax im Zusammenhang mit dem TES bei etwa 10-24 Prozent der Frauen mit einem spontanen Pneumothorax gefunden .
Röntgenuntersuchung der Brust (hauptsächlich HRCT) zeigt vier Varianten der Pathologie: lineare oder retikuläre Trübungen, kleine Knötchen, zystische Lufträume, verdickte Alveolarsepten. Diese radiologischen Befunde, insbesondere solche in Kombination mit einer Hämoptyse und Brustschmerzen, werden häufig als Hinweis auf eine tuberkulöse oder neoplastische Natur der Lungenläsion angesehen.
Eine Zwerchfellläsion wird normalerweise zufällig während eines chirurgischen Eingriffs aufgrund eines Pneumothorax festgestellt. Vor der Operation wird diese Pathologie aufgrund des begrenzten Ausmaßes der Läsionen und der geringen Auflösung radiologischer Methoden sehr selten erkannt.
Fast ausnahmslos befällt die Krankheit ein sehnenartiges Zentrum der rechten Zwerchfellkuppel und kann in zwei Arten auftreten. Die erste hat die Form von blauen oder violetten endometriösen Implantaten unter der parietalen Pleura von bis zu 5 mm Größe. Die zweiten sind runde oder schlitzartige Defekte in der Membran.
Das Fehlen spezifischer Symptome, Labormarker und charakteristischer radiologischer Muster erschwert die präoperative Diagnose von PE. Es wird oft erst nach einer Bestätigung durch die histologischen Methoden diagnostiziert, darunter die Immunhistochemie, einschließlich der Expression von Östrogen- und Progesteronrezeptoren .
Daher ist der chirurgische Eingriff oft zu diagnostischen und therapeutischen Zwecken notwendig. Obwohl die Operation die Diagnose in der Regel überprüft und alle heterotopen Endometriumläsionen entfernt, bleibt diese Art der Behandlung ohne eine suppressive Hormontherapie unvollständig. Es zielt auf eine Ovulationsblockierung, eine Unterdrückung der Östrogensekretion und eine epitheliale Wachstumsunterdrückung im endometriösen Fokus ab .
Eine relativ geringe Anzahl der in der Weltfachliteratur beschriebenen TES-Fälle und das Fehlen eines pathognomonischen Krankheitsbildes veranlassten uns, unsere eigenen Erfahrungen in der Diagnostik und Behandlung dieser Krankheit zusammenzufassen.
Methoden
Wir haben 42 Fälle des TES analysiert, die in unseren Krankenhäusern im Zeitraum von 2004 bis 2016 beobachtet wurden. Das Alter der Patienten lag zwischen 16 und 61 Jahren, so dass der Durchschnitt 40,5 ± 0,4 Jahre betrug.
35 Patienten wurden aufgrund eines spontanen Pneumothorax ins Krankenhaus eingeliefert, 3 mit abgerundeten Tumormassen, 1 mit einer Zyste und 3 mit einer Infiltration im Lungengewebe. Signifikant war bei 41 Patienten der pathologische Prozess in der rechten Lunge lokalisiert.
Ergebnisse
Die Hauptbeschwerden aller hospitalisierten Patienten sind in Tabelle 1 aufgeführt.
Tabelle 1. Complaints of patients with the thoracic endometriosis syndrome
|
Complaints |
Patients (n=42) |
|
|
abs. number |
per cent |
|
|
Chest pain |
85,7 |
|
|
Dyspnea |
73,8 |
|
|
Dry cough |
50,0 |
|
|
Infertility |
14,3 |
|
|
Hämoptyse |
9,5 |
|
In den meisten Fällen traten Brustschmerzen auf (85,7 Prozent); Hämoptysen wurden seltener gefunden (9,5 Prozent). Dyspnoe wurde nur bei 31 Patienten mit Pneumothorax festgestellt; 6 Frauen litten an Unfruchtbarkeit. In der Anamnese hatten 5 Patienten ein Uterusmyom und bei 2 Patienten eine Endometriumzyste des Eierstocks.
Bei der HRCT der Brust wurden abgerundete Schatten in der Lunge (3 Fälle), Infiltrate mit dünnwandigen Hohlräumen (6 Fälle), Lungenzysten (1 Fall), Blasen mit unterschiedlichem Durchmesser (6 Fälle) und eine Masse in der paravertebralen Region festgestellt als Neurinom betrachtet (1 Fall) (Abbildung 1). Gleichzeitig wurden in 26 von 42 Fällen (61,9 Prozent der Patienten) keine Veränderungen im Lungengewebe festgestellt.
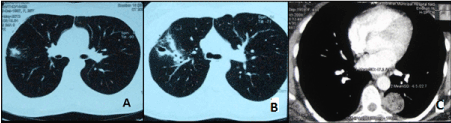
Abbildung. 1. HRCT-Brustscans von Patienten mit Lungenendometriose A – Infiltration des Lungengewebes; B –kleine Hohlräume; C – periphere Knötchen.
Leider erlaubt uns eine präoperative Untersuchung nicht, das TES in jedem Fall vorzuschlagen, da der CA-125-Ausdruck auch nicht auf die Möglichkeit hinweist. Gleichzeitig deutete eine retrospektive Analyse der postoperativen Daten darauf hin, dass eine wesentliche Voraussetzung für diese Diagnose bestand.
Präoperative Diagnosen waren die folgenden: primärer Spontanpneumothorax in 35 Fällen, infiltrative Lungentuberkulose in 3 Fällen, Lungenhämosiderose, Neurinom des Mediastinums, Lungentumor und Lungenzyste – jeweils in einem.
Der chirurgische Eingriff wurde bei 37 von 42 Patienten durchgeführt. Von diesen 35 Frauen mit Pneumothorax wurden 30 (85,7 Prozent) operiert. Eine atypische Lungenresektion wurde in 27 Fällen (90 Prozent der Patienten), eine Rippenfellpleurektomie in 28 Fällen (93,3 Prozent) und die Resektion des Zwerchfellsehnenzentrums in 25 Fällen (83,3 Prozent) durchgeführt.
Von 7 Patienten ohne Pneumothorax wurden 6 der atypischen Lungenresektion und 1 der Lobektomie unterzogen.
In allen Fällen wurde eine histologische Untersuchung des Operationsmaterials durchgeführt. Paraffinschnitte wurden mit Haematoxylin und Eosin, Alcian Blue und Picrofuchsin von van Gieson gefärbt. Die Immunhistochemie wurde unter Verwendung von Antikörpern gegen Progesteron- und Östrogenrezeptoren sowie monoklonalen Mausantikörpern gegen Ki-67 und bcl 2 (Dako, Dänemark) durchgeführt.
In korrelierenden klinischen und histologischen Daten wurde das TES in allen Fällen diagnostiziert und kann in folgende Kategorien unterteilt werden: Perforation der rechten Zwerchfellkuppel mit histologisch identifizierten Endometriumimplantaten (6 Patienten); intrapulmonale Endometriumheterotopien in Form von Knoten, Infiltraten und Zysten (11 Patienten); multifokale Lungen- und Zwerchfellläsionen (1 Patient). In 24 Fällen wurde eine Perforation der rechten Zwerchfellkuppel ohne histologisch identifiziertes Endometrium („poröses Zwerchfell“) beobachtet.
Die makroskopische Beurteilung der entfernten Lunge ergab Zysten mit dunkelbraunem Material (6 Fälle). Die Wände der Zysten waren dick, ihre innere Oberfläche glatt (5 Fälle) oder mit papillären Auswüchsen (1 Fall). 5 verbleibende Beobachtungen zeigten kleine Blutungsherde in den subpleuralen Bereichen.
Die mikroskopische Untersuchung ergab zahlreiche Cluster von Endometriumdrüsen mit einem zytogenen Stroma. Die Struktur dieser Drüsen entsprach verschiedenen Phasen des Menstruationszyklus 9 (nämlich. b. Proliferations- oder Sekretionsstadium) in unterschiedlichen Mengen vorliegen. Der endometriale Epitheltyp der Drüsen war gewöhnlich pseudostratifiziert, abgeflacht oder säulenförmig; Zellkerne befanden sich auf den verschiedenen Ebenen; das Zytoplasma enthielt geheime Tropfen; Hier und da wurden einige Anzeichen einer Epithelabschuppung festgestellt. In der Alveolarluina und dem Lungeninterstitium wurden häufig Hämosiderinablagerungen gefunden. Das Drüsenstroma wurde durch längliche Zellen mit spindelförmigen Kernen dargestellt, an einigen Stellen mit Dezidualisierungsmerkmalen (Abbildung 2). In 5 Fällen wurde eine zystische Transformation der Drüsen zusammen mit Blutungen um sie herum beobachtet. In den meisten Fällen zeigten sich einige Hämosiderinablagerungen und eine fibroblastische Transformation eines zytogenen Stromas.
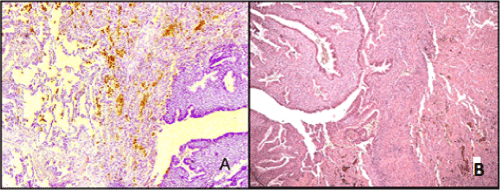
Abbildung. 2. Pulmonale Endometriose. A – Inseln der Proliferation der Endometriumdrüsen. In der Alveolarluina befinden sich Hämosiderinablagerungen. Hämatoxylin- und Eosin-Färbung (X 100); B – proliferierendes Epithel der Drüsen mit geheimen Tropfen im Zytoplasma. Stroma mit Dezidualisierungsmerkmalen. Hämatoxylin- und Eosin-Färbung (X 160).
In allen Fällen wurde die immunhistochemische Studie durchgeführt. Es zeigte die Progesteron- und Östrogenrezeptorexpression im Drüsenepithel und in zytogenen Stromazellen (Abbildung 3A, B) sowie die Expression des Onkoproteins bcl-2 im Drüsenepithel und moderate proliferative Aktivität (Ki-67) im zytogenen Stroma (Abbildung 3C).
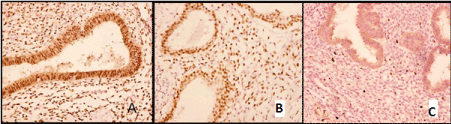
Abbildung. 3. Pulmonale Endometriose: A – Expression an Progesteronrezeptoren in Drüsenepithelzellen (X200); B – identisch mit Östrogenrezeptoren (X200); C – Ki-67-Expression im zytogenen Stroma (X100).
Unten sind zwei Beispiele aus unseren Beobachtungen.
Beispiel 1. Patient F., 52 Jahre alt. Die klinische Diagnose war ein Tumor des rechten Lungenunterlappens. Sechs Jahre zuvor wurde die Exstirpation des Uterus ohne Anhängsel aufgrund des Uterusmyoms mit Adenomyose durchgeführt; Der Patient litt an Unfruchtbarkeit. 6 jahre nach der Operation gab es Beschwerden über periodische Schmerzen in der Brust, Husten und Hämoptyse. Die Radiographie des Thorax ergab einen runden Schatten von 4 cm Durchmesser im Unterlappen der rechten Lunge. HRCT zeigte eine abgerundete Formation, 4х3х2,5 cm groß, heterogen strukturiert mit klar definierten Konturen. Die Untersuchung konnte die genaue Diagnose nicht bestätigen, daher wurde die rechte untere Lobektomie durchgeführt. Makroskopisch wurde eine Formation vom Typ „Wabe“ mit klar definierten Konturen und kleinen Hohlräumen bis zu 0,7 cm, die mit dicker brauner Flüssigkeit gefüllt waren, nachgewiesen. Zwischen den Hohlräumen befand sich ein dichtes homogenes Fasergewebe. Die histologische Untersuchung ergab zystisch transformierte endometrioide Drüsen mit einem proliferierenden Epithel an ihren Wänden sowie eine Papillenbildung und ein fibröses zytogenes Stroma sowie eine leiomyomatöse Hyperplasie um Drüsenstrukturen (Abbildung 4).
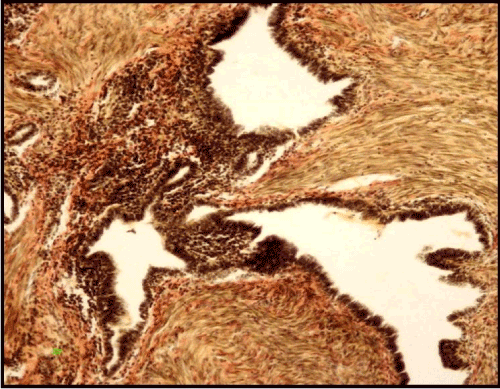
Abbildung. 4. Pulmonale Endometriose mit papillären Strukturen und leiomyomatöser Hyperplasie. Van Gieson Färbung (X 160).
Beispiel 2: Patient A., 42 Jahre alt. Klinische Diagnose war der rechtsseitige spontane Pneumothorax. Am ersten Tag des Menstruationszyklus traten Schmerzen in der rechten Brusthälfte auf. Es wurde von einem trockenen Husten und einer leichten Dyspnoe begleitet. Die Thoraxradiographie ergab einen rechtsseitigen Pneumothorax mit einer 50-prozentigen Atelektase und einer Verschiebung des Mediastinums nach links. Bei der Aufnahme in das Krankenhaus wurde eine rechtsseitige diagnostische Thorakoskopie mit einer Drainage der Pleurahöhle durchgeführt. Das Sehnenzentrum des Zwerchfells zeigte Perforationen und Endometriumimplantate (Abbildung 5). HRCT der Brust zeigte keine Veränderungen im Lungengewebe. Die rechtsseitige Videothorakoskopie, die Resektion des Zwerchfellsehnenzentrums und die subtotale Rippenfleurektomie wurden durchgeführt. Makroskopisch wurden einige Perforationen im Sehnenzentrum und bräunliche Knötchen mit gut definierten Konturen bis zu 0,5 cm festgestellt. Sie befanden sich auf der Oberfläche des Pleuramembrans, ohne es zu durchdringen. Die histologische Untersuchung zeigte einige zystische Endometriose-Läsionen auf dem fibrösen Hintergrund.
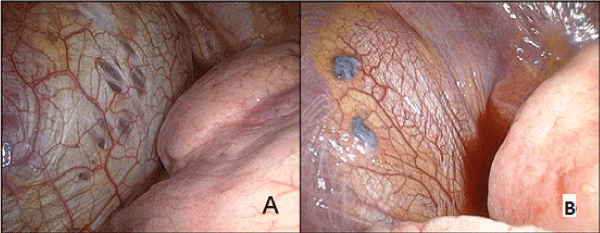
Abbildung. 5. Membranläsionen in Betrieb aufgedeckt. A – Perforationen im Zwerchfellsehnenzentrum; B – endometrioide Implantate.
In diesem Fall sowie in allen anderen Fällen fielen der Beginn und das Verschwinden klinischer und radiologischer Symptome mit dem Beginn und dem Ende des Menstruationszyklus zusammen. Trotzdem entging diese Tatsache den Physikern.
Diskussion
Als klarer Beweis für die Worte des bekannten russischen Oncomorphologen Golovin bestätigt die extragenitale Endometriose, dass jedes Gewebe eine historisch gebildete stabile Einheit ist, die bestimmte Eigenschaften und morphogenetische Potenzen besitzt, die auch bei abnormalen Wechselbeziehungen zwischen einem Organismus und einem Tumor nicht vollständig verschwinden. Dieser Ansatz ist äußerst wichtig für das Verständnis der PE als pathologischer Prozess toto coelo.
Bei den meisten unserer Beobachtungen betraf die Endometriose das Zwerchfell und wurde vom Pneumothorax mit einem entsprechenden Symptomkomplex begleitet, während die pulmonale Heterotopie seltener asymptomatisch auftrat oder bestimmte chirurgische und andere Pathologien vortäuschte.
Es ist erwähnenswert, dass die Läsion der linken Brusthälfte nur in einem Fall diagnostiziert wurde (nämlich. implantate in der linken Kuppel des Zwerchfells und der linken Lunge), was die Tatsache bestätigt, dass TES die rechtsseitige Pathologie ist. Wir schlagen vor, dass der Grund für diese Selektivität die Tatsache ist, dass die rechte Kuppel des Zwerchfells zusammen mit der Leber, obwohl nicht starr gebunden, während der Atmung wie ein Kolben wirkt, der eine „Saugeffekt“. Angeblich ist dies auch der Grund, warum es genau der Raum unter der rechten Zwerchfellkuppel ist, in den bestimmte Mengen des Menstruationsblutes aus dem Becken gelangen können. Die Blutresorption erfolgt unter aktiver Beteiligung des lymphatischen Apparates des Peritoneums . Endometriumfragmente erreichen den subpleuralen Raum durch die das Zwerchfell perforierenden Lymphgefäße und bleiben dort in den meisten Fällen fixiert. Die anschließende Nekrose und Lyse des Endometriums kann zu den Perforationsdefekten führen. Hypothetisch ist es möglich, dass in seltenen Fällen kleine Endometriumfragmente die obere Hohlvene durch die Lymphgefäße des Mediastinums erreichen und dann in das Lungenparenchym eindringen, das Knoten oder Zysten bildet.
Die klinische und morphologische Hypodiagnostik des TES ist nicht nur durch seine Seltenheit bedingt, sondern auch durch das Fehlen der umfassenden komplexen Analyse und Korrelation der anamnestischen, klinischen und histologischen Daten.
Angesichts der zunehmenden Inzidenz der Endometriose, unter anderem der pulmonalen, erscheint es unerlässlich, diese Krankheit in den differentialdiagnostischen Bereich einzubeziehen, insbesondere wenn es sich um Frauen im gebärfähigen Alter mit der unklaren rechtsseitigen Lungenpathologie und einer kompromittierten gynäkologischen Vorgeschichte handelt. In solchen Fällen ist es ratsam, Gynäkologen zu rekrutieren, um die Adenomyose und die Beckenendometriose auszuschließen. Im Falle der obskuren rezidivierenden Lungenerkrankungen ist es zwingend notwendig, die MRT der kleinen Beckenorgane durchzuführen.
Unsere Daten erlauben es, einige wichtige und zuverlässige Merkmale des TES wie folgt zu bestimmen: die überwiegend rechtsseitige Lokalisation der Erkrankung, das relativ junge Alter der Patientinnen, das zyklische Wiederauftreten der Hämoptyse und Beschwerden oder Schmerzen in der Brust, der rezidivierende rechtsseitige Pneumothorax, die Korrelation des Beginns und / oder der Regression der radiologischen Symptome mit dem Beginn und / oder Ende des Menstruationszyklus, das eine oder andere gynäkologische Problem (nämlich. unfruchtbarkeit, Beckenschmerzen, Algomenorrhoe) und Operationen an den Beckenorganen in der Anamnese.
Die diagnostische Chirurgie erfordert einen umfangreichen Einsatz des gesamten Operationsmaterials mit Ausschnittsproben für die histologische Untersuchung aller betroffenen Lungenareale, da die Endometriose-mikroskopischen Merkmale in verschiedenen, auch benachbarten Teilen der Lunge erheblich variieren können. Aus diagnostischer Sicht ist das wesentliche morphologische Unterscheidungsmerkmal der PE eine Kombination der Stabilitäts-, Progressions- oder Regressionszeichen innerhalb derselben oder in den benachbarten Proben des Lungengewebes. Um die endgültige Diagnose des TES zuverlässiger zu machen, ist die Verwendung der umfassenden histologischen und immunhistochemischen Methoden erforderlich. Die genaue Diagnose der Endometriose ist von großer praktischer Bedeutung, da sie Voraussetzung für die Auswahl der adäquaten Behandlung ist.
- Tsvelev YV, Abashin VG, et al. (2007) Endometriose: moderne Ansichten über die Ätiologie, Terminologie und Klassifizierung. Vestnik Rus Militärmedizinische Akademie 4: 42-47 .
- Olive DL, Schwartz LB (1993) Endometriose. N Engl J Med 328: 1759-1769.
- Ozhiganova IN (2009) Endometriose und Endometriose (Arbeitsstandards der postmortalen Untersuchung). SPB. .
- Harada M, Osuga Y, Izumi G, Takamura M, Takemura Y, et al. (2011) Dienogest, eine neue konservative Strategie für extragenitale Endometriose: eine Pilotstudie. Gynecol Endocrinol 27: 717-720. Bergqvist A (1993) Verschiedene Arten der extragenitalen Endometriose: eine Überprüfung. Gynecol Endocrinol 7: 207-221. Joseph J, Sahn SA (1996) Thorakales Endometriose-Syndrom: neue Beobachtungen aus einer Analyse von 110 Fällen. Am J Med 100: 164-170.
- Alifano M, Trisolini R, Cancellieri A, Regnard JF (2006) Thorakale Endometriose: aktuelles Wissen. Ann Thorac Surg 81: 761-769.
- Flieder DB, Moran CA, Travis WD, Koss MN, Mark EJ (1998) Pleuro-pulmonale Endometriose und pulmonale ektopische Deziduose: eine klinisch-pathologische und immunhistochemische Studie von 10 Fällen mit Schwerpunkt auf diagnostischen Fallstricken. Hum Pathol 29: 1495-1503.
- Channabasavaiah AD und Joseph JV (2010) Thoracic endometriosis: revisiting the association between clinical presentation and thoracic pathology based on thoracoscopic findings in 11 patients. Medone. Kapitel 89: 183-188.
- Legras A, Mansuet-Lupo A, Rousset-Jablonski C, Bobbio A, Magdeleinat P, et al. (2014) Pneumothorax bei Frauen im gebärfähigen Alter: eine aktualisierte Klassifikation basierend auf klinischen und pathologischen Befunden. Brust 145: 354-360.11.
- Hobbs JE und Bortnick AR. (1940) Endometriose der Lunge; eine experimentelle und klinische Studie. Am J Obstet Gynecol 40: 832-843.
- Pichurov AA, OrzheshkovskiÄ OV, Dvorakovskaia IV, Romanova LA, Ivanishchak BE, et al. (2014) . Vestn Khir Im I Ich Grek 173: 26-29.
- Sampson JA (1927) Peritoneale Endometriose aufgrund der Menstruationsverbreitung von Endometriumgewebe in die Peritonealhöhle. Bin J Obstet. Gynecol 14: 422-469.
- Adamyan LV, Kulakov VI und Andreeva EN (2006). Endometriose. In: M., Medizina. .
- Agarwal N. und Subramanian AA (2010) Endometriose. Morphologie, klinische Präsentationen und molekulare Pathologie. Joh. 10: 1-9.
- IablonskiÄ PK, Pichurov AA, OrzheshkovskiÄ OV, Petrun’kin AM, Goncharuk IV (2014) . Vestn Khir Im I Ich Grek 173: 89-95.
- Terada Y, Chen F, Shoji T, Itoh H, Wada H, et al. (1999) Ein Fall von endobronchialer Endometriose, der durch Subsegmentektomie behandelt wird. Brust 115: 1475-1478.18. Koizumi T, Inagaki H, et al. (1999) Erfolgreiche Anwendung von Gonadotropin-Releasing-Hormon-Agonisten bei einem Patienten mit pulmonaler Endometriose. Atmung 66: 544-546.
- Golovin DI (1975) Atlas der menschlichen Tumoren. Leningrad, Medizin. .
- Abu-Hijleh MF, Habbal OA, Moqattash ST (1995) Die Rolle des Zwerchfells bei der Lymphabsorption aus der Bauchhöhle. 186: 453-467.