Svag i knæene: Miller Fisher syndrom
Miller Fisher syndrom (MFS), en sjælden, selvbegrænsende variant af Guillain-Barr Lars syndrom (GBS), er et anti-Gk1bigg antistofsyndrom, der påvirker perifere og centrale nervesystemer.1 en akut neuromuskulær polyneuropatisk tilstand, MFS forårsager en stigende lammelse med en klassisk præsentationstriade af oftalmoplegi, ataksi og arefleksi. Forskere beskrev først den kliniske triade i 1932.1 to årtier senere, Canadisk slagtilfælde specialist Charles Miller Fisher var den første til at offentliggøre en rapport i 1956, der beskrev de kliniske fund og definerede tilstanden som en begrænset form for GBS.2
symptomer opstår over flere dage, ofte om vinteren og foråret, typisk efter en virusinfektion, og patienter oplever ofte diplopi som et af de første symptomer. Når en patient præsenterer symptomer som intermitterende esotropi, nedsatte vandrette sysler og faste mydriatiske elever, og din neurologiske undersøgelse er unormal, er det tid til at tænke på GBS, specifikt MFS. Følgende tilfælde illustrerer de relevante tegn og symptomer og afspejler det typiske resultat.
historie
en 27-årig kaukasisk mand præsenteret for VA Eye Clinic i forårsmånederne, der rapporterede akut debut binokulær diplopi, der startede en dag før. Patienten sagde, at den var konstant, men forekom kun ved fjernvisning med genstande forskudt vandret. Der var ingen øjensmerter eller sløret syn forbundet med diplopien. Han klagede også over nylige svimmelhed og balanceproblemer. Han rapporterede om en sinusinfektion med betydelig paranasal overbelastning, der startede en uge før dobbeltsynet. Tidligere okulære og medicinske historier var ikke bemærkelsesværdige; patienten tog i øjeblikket ingen medicin og havde ingen medicinallergier.
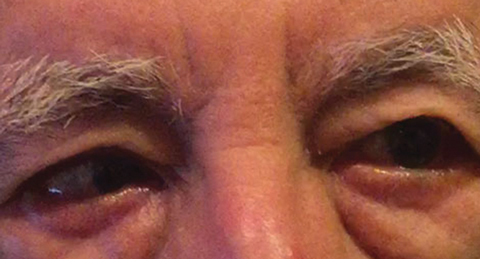
Fig. 1. Den differentielle diagnose efter baseline undersøgelse omfattede en delvis højre CN VI parese, hvilket kunne indikere en vaskulær tilstand, som det ses her hos en anden patient. Klik på billedet for at forstørre. Foto: Michael DelGiodice, OD
diagnostiske Data
ved baseline-undersøgelse var ukorrigerede visuelle akuiteter 20/20-2 OD og 20/25-2 OS. Eleverne var 5 mm lige runde og reaktive over for lys uden afferent pupilledefekt. Ekstraokulære motilities var fulde, glatte og nøjagtige i begge øjne uden begrænsninger. Dækningstest på afstand afslørede en intermitterende fire til seks prisme diopter højre esotropi i primært blik, der forekom cirka 50% af tiden. Udførelse af dækningstest på near afslørede en fire prisme diopter esophoria i primært Blik uden tropia.
selvom det ikke udføres i dette tilfælde, skal klinikere dække test i primært, højre og venstre blik. Hos patienter med diplopi vil kranial nerve seks (CN VI) parese manifestere sig som ikke – komitant afvigelse, værre i højre eller venstre blik, afhængigt af hvilken side parese er på. En dekompenserende phoria vil på den anden side vise comitant afvigelse.
brydningsfejl var -0,50 d kugle OD og -0,75 d kugle os, og synet kunne korrigeres til 20/20 i hvert øje. Intraokulært tryk var inden for normale grænser i begge øjne. Forreste og bageste segmentfund var ikke bemærkelsesværdige i højre og venstre øjne. De optiske nerver syntes sunde med et kop-til-disk-forhold på 0,15 i begge øjne.
differentielle diagnoser omfattede en delvis højre CN VI parese (Figur 1), myasthenia gravis, en komprimeringsproces og en dekompenserende afstand esophoria forårsager en intermitterende højre esotropi. Patienten benægtede enhver tidligere historie med binokulær diplopi.
billeddannelse af hjernen og kredsløbene blev beordret af Øjenklinikken for at udelukke hjerneinddragelse, herunder en komprimerende læsion. Computertomografi (CT) scanninger af hjernen og kredsløb blev udført og fortolket af personalet neuroradiolog. CT blev valgt i stedet for magnetisk resonansafbildning (MRI) på grund af timing og tilgængelighed; test og resultater kunne opnås samme dag med CT i klinikken efter timer. Resultaterne var ikke bemærkelsesværdige uden tegn på intrakraniel blødning, kompressiv læsion eller akut infarkt.
CT af paranasale bihuler afslørede moderat til svær kronisk paranasal sinus sygdom og fuldstændig opacificering af den højre maksillære sinus. Der var ingen forlængelse i kredsløbet. Patientens familielæge blev informeret om patientens symptomer, øjenundersøgelsesresultater og CT-billeddannelsesresultater og startede behandling for maksillær bihulebetændelse med en oral fem-dages doseringspakke og instruerede patienten om at følge op med Øjenklinikken.
patienten vendte tilbage fem dage senere efter at have afsluttet sit orale kursus og sagde, at han ikke oplevede nogen forbedring i afstanden diplopi; derudover oplevede han starten på betydelig fotofobi og periokulær smerte omkring begge øjne. Patienten oplyste, at hans gangubalance og gangvanskeligheder også forværredes. Ved undersøgelse forblev bedst korrigerede visuelle akuiteter 20/20 i højre og venstre øjne. Pupillerne blev dilateret ved 8,5 mm uden reaktivitet over for lys i begge øjne (figur 2). Ekstraokulære motilities afslørede lateral begrænsning med smerter ved bevægelse i højre øje og medial begrænsning med smerter ved bevægelse i venstre øje i overensstemmelse med en højre blik parese (figur 3). Vandrette og lodrette sysler var saccadic med unøjagtige og rykvise bevægelser. Forreste og bageste segmentfund forblev unremarkable OU.
differentielle diagnoser efter oftalmologisk undersøgelse omfattede venstre internuklear oftalmoplegi, højre blik parese og højre blik parese med venstre internuklear oftalmoplegi, som kunne redegøre for ekstraokulære motilitetsfund. Andre forskelle inkluderer en mellemhjerne læsion eller myasthenia gravis. Differentielle diagnoser for pupiludvidelse inkluderer tredje nerve (CN III) parese, traume og farmakologisk udvidelse. Patienten havde ingen andre fund, der var i overensstemmelse med en tredje nerveparese og nægtet traume eller eksponering for farmakologiske midler.
patienten blev henvist til neurologi for yderligere vurdering. Neurologisk undersøgelse rapporterede, at patienten var fuldt opmærksom og orienteret uden tab af ansigtsfølelse. Patienten udviste mild ataksi med vanskeligheder med at gå i tandem og stå fra en hukende position. Proksimal svaghed i både øvre og nedre ekstremiteter og unormale reflekser var til stede. Alle sensoriske modaliteter var intakte. MR og magnetisk resonansangiografi (MRA) i hjernen og kredsløbene var ikke bemærkelsesværdige. Cerebrospinalvæskeprotein blev forhøjet ved 75 mg/dL (referenceområde: 15 mg/dL til 45 mg / dL) uden andre abnormiteter. Elektromyogramtest var ikke bemærkelsesværdig og viste ingen abnormiteter i nerveledningen fra rygsøjlen til fødder og hænder.
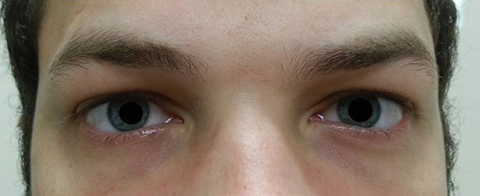
Fig. 2. Patientens pupiller blev udvidet 8,5 mm uden reaktivitet i højre eller venstre øjne. Klik på billedet for at forstørre.
diagnose
patienten præsenterede akutte symptomer på diplopi, ataksi og arefleksi. I betragtning af den intermitterende højre esotropi, nedsatte vandrette sysler, fast mydriatisk pupil, mild ataksi og unormale reflekser ved neurologisk undersøgelse og forhøjet cerebrospinalvæskeprotein blev diagnosen MFS stillet. Patienten blev indlagt på hospitalet for at overvåge for yderligere komplikationer. En øjenplaster blev leveret til patienten for at dække det højre øje efter behov for diplopi.
Der findes i øjeblikket ingen offentliggjorte diagnostiske kriterier for Miller Fisher syndrom. Diagnosen stilles normalt gennem præsentationen af den kliniske triade sammen med billeddannelses-og cerebrospinalvæskestudier. MR er typisk ikke bemærkelsesværdig i tilstanden, selvom nogle undersøgelser har vist centrale læsioner i mellemhjernen, pons og lavere medulla. Elektrofysiologiske undersøgelser viser reduceret eller unormal perifer sensorisk ledning.17
Cerebrospinalvæskeprotein er ofte forhøjet uden andre unormale fund. I en milepælsundersøgelse viste 64,4% af MFS-patienterne forhøjet spinalvæskeprotein.8 en positiv anti-Gk1b IgG antistof test giver mulighed for en endelig diagnose. I en undersøgelse var anti-Gk1b IgG-antistof til stede hos op til 95% af patienterne med tilstanden og fraværende i kontroller.3
neurologen diagnosticerede patienten med MFS baseret på den kliniske triade af oftalmoplegi, ataksi og arefleksi, en umærkelig MR og MRA i hjernen og forhøjet cerebrospinalvæskeprotein. Derfor blev Anti-Gk1b IgG antistof test ikke udført i dette tilfælde.
flere kliniske træk ved MFS ses også i Guillain-Barr Lars syndrom og Bickerstaffs hjernestamme encephalitis, hvilket gør diagnosen udfordrende. Patienter med kun Guillain-Barr Lutra til stede med lemmer svaghed, sensorisk tab, kranial neuropati og arefleksi uden oftalmologiske manifestationer. Patienter med Bickerstaffs hjernestamme encephalitis er typisk til stede med oftalmoplegi, ataksi, hyperrefleksi og en forstyrret bevidsthed. Da flere symptomer og tegn er til stede under alle tre tilstande, anti-Gk1b IgG antistoftiter test er nyttigt for en mere endelig diagnose. Anti-Gk1b-IgG-antistof er positivt hos et stort flertal af Miller Fisher-syndrompatienter sammenlignet med 66% hos Bickerstaffs hjernestamme encephalitis og 26% af Guillain-Barr-patienter med kronisk syndrom.16
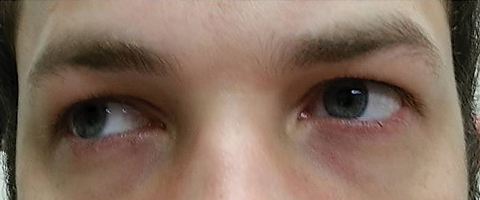
Fig. 3. Ekstraokulære motilities afslørede begrænsning i dekstroversion. Klik på billedet for at forstørre.
behandling og opfølgning
patienten blev evalueret dagen efter indlæggelse, da han sagde, at han ikke oplevede nogen visuelle ændringer eller forbedring i balance. Binokulær diplopi var stadig konstant; derfor forblev det højre øje lappet. Øjensmerter med langt blik og hurtige øjenbevægelser var stadig til stede. Ved begrænset sengeundersøgelse forblev bedst korrigerede visuelle akuiteter 20/20 i højre og venstre øjne. Eleverne blev udvidet ved 8.0 mm i begge øjne med minimal reaktivitet, som var lidt forbedret fra dagen før. Farvesyn var normalt i højre og venstre øjne. Ekstraokulære motilities var fulde i alle kvadranter med smerter, der stadig var til stede i langt vandrette blik. Horisontale sysler forblev saccadiske med rykkede bevægelser og slutpunkt nystagmus. De optiske nerver syntes sunde med forskellige margener og et kop til diskforhold på 0,15 i begge øjne.
to dage efter sagde patienten en forbedring af alle symptomer, og at hans øjne “føler sig bedre i dag, end de har været i et stykke tid.”Øjensmerter og binokulær diplopi blev begge løst. Visuelle acuities forblev 20/20 i højre og venstre øjne. Pupillestørrelserne var 7,5 mm i mørke og 7,0 mm i lys med forbedret direkte og konsensusrespons i begge øjne. Ekstraokulære motilities var fulde i alle kvadranter uden øjensmerter. Horisontale sysler forblev saccadiske med rykkede bevægelser og slutpunkt nystagmus. Neurologisk undersøgelse afslørede unormale reflekser, som forblev stabile. Behandlingsmulighederne for MFS inkluderer plasmaferese og intravenøs (IV) immunoglobulin IgG, men disse blev tilbageholdt i betragtning af forbedringen i oftalmoplegi og ataksi.fire dage senere rapporterede patienten, at alle symptomer stadig forbedredes, med nogle vanskeligheder med at fokusere og spore, mens han brugte computeren. Balancen var 80% løst, og der var få forekomster af fjerndiplopi. Acuities forblev 20/20 OU. Eleverne var 5,5 mm i mørke og 4,0 mm i lys med 3+ direkte og konsensusrespons OU. Ekstraokulære motilities var fulde i alle kvadranter uden øjensmerter. Horisontale sysler blev forbedret uden saccadiske bevægelser. Monokulær indkvartering var normal, som blev målt henholdsvis 8,5 og 9 prisme dioptere OD og OS.
en uge senere rapporterede patienten, at hans syn vendte tilbage til næsten normal uden diplopi og milde vanskeligheder med at fokusere og spore. Balancen blev 100% løst. Visuelle acuities forblev 20/20 i højre og venstre øjne. Elevstørrelser var 5,5 mm i mørke, 4,0 mm i lys med 4+ direkte og konsensusrespons OU. Ekstraokulære motilities var fulde i alle kvadranter uden øjensmerter. Horisontale sysler forbedret uden observerede saccadiske bevægelser. Okulær sundhed var unremarkable ou.
behandlingen blev tilbageholdt i betragtning af opløsningen af oftalmoplegi og ataksi med stabil arefleksi. Fuld genopretning af opthalmoplegi og ataksi tog to uger. Ledelsen omfattede nøje overvågning og opfølgning om fire uger; patienten blev rådet til at vende tilbage hurtigere, hvis nogen af hans symptomer vendte tilbage.
kliniske træk
i velbeskrevne undersøgelser af MFS præsenterede alle patienter den kliniske triade af oftalmoplegi, ataksi og arefleksi.4,5 symptomdebut forekommer typisk over flere dage, og patienter lider af en virusinfektion en til fire uger før de kliniske symptomer begynder.4,5 ifølge en undersøgelse af 50 patienter med tilstanden er det gennemsnitlige interval mellem infektionsdebut og udvikling af neurologiske symptomer otte dage.4 andre tegn på MFS inkluderer sløret tale, synkebesvær og et unormalt ansigtsudtryk med manglende evne til at smile eller fløjte.
oftalmologiske egenskaber. Udøvere skal være på udkig efter mydriasis, tilbagetrækning af låg, akut vinkellukning og diplopi sekundært til nervepalsier, der påvirker CN III, IV og vi.3,8,10,22,24 diplopi er det mest almindelige oftalmologiske symptom rapporteret i mange MFS-undersøgelser.8,16,25,26,27 diplopi er også det første symptom rapporteret hos 38,6% af 223 patienter i en landmark-undersøgelse og 65% af 466 patienter i en anden undersøgelse.8,27 i den anden undersøgelse udviste 100% af patienterne ekstern oftalmoplegi, mens intern oftalmoplegi var til stede hos 35% af patienterne.27 ekstern oftalmoplegi henviser til svækkelse af eksterne ekstraokulære muskler. Intern oftalmoplegi refererer til svækkelse af pupillær sphincter og ciliary muskel. Komplet oftalmoplegi påvirker både ydre og indre muskler.
i en retrospektiv undersøgelse af 19 patienter med MFS, alle præsenteret med en eller flere nervepalsier, der påvirker de ekstraokulære muskler.25 andre undersøgelser viser, at MFS-patienter kan opleve flere kraniale nervepalsier, som kan manifestere bilateralt.22,24,25 et almindeligt fund fundet blandt Anti-Gk1b IgG-positive lidelser er bortførelsesunderskud i overensstemmelse med en ensidig eller bilateral CN vi-parese.26,28 intern oftalmoplegi forårsager pupil mydriasis, hvor pupilens indsnævring til lys og/eller nær stimulering kan variere fra minimal til fraværende.8,26 i en rapport var mydriasis til stede hos 42% af patienterne. 45,7% af MFS-patienter, der forårsager ansigtssvaghed, manglende evne til at smile eller fløjte.8
ataksi. Årsagen til denne kliniske funktion i MFS er ikke fuldt ud forstået. Debat findes om, hvorvidt ataksi er forårsaget af dysfunktion centralt i lillehjernen eller perifert. Den første hypotese, foreslået af Dr. Fisher, postulerede inddragelsen af Ia-afferente neuroner.2 Dette blev understøttet af en anden undersøgelse årtier senere, som viste abnormiteter af Ia-afferente fibre i MFS.11 unormal perifer nerveinddragelse er også blevet foreslået med en uoverensstemmelse mellem proprioceptiv input fra muskelspindler og kinæstetisk information fra fælles receptorer.12
der har også været dokumentation for, at ataksi stammer fra lillehjernen. En overvægt af anti-Gk1b IgG-antistof i lillehjernen blev fundet ved anvendelse af immunocytokemisk farvning af det humane lillehjernen og yderligere bekræftet med vestlige blot-undersøgelser, som viste øget anti-Gk1b IgG-antistof hos MFS-patienter sammenlignet med kontrol, skønt mekanismen for cerebellar involvering ikke er undersøgt.13,14 i 2015 offentliggjorde forskere en sagsrapport fra en MFS-patient, der gennemgik Mr. Der var et reduceret n-acetylaspartat/kreatinforhold, hvilket tyder på cerebellar dysfunktion, som vendte tilbage til normal 2,5 måneder efter genopretning.23
arefleksi. Denne kliniske funktion sammen med depression af dybe senreflekser er et tegn på perifert nervesysteminddragelse i MFS. Elektrofysiologiske undersøgelser har valideret unormal perifer nerveledning i GBS og MFS.3 i en undersøgelse blev 81,6% af MFS-tilfælde præsenteret med arefeksi.8 En anden skelsættende undersøgelse viste, at alle patienter oplevede arefleksi, som stadig var til stede seks måneder efter indtræden.4
hvor almindelig er MFS?
epidemiologiske data om Miller Fisher syndrom er begrænsede. Forekomsten af MFS er ret sjælden, forekommer i 0,09 per 100.000 mennesker årligt.3 MFS forekommer mere almindeligt hos patienter med Guillain-Barr Lars syndrom, fra 3% til 25%.4,6,7 denne forening forekommer mere hos patienter med Fjernøsten-afstamning, hvilket antyder en mulig genetisk komponent til MFS. Den gennemsnitlige alder for indtræden er 43, med en rækkevidde på 13 til 78,5 MFS påvirker mænd dobbelt så meget som kvinder med et forhold på to til 1,03,5 MFS forekommer mere i vinter-og forårssæsonen.5,6,8 den nøjagtige årsag til sæsonbetinget forkærlighed er ikke bestemt, men er sandsynligvis forbundet med den postinfektiøse karakter af tilstanden, da bakterielle og virale infektioner har vist sig at udløse en autoimmun respons, der forårsager produktion af anti-Gk1b IgG-antistoffet i MFS.
Patofysiologi
patofysiologien af Miller Fisher syndrom forstås ikke godt; der findes imidlertid flere hypoteser fra immunologiske og histologiske undersøgelser. Det er velkendt, at tilstanden ligger inden for spektret af anti-Gk1b IgG-antistofsyndromer sammen med Guillain-Barr-syndrom og Bickerstaffs hjernestamme encephalitis. gangliosid gk1b er en gruppe af komplekse lipider involveret i det centrale og perifere nervesystem. Gk1b er en komponent i plasmamembranstrukturen i kraniale nerver, der forsyner de ekstraokulære muskler og er involveret i cellefunktion ved det presynaptiske neuromuskulære kryds.
en autoimmun mekanisme fra en forudgående udløsende infektion vil producere anti-Gk1b IgG antistof, som beskadiger gangliosid Gk1b-funktion, hvilket forårsager demyelinering. Histologiske undersøgelser har vist demyelinering og aksonal hævelse i perifere og oculomotoriske kraniale nerver.15 anti-Gk1bigg-antistoffet er fraværende hos raske patienter, men positivt hos over 90% af patienterne med MFS.16,25
bakterielle og virale infektioner har vist sig at udløse en autoimmun respons, hvilket forårsager produktion af anti-GK 1b IgG-antistoffet. Følgende infektiøse midler, der har været forbundet med MFS, omfatter mycoplasma pneumoni, HIV, Campylobacter jejuni, Hemophilus, Helicobacter pylori og Epstein-Barr-virus.4,16 i en rapport, der så på 466 MFS-patienter, havde 90% en forudgående sygdom, herunder øvre luftvejsinfektion, diarre eller begge dele.27
prognose og behandling
Miller Fisher syndrom er en selvbegrænsende sygdom og har en samlet positiv prognose. Symptomerne forbedres generelt efter et par uger med fuld bedring, der typisk forekommer i to til tre måneder. I en undersøgelse startede bedring med en median på 13 dage fra symptomdebut, og fuldstændig opløsning af oftalmoplegi og ataksi forekom på seks måneder.4,5 tilbagefald har vist sig at forekomme i mindre end 3% af tilfældene.4,5
selvom MFS typisk er selvbegrænsende, har systemiske komplikationer været forbundet med tilstanden. Øvre luftvejsinfektioner er fundet hos 56% Til 76% af MFS-patienter, som kan udvikle sig til åndedrætssvigt, der kræver mekanisk ventilation.4,18,19 andre sjældne alvorlige komplikationer omfatter kardiomyopati, laktatacidose og koma.3,20
behandlingsmulighederne for MFS inkluderer plasmaferese, IV immunoglobulin IgG og overvågning uden behandling. Forskere postulerer, at plasmaferese og IV IgG kan være effektive til at fremskynde opløsningstiden, da antistof Gk1b er IgG i klassen, og halveringstiden for IgG er cirka 21 dage, hvilket er længere end de fem til seks dages halveringstider for IgM og IgA.19 Der er imidlertid ikke udført randomiserede dobbeltblindede placebokontrollerede undersøgelser, der undersøger disse behandlinger.
En retrospektiv undersøgelse viste ikke, at plasmaferese ændrede chancen for fuld bedring og tiden til at løse ataksi og oftalmoplegi; endvidere påvirkede intervallet fra begyndelse til start af plasmaferesebehandling ikke tiden til opløsning eller sværhedsgraden af symptomer ved begyndelsen. Imidlertid indikerer en sagsrapport, at plasmaferese er indikeret, når dyb ataksi, motorisk og respiratorisk svækkelse er til stede.21
patienter bør monitoreres nøje for risiko for at udvikle alvorlige systemiske komplikationer såsom øvre respirationssvigt. Undersøgelser viser ingen signifikant forbedring i restitutionstid med IV IgG eller plasmaferesebehandling i MFS, så overvågning kan være en praktiserende læge bedste mulighed.
selvom det er sjældent, behøver tilstanden ikke at blive udiagnostiseret. Ved at genkende de vigtigste kliniske træk kan praktiserende læger afsløre årsagen til deres patients symptomer og få tillid til en fuld bedring. Dr. med. og Cantrell er personale optometrister på Orlando VA Medical Center. Dr. Cali er en Personale optometrist på Lee County VA Clinic. Forfatterne ønsker at takke Joseph Miller, od, Paul Gruosso, OD og Vanessa Santos, OD, for hjælp til dette manuskript.
1. Collier J. perifer neuritis: Morisa-forelæsningerne. Edinburgh Med J. 1932: 39: 601-18.
2 . Fisher M. En usædvanlig variant af akut idiopatisk polyneuritis (syndrom oftalmoplegi, ataksi, og arefleksi). N Eng J Med. 1956:255:57-65.
3. Lo YL, et al. Klinisk og immunologisk spektrum af Miller Fisher syndrom. Muskel Nerve. 2007:36(5):615-27.
4. Mori M, Malaysia S, Fukutake T, et al. Kliniske træk og prognose for Miller Fisher syndrom. Neurologisk. 2001:56(8): 1105-6.
5. Mori M, Malaysia S, Fukutake T, et al. Plasmapharesis og Miller Fisher syndrom: analyse af 50 på hinanden følgende tilfælde. J Neurol Neurosurg Psych. 2002:72:680.
6. Cl, Tsai CP. Miller Fisher syndrom: en hospitalsbaseret retrospektiv undersøgelse. Euro J Neurol. 2000:44(2):79-85.
7. Cheng BC, Chang VN, Chang CS et al. Guillain-Barr-syndrom: kliniske træk, prognostiske faktorer og terapeutiske resultater. Euro J Neurol. 2003:10 (6):655-62.
8. Berlit P, Rakicky J. Miller Fisher syndrom. Gennemgang af litteratur. J klinisk neuro-oftalmologi. 1992:12:57-63.
9. Lyu RK, Tang LM, Cheng SY, et al. Guillain-Barr-syndrom: en klinisk undersøgelse af 167 patienter. J Neurol Neurosurg Psych. 1997:63:494-500.
10. Tatsomoto M, Odaka M, Hirata K, Yuki N. isoleret abducens parese som en regional variant af Guillain-Barr Lars syndrom. J Neurol Sci. 2006:243:35-8.
11. Ja, hvid JC. Korrelation af 1A afferent ledning med ataksi af Fisher syndrom. Muskel Nerve. 1986:9:327-32.
12. Das P, Bisvask S, et al. Miller Fisher-variant af guillain-Barr Kris syndrom: en sagsrapport og klinisk gennemgang. Bangabandhu Sheikh Mujib medicinsk Univer J. 2012:5(1):69-71
13. Kornberg AJ, Pestronk A, Blume GM, et al. Selektiv farvning af det cerebellære molekylære lag ved serum IgG af Miller Fisher og relaterede syndromer. Neurologisk. 1996:47:1317-20.
14. Inoue N, Koh C, Ivahashi T. påvisning af serum anticerebellære antistoffer hos patienter med Miller Fisher syndrom. Euro J Neurol. 1999:42:230-4.
15. Barontini F, Di Lollo S, Maurri S, Lambruschini P. lokalisering af den patologiske proces i Miller Fisher syndrom. Italien J Neurol Sci. 1992:13:221-5.
16. Koga M, Yuki N, Takahashi M, et al. Tæt tilknytning af IgA-anti-gangliosid-antistoffer med forudgående Campylobacter jejuni-infektion i Guillain-Barr Karrus og Fishers syndromer. J Neuroimmunol. 2003:141:112-7.
17. Guiloff RJ. Perifer nerveledning i Miller Fisher syndrom. J Neurol Neurosurg Psychiat. 1977:40:801-7.
18. Chikakiya H, Kunishige M, Yoshino H, et al. Forsinket motorisk og sensorisk neuropati hos en patient med hjernestammen encephalitis. J Neurol Sci. 2005:234:105-8.
19. Arakata Y, Yoshimuro M, Kobayashi S, et al. Anvendelsen af intravenøs immunoglobulin i Miller Fisher syndrom. Hjerne Udvikle J. 1993:15:231-3.
20. Matsumoto H, Kobayashi O, Tamura K, et al. Miller Fisher syndrom med forbigående koma: sammenligning med bickerstaffs hjernestamme encephalitis. Hjerne Udvikle J. 2002: 24: 98-101.
21. Yeh JH, Chen HH, Chen JR, et al. Miller Fisher syndrom med central involvering: vellykket behandling med plasmaferese. Therap Aferesedialyse J. 1999: 3: 69-71.
22. Papanikolaou T, Cath G, Boothman B, et al. Case report: akut bilateral oftalmoparese med pupilær arefleksikal mydriasis i Miller-Fisher syndrom behandlet med intravenøs immunoglobulin. J Ophthalmol. 2010; artikel-ID 291840.
23. Sandler RD, Hoggard N, Hadjivassiliou M. Miller-Fisher syndrom: er ataksi central eller perifer? Cerebellum Ataksier. 2015:2:3.
24. Det er en af de mest populære måder at gøre det på. Progressiv subakut Miller-fisher syndrom med succes behandlet med plasmaferese. Polsk J Neurol Neurosurg. 2015;49(2):137-8.
25. San-Juan OD, Martinus-Herrera JF, Moreno Garca J, et al. Miller Fisher syndrom: 10 års erfaring i et center på tredje niveau. Euro Neurol. 2009; 62: 149-54
26. Snyder LA, Rismondo V, Miller NR. Fisher-varianten af Guillain-Barr-syndrom (Fisher-syndrom). J Neuroophthalmol. 2009 Dec;29 (4): 312-24.
27. S, Odaka M, et al. Bickerstaffs hjernestamme encephalitis og fisher syndrom danner et kontinuerligt spektrum: klinisk analyse af 581 tilfælde. J Neurol. 2008;255:674-82.
28. Yuki N. akut parese af ekstraokulære muskler forbundet med IgG anti-Gk1b antistof. Ann Neurol 1996; 39: 668-72.