Lavspændingsglaukom: en Oksymoron i oftalmologi
foreslået henvisning til denne artikel: Costagliola C, Agnifili L, Mastropaska L, distanse A. Lavspændingsglaukom: en Oksymoron i oftalmologi. Forrige Kronisk Dis 2019; 16:180534. DOI:http://dx.doi.org/10.5888/pcd16.180534external ikon.
udtrykket glaukom henviser til en gruppe af okulære tilstande, der er kendetegnet ved progressiv synsnerveskade og tab af synsfelt (1). Glaucomatøs optisk neuropati skyldes det progressive tab af retinale ganglionceller; forhøjet intraokulært tryk (IOP) er en vigtig risikofaktor. IOP kan virke direkte, ved en mekanisk virkning eller indirekte ved at påvirke blodforsyningen (2). Faktorer, der påvirker progressionen af glaukomatøs optisk neuropati, inkluderer ældre alder, avanceret sygdomsstadium, højere IOP og skiveblødninger (3). Hos patienter med primær åbenvinklet glaukom (POAG) er den øgede modstand mod vandig udstrømning gennem det trabekulære netværk den største synder for forhøjet IOP. På trods af tilstrækkelig kontrol med IOP kan glaucomatøs optisk neuropati dog ofte fortsætte med at udvikle sig. Således genkendes faktorer, der ikke er relateret til IOP, hvor det vigtigste er et fald i blodforsyningen til synsnerven (4).
andre faktorer, der ikke er relateret til IOP, omfatter glutamattoksicitet, oksidativ stress, autoimmunitet og vaskulær dysregulering (3). Lavspændingsglaukom (LTG) defineres som en form for glaukom, der nøje efterligner POAG, men IOP-niveauer er inden for det normale interval, og den sandsynlige patogenese er vaskulær.
de kontroversielle spørgsmål er 1) er LTG en sygdom på spektret af POAG (på venstre side af fordelingen af IOP, på de laveste niveauer)?, 2) er optisk diskudseende sekundært til synsnervehypoperfusion på grund af vaskulære sygdomme?, eller 3) skal LTG inkluderes i et spektrum af medfødte og erhvervede optiske neuropatier, der kan simulere glaukomatøs optisk neuropati?
Top
er Lavspændingsglaukom en sygdom på spektret af primær åbenvinklet glaukom?
da Albrecht von Graefe i 1857 beskrev en form for glaukom, der manifesterede skade på synsnervehovedet og en åben forkammervinkel, med IOP inden for referenceområdet, blev digital palpationstonometri betragtet som guldstandarden. Hvis han havde brugt et indtryk tonometer til at måle IOP, ville den største mangel ved tonometrien have været, at den fortrængte så meget væske ved kontakt med øjet, at de målte aflæsninger ville være meget variable og unøjagtige. Omvendt, hvis han havde brugt indrykningstonometri, ville det ikke have overvejet den fejlklassificering, der skyldes tilstedeværelsen af en tynd central hornhinde (1). Mange diagnoser af LTG var for øjne med tynde hornhinder og var baseret på falske lave værdier for IOP, et fund, der rejser tvivl om diagnosen LTG (5). Desuden skal fraværet af forhøjet IOP findes på målinger udført mere end en gang eller om dagen, da IOP viser daglige og natlige udsving hos raske forsøgspersoner og endnu mere hos patienter med POAG eller LTG (6). For variationer i IOP kan der skelnes mellem 3 populationer af LTG-patienter: patienter uden IOP-udsving, patienter med daglig IOP-akrofase (toppen eller toppen af en cyklus) og patienter med natlig IOP-akrofase (7). Patienter i de sidste 2 kategorier bør betragtes som ægte POAG-patienter snarere end LTG-patienter, hvor glaukomatøs optisk neuropati forekommer på trods af normal IOP. Det er sandsynligt, at patienter med en daglig eller natlig akrofase er blevet indskrevet i undersøgelser baseret på den mekaniske teori; reduktion af IOP kan kun bremse udviklingen af synsfelttab hos disse patienter (8). Data fra Lavtryksglaukombehandlingsundersøgelsen fremhævede IOP ‘ s rolle i LTG-patogenese; progressionen af synsfelttab blev reduceret med 9,1% med timolol 0,5% og med 39,1% med brimonidin 0,2% efter 2 års behandling (8). I denne undersøgelse blev IOP-værdier imidlertid udelukkende registreret i dagtimerne. Hvorvidt patienter med et dårligere synsfelt havde IOP natlig akrofase vides således ikke. Andre undersøgelser af asymmetrisk LTG rapporterede, at øjet med højere IOP viser større glaukomatøs skade end øjet med lavere IOP, hvilket opretholder IOP ‘ s rolle i patogenesen (9). Alligevel blev IOP i alle disse kliniske forsøg kun målt i kontortiden; således blev opførelsen af natlig IOP ikke registreret. En nylig undersøgelse, hvor nychthemeral IOP-kurver blev evalueret med en telemetrisk sensor, viste en natlig akrofase med IOP-pigge hos patienter med LTG, skønt disse pigge var på signifikant lavere niveauer end piggene fundet blandt patienter med POAG (7). Denne undersøgelse rapporterede, at IOP toppede om natten hos 40% til 80% af patienterne med normal spændingsglaukom, og mønsteret hos disse patienter svarede til mønsteret hos patienter med POAG. I 24-timers kurver havde patienter med LTG og POAG mere udtalt mønstre af IOP om aftenen og natten end om morgenen med flere toppe og større IOP-udsving i løbet af natten end om aftenen (7). Andre faktorer kan bekræfte hypotesen om en primær IOP-relateret mekanisk stress i LTG, såsom tilstedeværelsen af ændringer i de vandige humorudstrømningsveje svarende til dem, der forekommer i POAG (10).
hos patienter, hvor LTG kan betragtes som en sygdom på spektret af POAG, skal diagnostiske og terapeutiske strategier svarende til dem for patienter med hyperbar glaukom implementeres ved hjælp af en øjenlæge (figur).
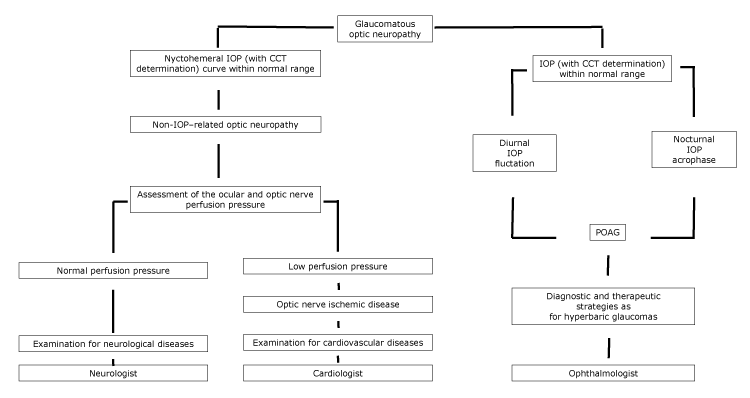
figur.
foreslået rutediagram over optisk neuropati med specialisthenvisning i henhold til de nychthemeral IOP-egenskaber. Forkortelser: CCT, Central hornhindetykkelse; IOP, intraokulært tryk; POAG, primær åbenvinklet glaukom.
Top
er optisk Diskudseende sekundært til optisk Nervehypoperfusion på grund af vaskulære sygdomme?
hos patienter med LTG og normale nychthemeral IOP-kurver kan mekaniske faktorer ikke være ansvarlige for optisk neuropati; trykuafhængige faktorer kan være involveret, hvor vaskulære ændringer potentielt er de vigtigste (5). En glaucomatøs-lignende optisk neuropati kan observeres hos patienter med en kardiovaskulær hændelse eller med kronisk aterosklerose eller obstruktiv arteriel sygdom (11). Nedsat blodstrømningshastighed i retrobulbararterier og i cerebral kredsløb, lavt diastolisk blodtryk og mindre central retinal kardiameter er også observeret hos patienter med LTG (5). Hos disse patienter skyldes sygdomspatogenesen et nedsat okulært perfusionstryk, hovedsageligt forbundet med primær vaskulær dysregulering eller til en generaliseret dysfunktion i endotel-eller autonomt nervesystem (5,11). Det er imidlertid uklart, om disse faktorer var årsagen eller resultatet af den optiske neuropati. Fra et klinisk synspunkt viser LTG en højere forekomst af skiveblødninger og er hyppigere forbundet med vaskulære sygdomme som migræne, obstruktiv søvnapnø eller Raynauds syndrom end med IOP (5). Endelig viser omkring halvdelen af LTG-patienter med præperimetrisk sygdom skadeprogression på trods af normale IOP-værdier (12). Alle disse resultater tyder på den vigtige rolle vaskulær dysregulering.
hos patienter med hjerte-kar-sygdomme kan optic disc cupping have tendens til ikke at udvikle sig, hvis den underliggende årsag til optisk neuropati er blevet kontrolleret. Desuden kan LTG-patienter vise cirkumpapillær atrofi såvel som cerebrale kortikale mikroinfarkter, som er tegn på iskæmi (5). Hos patienter, hvor vaskulære sygdomme inducerer en synsnervehypoperfusion, skal en komplet diagnostisk undersøgelse for hjerte-kar-sygdomme udføres ved hjælp af en kardiolog (figur).
Top
skal LTG inkluderes i et spektrum af medfødte og erhvervede optiske neuropatier, der kan simulere en Glaukomatøs optisk neuropati?
når de hyppigere årsager til optic disc cupping er udelukket, bør muligheden for en neurodegenerativ optisk neuropati overvejes. Disse tilfælde er de mest frustrerende, fordi optisk diskskade skrider frem, selv efter at IOP er blevet sænket. Mange medfødte og erhvervede optiske neuropatier er inkluderet i denne gruppe af tilfælde, og differentiering mellem glaucomatous og nonglaucomatous cupping kan være udfordrende selv for erfarne observatører (13). Blandt de medfødte former for optisk skivekopping, megalopapilla, autosomal dominerende optisk atrofi og Leber arvelig optisk neuropati kunne producere en optisk skiveudgravning, der simulerer glaukomatøs optisk neuropati.
de erhvervede neuropatier kan være sekundære til inflammatoriske, komprimerende, toksiske og traumatiske årsager. Optisk neuritis kan producere en stigning i cup-to-disc-forholdet, der, selvom det er ensidigt, kan forveksles med glaukomatøs optisk neuropati. Kompressive læsioner inklusive meningiom, hypofyseadenom, craniopharyngioma og indre carotisarterieaneurisme kan føre til asymmetrisk optisk disk cupping og fejlagtigt tilskrives LTG. Methanol og ethambutolforgiftning kan producere en bilateral optisk disk cupping svarende til glaukomatøs optisk neuropati, sekundært til aksonalt tab. Således, når en asymmetrisk forstørret kop observeres, er yderligere neuro-oftalmologisk undersøgelse nødvendig (13).
endelig har aldring en hovedrolle blandt forhold, der fører til optisk disk cupping. Harju et al fandt, at graden af optisk disk cupping steg hos raske ældre undersøgelsesdeltagere på grund af fysiologisk fibertab. Deres studiepopulation var passende og repræsenterede et sæt sunde øjne uden glaukom; gennem 11 års opfølgning udviklede ingen undersøgelsesdeltagere ændringer i synsfeltet, og der blev ikke registreret nogen signifikant stigning i IOP (14). I sidstnævnte tilfælde skal en fuldstændig diagnostisk undersøgelse for neurologiske sygdomme udføres ved hjælp af en neurolog (figur).
forbedringer i diagnostiske teknikker gør det lettere end før at klassificere optisk disk cupping; en beskrivelse af optiske diskegenskaber kombineret med billeddannelse af nethindens nervefiberlag og optisk disktopografi tillader differentiering mellem glaucomatøs og ikke-glaucomatøs optisk disk cupping. Desuden hjælper en omhyggelig analyse af patientens historie sammen med morfologisk og funktionel vurdering af optisk nerve til at identificere lidelser.udtrykket LTG kunne være en nostalgisk hukommelse fra fortiden, når en defineret diagnose ikke var mulig. Brug af udtrykket er som at bruge ordet “feber”, når der ikke er nogen høj temperatur eller sige festina lente (“mere hast, mindre hastighed”). Udtrykket LTG kan være vildledende eller unøjagtigt, fordi det henviser til et mekanisk problem med IOP, mens optisk skivekopping og synsfelttab i øjne med normalt intraokulært tryk skyldes andre faktorer. Derfor bør øjenlæger i nærvær af optisk skivekopping med normal IOP undersøge andre sandsynlige årsager til synsnerveskader udover intraokulært tryk.
Top
anerkendelser
denne undersøgelse modtog intet specifikt tilskud fra noget finansieringsbureau i den offentlige, kommercielle eller nonprofit sektor.
Top
forfatterinformation
tilsvarende forfatter: Luca Agnifili, MD, PhD, Ophthalmology Clinic, Via dei Vestini, 66100, Chieti (CH), Italien. Telefon: +39-0871-358489. E-mail: [email protected].
Forfattertilknytninger: 1institut for medicin og Sundhedsvidenskab, Molise Universitet, Campobasso, Italien. 2afdelingen for medicin og aldrende videnskab, oftalmologi klinik, University G. d’Annunzio of Chieti-Pescara, Chieti, Italy.
Top
- Coleman AL, Miglior S. Risk factors for glaucoma onset and progression. Surv Ophthalmol 2008;53(6, Suppl):S3–10. CrossRefexternal icon PubMedexternal icon
- Costagliola C, dell’Omo R, Romano MR, Rinaldi M, Zeppa L, Parmeggiani F. Pharmacotherapy of intraocular pressure: part I. Parasympathomimetic, sympathomimetic and sympatholytics. Expert Opin Pharmacother 2009;10(16):2663–77. CrossRefexternal icon PubMedexternal icon
- Weinreb RN, Aung T, Medeiros FA. The pathophysiology and treatment of glaucoma: a review. JAMA 2014;311(18):1901–11. CrossRefexternal icon PubMedexternal icon
- Cherecheanu AP, Garhofer G, Schmidl D, Werkmeister R, Schmetterer L. Ocular perfusion pressure and ocular blood flow in glaucoma. Curr Opin Pharmacol 2013;13(1):36–42. CrossRefexternal icon PubMedexternal icon
- Mastropasqua R, Fasanella V, Agnifili L, Fresina M, Di Staso S, Di Gregorio A, et al. Advance in the pathogenesis and treatment of normal-tension glaucoma. Prog Brain Res 2015;221:213–32. CrossRefexternal icon PubMedexternal icon
- Moon Y, Lee JY, Jeong DW, Kim S, Han S, Kook MS. Relationship between nocturnal intraocular pressure elevation and diurnal intraocular pressure level in normal-tension glaucoma patients. Invest Ophthalmol Vis Sci 2015;56(9):5271–9. CrossRefexternal icon PubMedexternal icon
- Agnifili L, Mastropasqua R, Frezzotti P, Fasanella V, Motolese I, Pedrotti E, et al. Circadian intraocular pressure patterns in healthy subjects, primary open angle and normal tension glaucoma patients with a contact lens sensor. Acta Ophthalmol 2015;93(1):e14-21. Crossrefekstern ikon Pubmedekstern ikon
- De Moraes CG, Liebmann JM, Greenfield DS, Gardiner SK, Ritch R, Krupin T; studiegruppe med Lavtryksglaukombehandling. Risikofaktorer for synsfeltprogression i lavtryksglaukombehandlingsundersøgelsen. Am J Ophthalmol 2012; 154(4):702-11. Krydsreferent ikon Pubmedeksternt ikon
- Cartre MJ, Anderson DR. korrelation af asymmetrisk skade med asymmetrisk intraokulært tryk i normalspændingsglaukom (lavspændingsglaukom). Arch Ophthalmol 1988; 106(7):898-900. CrossRefexternal icon PubMedexternal icon
- Agnifili L, Carpineto P, Fasanella V, Mastropasqua R, Zappacosta A, Di Staso S, et al. Conjunctival findings in hyperbaric and low-tension glaucoma: an in vivo confocal microscopy study. Acta Ophthalmol 2012;90(2):e132–7. CrossRefexternal icon PubMedexternal icon
- Hayreh SS, Jonas JB. Appearance of the optic disk and retinal nerve fiber layer in atherosclerosis and arterial hypertension: an experimental study in rhesus monkeys. Am J Ophthalmol 2000;130(1):91–6. CrossRefexternal icon PubMedexternal icon
- Collaborative Normal-Tension Glaucoma Study Group. Comparison of glaucomatous progression between untreated patients with normal-tension glaucoma and patients with therapeutically reduced intraocular pressures. Am J Ophthalmol 1998;126(4):487–97. CrossRefexternal icon PubMedexternal icon
- Fraser CL, White AJ, Plant GT, Martin KR. Optic nerve cupping and the neuro-ophthalmologist. J Neuroophthalmol 2013;33(4):377–89. PubMedexternal icon
- Harju M, Kurvinen L, Saari J, Vesti E. Change in optic nerve head topography in healthy volunteers: an 11-year follow-up. Br J Ophthalmol 2011;95(6):818–21. CrossRefexternal icon PubMedexternal icon
Top