indlæg tagget”Mo teori; cycloaddition; organisk kemi; HOMO; LUMO; konjugeret system”
et af de mest udfordrende begreber i konjugerede systemreaktioner er molekylære orbitale interaktioner eller Mo teori. Det grundlæggende i dette princip kan være svært at forstå, men vil være meget informativt til at forudsige de korrekte reaktionsbetingelser og resultatet af reaktionen, hvis du forstår dem, hvilket vil give dig en stor fordel ved fremtidige prøver og eksamener. Vi hos StudyOrgo har udtænkt en simpel forklaring på det grundlæggende til Mo teori for at hjælpe dig med dine studieforberedelser.
principper for Mo-teori
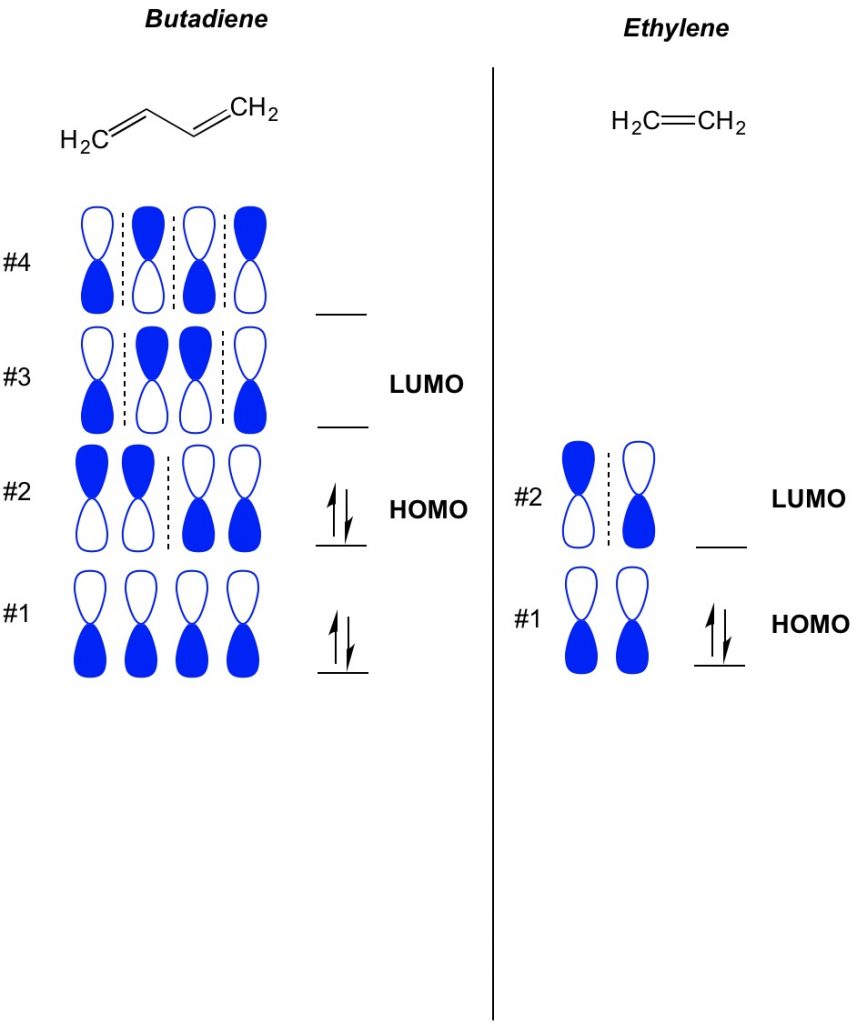
det grundlæggende koncept for Mo-teori er at beskrive de skiftende mønstre af orbitaler, der findes i pi-bindingssystemer. Vi beskriver orienteringen af hver halvdel af dumbbell orbital centreret omkring et atom som værende fed eller åben. Husk, at der er bonding og antibonding orbitaler. I det væsentlige opfører orbitaler med lavere antal noder (skifter i orienteringen af dumbbell orbital, som vi viser med den stiplede linje) mere som bonding orbitaler, mens orbitaler med højere antal noder opfører sig som anti-bonding orbitaler. For at bestemme, hvilke orbitaler der er optaget på dit molekyle, skal du blot tælle, hvor mange pi-bindinger du har i dit konjugerede system. Nedenfor er et eksempel på butadien. Det har 4 pi elektroner, så vi fylder de laveste molekylære orbitaler først, to i hver orbital. Derfor er den højeste besatte molekylære orbital eller HOMO i butadien #2. Som et resultat er den laveste ubesatte molekylære obital eller LUMO i butadien #3. Vi kan udvide dette til ethylen og se, at med 2 pi-elektroner er molekylær orbital #1 HOMO og molekylær orbital #2 er LUMO.
Cycloadditions Mo teori
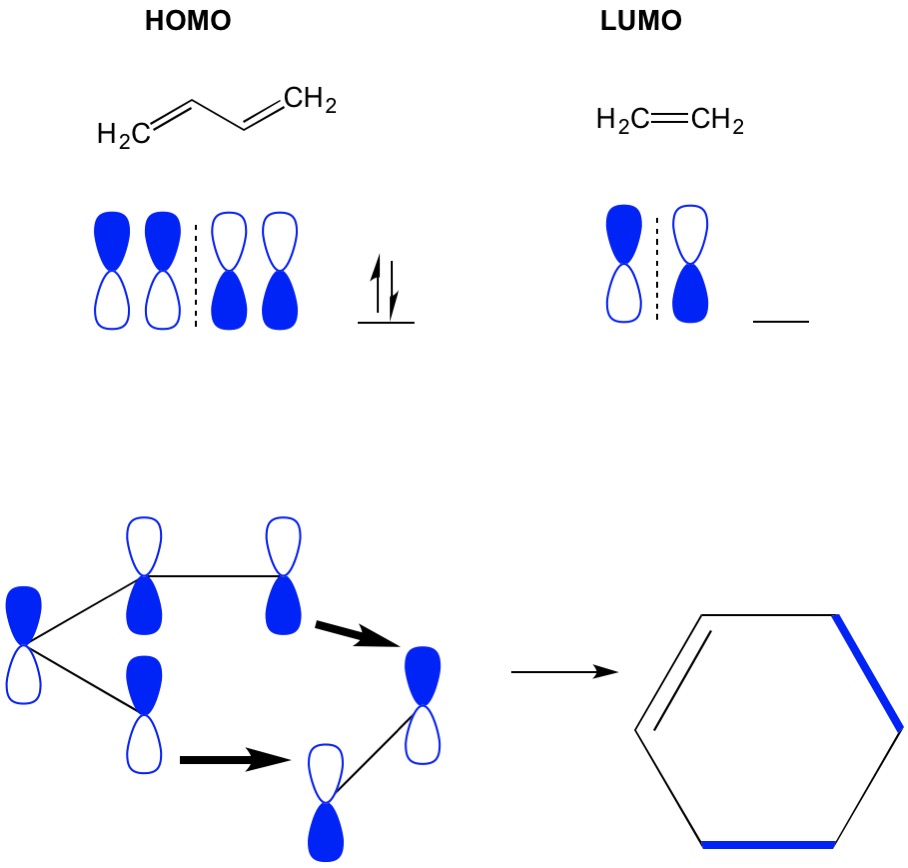
Husk, at cycloadditionsreaktioner beskriver dannelsen af nye C-C sigma-bindinger gennem omlejring af pi-elektronerne i et konjugeret system. Derfor er vi nødt til at bruge pi-elektronernes molekylære orbitaler til at drive reaktionen. Lad os tage reaktionen af butadien med ethylen, den mest forenklede Diels Alderreaktion (4+2 cycloaddition). Vi starter med det mest konjugerede molekyle, butadien og undersøger dets HOMO. Så ser vi på det mindst konjugerede molekyle, ethylen og undersøger dets LUMO. Hvorfor? Vi har brug for elektronerne fra en HOMO til at strømme fra et molekyle til et andet, så vi er nødt til at bruge LUMO orbital, der ikke er optaget til denne proces. Vi ser, at knudepunkter i HOMO og LUMO justeres; det er de åbne og lukkede halvdele af håndvægte justeres. Dette fører til en fremadrettet reaktion og dannelse af produktet, cycloheksen.
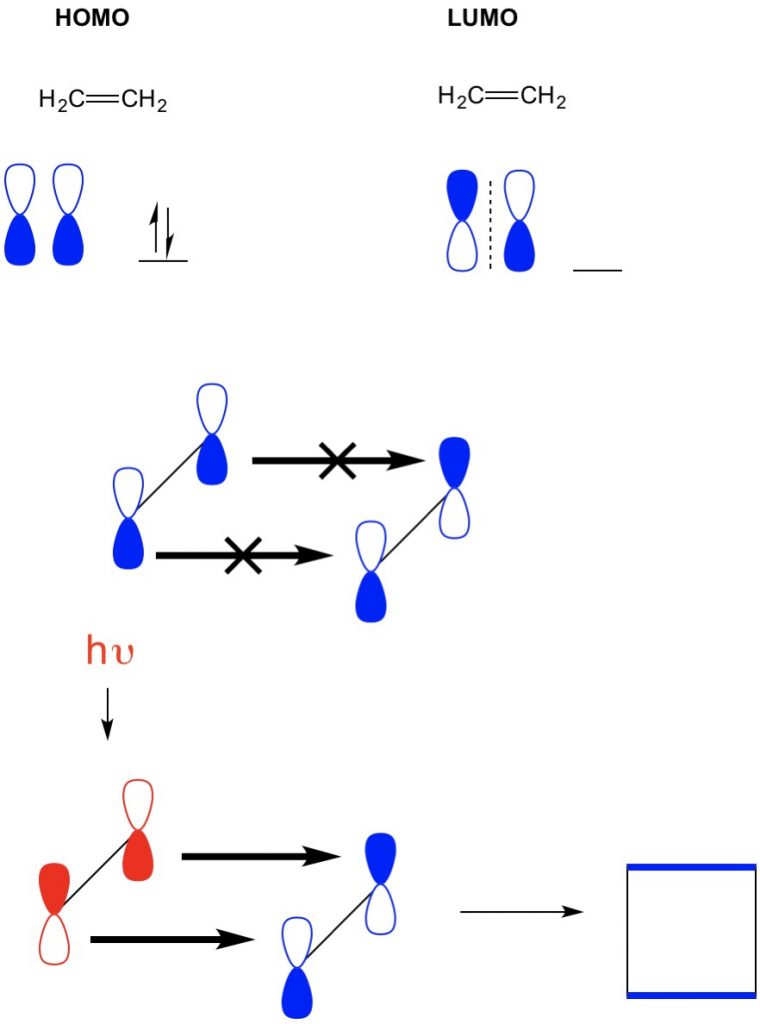
i et andet eksempel, hvor vi har en (2+2 cycloaddition), ser vi HOMO og LUMO af ethylen ikke justere således forbyder reaktionen. Vi har dog evnen til at ophidse elektroner fra HOMO til en højere orbital ved hjælp af lys (hv) eller varme og dermed ændre HOMO. Vi gennemgår dette koncept i detaljer i en tidligere artikel. Når vi gør dette, HOMO af ophidset ethylen og LUMO af jordtilstandsethylen justeres, og reaktionen producerer cyclobutan.
Vi håber, at denne beskrivelse har hjulpet med at afklare dette begreb Mo teori. Dette er et eksempel på de klare og enkle udstationeringer, vi har forberedt på over 175 reaktioner, der almindeligvis ses i Orgo1 og Orgo2 kurser. Tilmeld dig i dag for dine studieforberedelsesbehov!